内质网应激凋亡途径对H9C2细胞缝隙连接蛋白43表达的影响及稳心颗粒的干预研究△
黄涯,刘珂珂,吕梦,娄利霞,程涓,聂波,张冬梅,吴爱明*,赵明镜,商洪才
1.北京中医药大学 东直门医院 中医内科学教育部和北京市重点实验室,北京 100700;2.北京中医药大学 东直门医院 病理科,北京 100700
恶性心律失常是诸多心脏疾病中最常见的并发症之一[1]。目前临床上所使用的抗心律失常药物多以离子通道阻滞剂为主,存在一些不良反应,并且在降低死亡风险及改善预后方面尚不令人十分满意[2]。心肌缝隙连接重构是心肌损伤后恶性心律失常发生的重要病理学基础之一[3],其核心是缝隙连接蛋白(Cx)表达的异常,其中在心肌中表达最多的为Cx43。因此,研究Cx43的病理变化及其发生机制对心律失常的防治具有积极意义[4]。
稳心颗粒经过长期临床实践,在心律失常的防治方面表现出良好的疗效。前期动物实验发现稳心颗粒具有减轻心肌损伤、抑制凋亡的作用[5]。心肌凋亡被抑制时能够逆转Cx的降解过程[6],而内质网应激是细胞凋亡的关键途径之一。因此,本研究在细胞水平,采用毒胡萝卜素(thapsigargin,TG)诱导内质网应激凋亡模型,探讨内质网应激凋亡途径对Cx43表达的影响,同时观察稳心颗粒能否通过内质网应激凋亡途径调节Cx43的表达水平,为深入探讨稳心颗粒防治心律失常的作用机制提供参考。
1 材料
1.1 细胞
大鼠心肌细胞H9C2来源于大鼠胚胎期心脏组织,购自中国医学科学院基础医学研究所细胞资源中心。
1.2 试药
稳心颗粒(无蔗糖型,山东步长制药股份有限公司,批号:1806010);TG(批号:67526-95-8)、抑制剂salubrinal(Sal)、二甲基亚砜(DMSO),美国Sigma公司。DMEM培养基、胎牛血清(FBS)、胰蛋白酶,美国Gibco公司;双抗(美国Caisson公司);磷酸盐缓冲液(PBS,美国Hyclone公司);Cx43、天冬氨酸胱氨酸特异性蛋白酶-12(Caspase-12)抗体,英国Abcam公司;葡萄糖调节蛋白78(GRP78)、C/EBP-同源蛋白(CHOP)抗体,美国Proteintech公司;其他试剂均为国产分析纯。
1.3 仪器
MCO-20AIC型CO2培养箱(日本Sanyo公司);SVE-4AL型垂直流超净工作台(新加坡Esco公司);Olympus Bx60型光学倒置显微镜(日本Olympus公司);Varioskan LUX型酶标仪(美国Thermo Scientific公司);CytomicsTMFC 500型单激光流式分析仪(美国贝克曼库尔特公司)。
2 方法
2.1 H9C2细胞的培养
根据ATCC推荐,使用含糖4.5 g·L-1的DMEM培养液配制成含10%FBS的完全培养基,添加双抗(青霉素100 U·mL-1,链霉素100 μg·mL-1);细胞接种透气培养瓶或培养皿中,置于37 ℃、5%CO2的恒温孵育箱中静置培养。培养24~48 h,待细胞汇合度达到80%~90%并处于稳定状态,进行传代或给药处理。
2.2 溶液配制
TG粉末用DMSO配制成1 mmol·L-1原液。Sal溶液为DMSO溶解的10 mmol·L-1原液。取稳心颗粒粉末配制成100 g·L-1的原液。所有试剂均经0.22 μm滤网滤过除菌。
2.3 CCK-8比色分析法筛选药物浓度及作用时间
采用CCK-8法检测实验所用试剂对H9C2细胞增殖活性的影响。将细胞稀释至6×104个/mL,接种在96孔板中,每孔100 μL,贴壁生长24 h。实验药物均用完全培养基进行稀释,根据试剂说明书和文献方法[7],设置TG的浓度梯度为0.01、0.05、0.10、0.50、1.00 μmol·L-1,作用时间为12、24、48、72 h,Sal和稳心颗粒的浓度分别为0.1、1.0、10.0、20.0、30.0、40.0、50.0、75.0、100.0 μmol·L-1和0.5、1.0、10.0、50.0 g·L-1,作用时间均为24 h。同时设置本底孔减少误差,药物刺激不同时间后加入CCK-8试剂溶液10 μL,反应1.5 h后使用酶标仪在450 nm处测定吸光度(A)值,根据公式(1)计算细胞存活率。
细胞存活率=A药物/A对照×100%
(1)
2.4 光镜下观察各组H9C2细胞形态学改变
将细胞接种在6孔板中,6000个/孔,贴壁生长24 h后分为对照组、模型组、Sal(20 μmol·L-1)组和稳心颗粒(10 g·L-1)组。除对照组外,其余各组细胞加入TG 0.10 μmol·L-1诱导内质网应激凋亡模型。各组加入药物作用24 h后,在光镜下观察细胞生长情况及形态特征,并拍摄图像。
2.5 流式细胞术检测细胞凋亡
采用Annexin/PI双染法对细胞进行荧光标记,使用流式分析仪检测。将细胞接种在6孔板中,6000个/孔,按照2.4项下分组对应处理,药物作用24 h后收集细胞,胰酶消化,离心,PBS重悬,重复2次,加入Annexin/PI试剂盒中的Binding buffer 500 μL,重悬细胞,混匀,加入Annexin试剂5 μL,混匀,加入PI试剂5 μL,混匀,避光反应15 min,使用流式分析仪检测分析。
2.6 Western blotting法检测蛋白表达
将细胞接种在6孔板中,6000个/孔,按照2.4项下分组对应处理,药物作用24 h后弃去上清,PBS冲洗2遍,每孔加入100 μL细胞裂解液,在冰上静置10 min,每5 min摇晃混匀1次,收集6孔板中的液体在4 ℃条件下离心,收集上清,蛋白采用BCA法定量,SDS-聚丙烯酰胺凝胶(PAGE)进行电泳后将蛋白转移到NC膜上,使用封闭液室温孵育1 h,加入一抗GRP78(1∶1000)、CHOP(1∶2000)、Caspase-12(1∶500)、Cx43(1∶8000)、GAPDH(1∶5000),4 ℃孵育过夜,三乙醇胺缓冲盐水溶液(TBST)冲洗,室温孵育二抗(1∶5000),TBST冲洗,ECL发光液显影,使用Image pro 6.0对目的蛋白表达量进行分析。
2.7 统计学处理
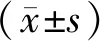
3 结果
3.1 TG、Sal及稳心颗粒对H9C2细胞活性的影响
CCK-8比色分析结果(见图1)显示,TG 0.01、0.05、0.10、0.50、1.00 μmol·L-1分别处理H9C2细胞12、24、48、72 h后,对细胞活性的影响呈时间和浓度依赖性。本研究选择达到半数抑制浓度(IC50)的条件(即0.10 μmol·L-1TG溶液处理24 h)作为造模条件;Sal溶液浓度大于40 μmol·L-1时,细胞存活率低于95%,对细胞生长产生了一定的毒性作用,因此0.1~40 μmol·L-1为Sal的无毒浓度范围,本研究选择Sal 20 μmol·L-1用于后续实验;稳心颗粒在0.5~10 g·L-1时促进细胞增殖,而在50 g·L-1时细胞存活率大幅降低,本研究选择10 g·L-1作为稳心颗粒组的干预条件。

注:与TG 0.01 μmol·L-1、Sal 0.10 μmol·L-1、稳心颗粒0.5 g·L-1组比较,*P<0.05,**P<0.01;与TG 0.05 μmol·L-1、Sal 1 μmol·L-1、稳心颗粒1 g·L-1组比较,#P<0.05,##P<0.01;与TG 0.1 μmol·L-1、Sal 10 μmol·L-1、稳心颗粒5 g·L-1组比较,ΔP<0.05,ΔΔP<0.01;与TG 0.5 μmol·L-1、Sal 20 μmol·L-1、稳心颗粒10 g·L-1组比较,θP<0.05,θθP<0.01;与Sal 30 μmol·L-1比较,ΦP<0.05,ΦΦP<0.01。图1 TG、Sal及稳心颗粒对H9C2细胞活性的影响
3.2 稳心颗粒对TG诱导的H9C2细胞形态的影响
如图2所示,药物作用细胞24 h后,倒置相差显微镜下观察细胞生长状态的变化。对照组H9C2细胞贴壁生长,呈长梭状,伸展性良好,细胞呈致密束状有序排列,无接触抑制,细胞生长汇合度约90%;模型组细胞生长汇合度明显降低,细胞轮廓变得不规则,失去正常铺展外观,分布无序,细胞呈片状或条状生长;而Sal组和稳心颗粒组细胞生长汇合度显著优于模型组,其轮廓形态明显改善,大致恢复致密束状排列。

图2 稳心颗粒对TG诱导的H9C2细胞形态的影响(×40)
3.3 稳心颗粒对TG诱导的H9C2细胞内质网应激凋亡的影响
流式细胞术检测凋亡的结果提示,与对照组比较,模型组、Sal组及稳心颗粒组早期凋亡率都显著增加(P<0.05,P<0.01)。与模型组比较,Sal组及稳心颗粒组早期凋亡率都显著下降(P<0.01),见表1和图3。

表1 稳心颗粒对TG诱导的H9C2细胞内质网应激凋亡的影响

图3 稳心颗粒对TG诱导的H9C2细胞内质网应激凋亡的影响
3.4 稳心颗粒对TG诱导的H9C2细胞内质网应激凋亡后相关蛋白表达的影响
结果显示,与对照组比较,模型组细胞GRP78、CHOP、Caspase-12蛋白表达水平显著升高,Cx43蛋白表达水平显著降低(P<0.01)。与模型组比较,Sal组和稳心颗粒组细胞CHOP和Caspase-12蛋白表达水平均显著降低,而Cx43蛋白表达水平显著升高(P<0.01);Sal组细胞GRP78蛋白表达水平差异无统计学意义,稳心颗粒组细胞GRP78蛋白表达水平显著升高(P<0.01),见图4。
4 讨论
心肌缝隙连接由Cx构成的六聚体半通道在相邻细胞间对接形成,缝隙连接发挥作用依赖于Cx正常表达,Cx是内质网合成的跨膜驻留蛋白,其合成和降解都受到内质网的全面调控[8]。对于心肌Cx的降解,在已经报道的研究中,主要为未折叠蛋白反应(UPR)-内质网应激相关蛋白降解(ERAD)级联的自噬和泛素途径,受到多种因素的调控,如自噬相关蛋白的表达影响Cx43磷酸化及其降解的状态[9],但UPR-ERAD级联并不完全包括Cx的降解路径。内质网应激UPR通过3条信号通路发挥减少蛋白合成、增加蛋白降解、限制蛋白转运的作用,减轻内质网应激以促进细胞生存,而当内质网应激发展到不可逆阶段时,这3条信号通路便由促生存转向促凋亡。心肌细胞发生内质网应激是心肌损伤后的主要病理机制之一,持续不能缓解的内质网应激将诱导细胞启动凋亡程序[10],心肌细胞凋亡过程中Cx表达的改变可能是心肌损伤后心律失常的重要原因之一[11]。

注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01。图4 稳心颗粒对TG诱导的H9C2细胞内质网应激凋亡后相关蛋白表达的影响
本实验选用内质网应激经典刺激剂TG造模。TG是一种有效抑制内质网膜上Ca2+离子泵蛋白活性的物质,能迅速打破钙稳态,导致内质网应激[12],TG也作为许多研究应用的凋亡诱导剂[13-14]。使用TG 0.1 μmol·L-1处理H9C2细胞24 h,结果显示,细胞汇合度降低,形态改变,排列紊乱,出现明显凋亡,且细胞内GRP78、CHOP和Caspase-12蛋白表达水平较对照组显著提高。内质网分子伴侣GRP78是最经典的内质网应激感受蛋白,也是UPR激活的关键分子之一。CHOP是UPR在内质网过度应激时启动的凋亡信号分子,是UPR由促生存向促凋亡转变的关键标志[15],而Caspase-12则是内质网应激UPR中表达的钙网蛋白直接特异性激活的Caspase蛋白,可进一步诱导激活Caspase级联反应,水解包括Cx在内的凋亡细胞内所有蛋白[16]。以上结果表明,在TG刺激下,H9C2细胞出现了内质网应激并激活了凋亡信号分子,形成了内质网应激凋亡状态。
在内质网应激凋亡状态下,H9C2细胞中Cx43蛋白的表达显著减少,这表明Cx43的表达可能与内质网应激凋亡密切相关。因此,本实验进一步通过经典凋亡抑制剂验证了Cx43与内质网应激凋亡通路之间的关联,使用凋亡抑制剂Sal与TG共同干预H9C2细胞后,细胞形态及排列分布明显改善,Sal组细胞凋亡率显著下降,Sal对GRP78蛋白的表达无明显影响,但显著下调了CHOP和Caspase-12蛋白的表达水平,上调Cx43蛋白的表达水平,说明Cx43蛋白表达量的增加可能与内质网应激凋亡途径降解的抑制直接相关,进一步验证了Cx的降解与心肌细胞内质网应激凋亡途径之间的联系。
稳心颗粒能抑制心肌梗死后的心肌细胞凋亡,并且能够干预Cx的表达,改善心律失常的发生[17]。本课题组前期实验也证明了稳心颗粒能在基因水平调控Cx43和Cx45 mRNA表达,维持两者原有比例[18]。本研究使用稳心颗粒和TG共同干预H9C2细胞,稳心颗粒在一定程度上发挥了与凋亡抑制剂Sal相似的作用,这也与文献报道中稳心颗粒能抑制心肌细胞凋亡的结论相符合[5]。光学显微镜下,可见细胞形态及排列分布明显改善,流式细胞术结果提示稳心颗粒的干预使H9C2细胞凋亡率显著下降,Western blotting结果进一步提示稳心颗粒显著上调了GRP78蛋白表达水平。有研究显示GRP78过表达能激活多种抑制内质网应激的信号通路[19-21],因此稳心颗粒可能通过上调GRP78而加强细胞的自适应反应。此外,稳心颗粒还显著抑制了CHOP蛋白和Caspase-12蛋白的表达,而上调了Cx43蛋白的表达水平,这与文献报道中凋亡抑制状态下心肌缝隙连接降解过程被逆转的结论一致[6],说明稳心颗粒可能通过减轻内质网应激、抑制凋亡程序激活及Caspase水解反应调控了Cx43的降解。
综上所述,本研究结果表明,TG诱导内质网应激凋亡途径的激活能够影响H9C2细胞Cx43的表达水平,稳心颗粒能在一定程度上抑制内质网应激凋亡信号分子的激活,进而抑制Cx43经胱天蛋白酶水解途径降解,从而发挥保护心肌缝隙连接的作用。

