大麻二酚及其类似物研究进展
史文强,公绪栋,吴春晖,沈敬山*
(1. 中国科学院上海药物研究所 中国科学院受体结构与功能重点实验室,上海 201203;2. 中国科学院大学,北京 100049;3. 中国科学院新疆理化技术研究所 中国科学院干旱区植物资源化学重点实验室,新疆 乌鲁木齐 830011;4. 上海特化医药科技有限公司,上海 201203)
1940年研究者从植物大麻中分离得到了大麻二酚(CBD,1)[1],随后于1963年鉴定了其化学结构。在500余个植物大麻来源的天然化合物中,CBD因其广泛的药理学作用与功效而受到越来越多的关注。2005年吉瓦制药公司研发的Sativex®[Δ9-四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC)与CBD含量比值为1的口腔黏膜喷雾剂]获批上市,用于多发性硬化症的治疗以及缓解肿瘤相关的疼痛[2]。2018年6月,美国FDA批准了吉瓦制药公司的CBD口服液上市,商品名为Epidiolex®,用于治疗两岁及以上患者的Dravet综合征和Lennox-Gastaut综合征引起的癫痫[3]。除了在神经精神系统疾病领域的应用以外,CBD还在心血管、肿瘤等疾病领域展现出潜在的临床应用价值[4],更加激发了药物化学工作者的研究兴趣,本文以期通过CBD的构效关系研究,获得成药性更好的候选药物。

1 CBD概述
CBD具有丰富的药理学作用,且多项研究表明CBD在体内发挥作用与内源性大麻素系统密切相关。CBD口服生物利用度较低,但代谢半衰期较长。此外,CBD的代谢产物种类多样,且具有丰富的生物学活性。
1.1 CBD的药理学作用
与CBD生物学作用相关的靶点,目前至少报道了65个。所涉及的疾病领域包括神经精神系统疾病(如癫痫、抑郁症、帕金森病和焦虑症等),癌症(乳腺癌、肺癌、结肠癌等),自身免疫性疾病以及心血管系统疾病等[5-7]。
CBD抗癫痫的作用机制目前尚不清楚,可能与其调节腺苷及胞内Ca2+水平从而减弱神经元兴奋性有关[8]。CBD在动物模型上还表现出快速抗抑郁、抗焦虑以及改善认知的作用,这可能与其激活5-羟色胺1A受体(5-HT1AR)促进前额叶皮层中突触形成和脑源性神经营养因子(BDNF)生成有关[4,9-10]。CBD可诱导T-47D和MDA-MB-231人乳腺癌细胞凋亡,可能与其下调雷帕霉素靶蛋白(mTOR)的表达有关[11]。在角质细胞中,CBD可降低紫外线照射所引起的活性氧(ROS)和核转录因子-κB(NF-κB)水平的升高,且抑制脂质过氧化,进而调节胞内的氧化还原平衡[12]。CBD可显著降低脊髓损伤小鼠中与T细胞分化和侵润相关的趋化因子和细胞因子的表达,进而改善神经痛等脊柱损伤症状[13]。CBD可诱导NO的释放或者通过环氧合酶(COX)和超氧化物歧化酶(SOD)介导,产生血管舒张作用[14]。
1.2 CBD与内源性大麻素系统
内源性大麻素系统包含2种大麻素受体(CB1R和CB2R)以及一些内源性配体。大麻素受体属于G蛋白偶联受体(GPR)家族中的一员[15]。
CBD对CB1R和CB2R的亲和力很低,最近研究[16-17]显示CBD对CB1R具有负向别构调节作用,这对CBD可调节Δ9-THC相关的副作用如:心动过速、焦虑、镇静以及食欲下降等提供了依据。同时,CBD对CB2R具有部分激动作用。Martinez-Pinilla等[18]研究显示CBD对CB2R具有别构调节作用。总之,CBD对CB1R/CB2R的作用尚不清晰,有待进一步探究。
CBD可与内源性大麻素花生四烯酸乙醇胺(AEA,2)、2-花生酰基甘油(2-AG,3)竞争性地结合到脂肪酸结合蛋白(FABPs)上,FABPs可转运AEA至其代谢酶-脂肪酸酰胺水解酶(FAAH),故AEA的代谢会减少,因此CBD可抑制细胞间AEA的摄取从而起到调节内源性大麻素的作用[19]。最近的研究[20-21]显示CBD发挥抗抑郁作用可能依赖于大麻素系统,CBD通过作用于FAAH从而抑制细胞间内源性大麻素AEA的摄取,AEA作用于大麻素受体增强了5-HT能神经传递,随后通过谷氨酸系统或者激活5-HT1AR产生抗抑郁作用。

1.3 CBD 的药代学性质、代谢物及毒副作用
由于首过效应,CBD的口服生物利用度较低,人体试验数据为13% ~ 19%,吸入性给药生物利用度为11% ~ 45%(平均值为31%)[22-23]。CBD的亲脂性较高,易于透过血脑屏障。CBD在体内代谢的半衰期较长,注射给药为(24±6) h,吸入性给药为(31±4) h[24]。
Harvey等[25]于1990年首次报道了CBD人体有关的代谢研究。CBD在体内的主要代谢途径是7位碳原子的氧化及进一步的戊基侧链(C-1′′/2′′/3′/4′′)、烯丙基(C-10)的羟化。另外,戊基侧链的β-氧化也是主要代谢途径之一,生成奇数碳原子的羧酸代谢产物(见图1,2)。
CBD可被CYP450酶代谢,CBD的多个位点被羟基化之后进一步被氧化,这导致其代谢物的复杂多样性。从不同的组织中已发现约100个CBD代谢物。总体来看,CBD代谢产物中7-COOHCBD(6)系列化合物占比最大,它们以原型或葡萄糖醛酸结合的形式排到体外[26]。尿中原型CBD的浓度占CBD排泄物总浓度的12.1%,化合物4占13.3%。在尿中还监测到Δ9-THC(0.69%,24)、Δ8-THC(1.69%,25)以及大麻酚(0.6%,26),研究显示可能是CBD随尿液排出之后在体外发生环化,从而产生上述3种化合物[27]。研究发现大鼠经口给予CBD(50mg · kg-1),但在其血液和大脑皮层中均未发现有Δ9-THC的产生[28-29]。
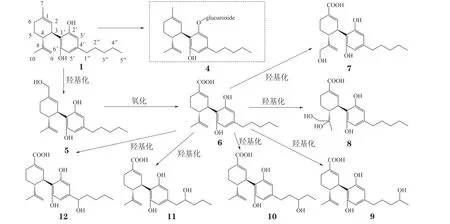
图1 CBD的主要代谢途径之一(C-7的羟基化及氧化)及主要代谢产物Figure 1 One of the main metabolic pathways of CBD (hydroxylation and oxidation of C-7) and main metabolites

图2 CBD的主要代谢途径之一(β-氧化)及主要代谢产物Figure 2 One of the main metabolic pathways of CBD (β-oxidation) and main metabolites

化合物5和6对大麻素受体几乎没有亲和力(Ki>10 μmol · L-1),这2种代谢物在体外能够剂量依赖性地抑制NO、ROS以及肿瘤坏死因子-α(TNF-α)的产生,具有一定的抗炎作用。在小鼠实验中,化合物6可导致轻微的体温下降(降幅为 -1.1℃)以及较弱的肠道蠕动抑制[30]。化合物5在体外细胞实验中可剂量依赖性地降低三酰甘油的水平,且作用强于CBD,这意味着化合物5或许可用于代谢紊乱相关疾病(例如非酒精性脂肪肝)的治疗[31]。
CBD在人体和其他动物模型上所展示出的毒副作用非常小,常见的不良反应有嗜睡、腹泻、恶心以及体温升高等[32]。CBD对许多细胞色素酶亚家族具有一定的抑制作用,尤其是CYP2C和CYP3A亚家族,因此与CBD共用经CYP3A和CYP2C家族代谢的药物时,会有发生药物-药物相互作用的风险[33-34]。
2 大麻二酚衍生物
根据来源,大麻二酚衍生物可分为天然来源和合成来源2种。本文依据化学结构特征对不同来源的大麻二酚衍生物进行再分类,并对衍生物的生物学活性及作用机制进行介绍。
2.1 天然来源的大麻二酚衍生物
2.1.1 大麻二酚型化合物植物大麻中所含的大麻素类化合物超过100个,包括CBD在内有7个化合物被归类为CBD型化合物[35],这些化合物的立体构型与CBD完全相同。
化合物27于1972年首次报道,化合物28于1976年报道,这2种大麻素在植物大麻中的含量都非常低,关于其药理作用的研究暂无详细报道[36]。
次大麻二酚(CBDV,29)是CBD的C4′位的丙基衍生物,其对CB1R和CB2R的亲和力非常弱。另外,化合物29对多个瞬时感受器电位通道(TRP channel)亚家族具有激动作用,包括TRPA1、TRPV1和TRPV2等,其对TRPA1的激动活性最强(EC50= 420±10 nmol · L-1),对TRPM8展现出拮抗作用(IC50= 900 nmol · L-1)[37]。在小鼠及大鼠癫痫模型上,化合物29显示出显著的抗惊厥及抗癫痫作用,并且不会影响运动功能[38]。此外,化合物29还可显著改善Rett综合征模型鼠的社交和运动协调能力,并且使小鼠大脑的脑质量增加[39]。化合物29目前处于Ⅱ期临床阶段,用于癫痫和孤独症的治疗,该药由吉瓦制药公司与大冢制药公司共同研发[40]。
化合物30于1977年被报道,但目前关于其药理活性的研究较少[36]。Takeda等[41]报道大麻二醇酸(31)可下调c-fos基因的表达,从而抑制环氧合酶-2(COX-2)的生成,进而抑制MDA-MB-231乳腺癌细胞的迁移。化合物31的甲酯衍生物(HU-580,32)与化合物31在体外实验中均能增强选择性5-HT1AR激动剂8-OH-DPAT的最大效应,并且在大鼠实验中均展示出止吐和抗焦虑的作用,但这2种作用皆可被选择性5-HT1AR拮抗剂WAY100635阻断[42]。此外,化合物32在Wistar-Kyoto和Flinders Sensitive Line 2种遗传抑郁动物模型上展示出抗抑郁作用,其在强迫游泳实验中能够显著降低大鼠的不动时间[43]。
有研究显示化合物33和34与CBD相比其抗菌能力显著下降,推测酚羟基对于CBD发挥抗菌作用十分重要[44]。另外,CBD的酚羟基甲基化之后对某些CYP450酶(如CYP2D6)的抑制能力明显下降[45]。
2.1.2 其他植物源性大麻素除CBD(1)和Δ9-THC(24)之外,化合物25、26、35和36在植物大麻中含量也比较丰富。包括CBD在内,这6个植物源性大麻素在抑郁小鼠模型上均显示出一定的抗抑郁作用。尤其是化合物24和36,在较低剂量下就显示出较为显著的抗抑郁作用[46]。
化合物24和25都具有显著的精神活性,对CB1R和CB2R具有中等强度的部分激动作用[47]。最新一项研究显示化合物26在10 μg剂量下可有效缓解神经生长因子诱导的咀嚼肌疼痛模型鼠的疼痛,并且不影响大鼠的运动功能,这可能与化合物26作用于外周大麻素受体有关[48]。Rhee等[49]报道化合物26的1,1-二甲基庚基类似物(37),尤其是甲基羟化的类似物(38),其对大麻素受体的亲和力非常强(KiCB1= 0.1±0.05 nmol · L-1,KiCB2= 0.2±0.04 nmol · L-1)。化合物35在体外展现出肾上腺素α2受体激动作用(EC50= 0.2 nmol · L-1),对5-HT1A受体展现出拮抗作用。此外,化合物35对多个TRP通道亚型均具有较强的作用,尤其是TRPA1(EC50= 700 nmol · L-1)和TRPM8(IC50= 160 nmol · L-1)[37]。Udoh等[50]报道化合物36对CB2R具有激动活性,这可能与其抗炎作用有关。

2.2 合成来源的大麻二酚类似物
2.2.1 (+)-CBD系列化合物化合物39对大麻素受体具有中等强度的亲和力,其7-OH、7-COOH及1,1-二甲基庚基衍生物对CB1R与CB2R均具有较高亲和力,亲和力数值见表1[51]。

表1 (+)-CBD及其衍生物对CB1R与CB2R受体亲和力Table 1 Affinity of (+)-CBD and its analogs at the CB1/CB2 receptors
其中只有化合物42在小鼠实验中显示出中枢作用,例如增加僵直不动时间、降低体温( -7.5℃),在热板实验中展示出明显的镇痛作用。化合物42所显示出的中枢作用均可被CB1R拮抗剂SR141716阻断,但却不能被CB2R拮抗剂SR144528阻断。其他衍生物只显示出外周作用,例如抑制肠道蠕动。化合物40可强烈抑制福尔马林诱导的炎症性疼痛。化合物43和44没有显示出中枢作用,可能与其无法透过血脑屏障有关[52]。

2.2.2 环己烯部分的修饰—氟取代及蒎烯衍生物Breuer等[53]报道了氟取代的CBD类似物,其中HUF-102(45)和HUF-103(46)的氟取代在环己烯部分,HUF-101(47)的氟取代在苯环上。在针对Swiss小鼠的高架十字迷宫、强迫游泳、听觉惊吓反应的前脉冲抑制和埋珠实验中,化合物47显示出较为显著的活性,与对照组相比具有统计学差异,这说明化合物47可能具有抗焦虑、抗抑郁、抗精神分裂及抗强迫行为的作用。在上述实验中,化合物45在1 ~ 10mg · kg-1剂量下均未显示出任何活性。化合物46与47相比,其抗焦虑、抗抑郁活性相对较弱,且没有显示出抗精神分裂的作用。在用CB1R或CB2R拮抗剂对小鼠进行预处理后,化合物47的抗强迫作用消失,推测其抗强迫作用依赖于CB1R和CB2R[53]。另外,与CBD相比,在小鼠模型中化合物47可在更低剂量下缓解疼痛,推测可能与激活CB1R和CB2R有关,但化合物47不具有精神活性[54]。
HU-308(48)和HU-433(49)都是选择性的CB2R激动剂(Ki分别为11.5与296 nmol · L-1,EC50分别为6.4与130 nmol · L-1)。与化合物48相比,化合物49在卵巢切除诱导的骨流失及耳炎鼠模型中显示出更好的治疗作用。化合物49除了具有诱导成骨细胞增殖、破骨细胞分化的作用外,还具有抗炎作用[55]。化合物48具有广泛的药理学作用,例如抗炎、镇痛、神经保护及抗肿瘤等作用[56-57]。

2.2.3 间苯二酚部分的修饰CBD的4个双乙酰化衍生物(50 ~ 53)均在小鼠模型中显示出抗惊厥的作用。在6.25 ~ 100mg · kg-1剂量下,包括CBD在内的这5个化合物在巴比妥钠诱导睡眠时间延长上具有同等效价。在12.5和25mg · kg-1剂量下,只有CBD和化合物53降低了小鼠的自发活动。在较高剂量下CBD和化合物51对治疗电击产生的痉挛效果最好[58]。化合物50高剂量下可导致小鼠死亡,可能是引入醛基形成了迈克尔受体,导致毒性增强。
2008年的一篇专利[59]报道了一系列单羟基和双羟基取代的CBD类似物(例如HU-427,54),在提高稳定性的同时也改善了生物利用度,这系列衍生物具有较好的抗炎活性。Zyberba公司开发了一系列CBD酯及碳酸酯类前药衍生物(例如 ALL00102,55),用于急性呼吸综合征的治疗[60]。

CBD的醌类衍生物多数对过氧化物酶体增生激活受体γ(PPARγ)具有激动作用,例如,HU-331(56)对PPARγ的EC50为5 μmol · L-1。化合物56是一种选择性的拓扑异构酶Ⅱα抑制剂,其对结肠癌HT-29细胞具有强烈的抑制作用[61]。2015年的一篇专利[62]报道了一类3位取代的醌类化合物(例如57,58),包括N取代和C取代2类。该篇专利所报道的这类化合物在保留PPARγ激动作用的同时,还避免了细胞毒性以及核因子E2相关因子2(Nrf2)的激活。化合物59对PPARγ的EC50为2.2 μmol · L-1,其具有抗炎作用,可抑制脂多糖刺激的小胶质细胞中炎症因子的释放,保护神经元细胞免受兴奋性中毒。此外,化合物59在小鼠多发性硬化症模型中显示出一定的治疗作用[63]。

CBD的亲脂性较高(cLogP= 6.3),为了改善成药性,Kannalife医药公司针对CBD的C4′位取代基进行修饰,得到一系列4′位修饰的衍生物(例如60 ~ 62)。其中KLS-13019(60)在口服生物利用度、中枢神经系统渗透、血浆浓度及小鼠模型的认知改善方面均较CBD有显著改善,另外化合物60与CBD相比作用强且毒性低。化合物60不仅在由乙醇和乙酸铵的毒性导致的神经退行性疾病大鼠模型上显示出显著药效,而且有望用于修复由肝硬化导致的肝损伤。Kannalife公司表示化合物60将有望用于肝性脑病,一种对认知和行为功能构成不利影响的氧化应激性疾病的治疗[64]。
研究显示化合物60可能是通过线粒体钠钙交换体(mNCX)对细胞内的钙离子水平(神经元存活的一个决定性的因素)进行调节,从而发挥神经保护作用。抑制mNCX之后,CBD和化合物60在大鼠模型中均未观察到神经保护作用。此外,化合物60发挥神经保护作用还可能与CB2R有关[65]。
2.2.4 Abnormal CBD衍生物在糖尿病诱发的心血管异常大鼠模型上,化合物63可恢复脂联素-蛋白激酶B-内皮型一氧化氮合酶信号通路的功能以及减少心肌氧化应激从而改善心血管功能,这可能与其激活GPR18有关[66]。最近的一项研究显示化合物63和64可激活GPR55受体进而激活环磷腺苷效应元件结合蛋白(CREB),使下游B-淋巴细胞-2(Bcl-2)和B-淋巴细胞-xL(Bcl-xL)等抗凋亡基因的表达上调,从而抑制内质网应激诱导的胰岛β细胞凋亡[67-68]。

3 结语与展望
天然产物以其化学结构和生物学活性的多样性与新颖性,一直以来都是药物研究工作者先导发现与灵感产生的不尽源泉。CBD作为经典天然产物的代表之一,再次印证了这一源泉的重要意义[69]。已有的临床数据显示CBD对神经系统、肿瘤及免疫性等疾病均有一定的治疗作用,尤其是在改善失眠、缓解焦虑和提高肿瘤患者的生活质量、延长生存周期方面效果突出。随着CBD在癫痫、疼痛等疾病领域取得突破性进展,CBD及其衍生物吸引了越来越多的关注。多个具有开发前景的类似物(如CBDV、KLS-13019、HUF-101等)已进入临床或临床前研究阶段。缺乏明确的分子靶点导向是限制CBD衍生物开发的重要因素之一,对CBD类化合物展开作用机制研究,并建立可靠的体外活性测试与动物药效评价模型予以验证,是首先需要解决的难题。针对CBD作用靶点众多、但对各靶点的作用不强的特点,关于CBD衍生物的开发,笔者认为一方面引入特定基团以提高对某一靶点选择性的同时提高水溶性,从而改善生物利用度;另一方面,针对多种发病机制的复杂疾病,开发具有特定多靶点作用的CBD衍生物不失为一种可行的策略。笔者课题组近期报道了一种CBD及其侧链衍生物的新合成方法,并致力于侧链的修饰与改造[70]。相信仍有许多有价值的分子等待药物化学工作者去挖掘,希望CBD及其衍生物为人类的健康贡献其力量。

