优化高效液相色谱法测定鸡肉及鸡汤中嘌呤含量
方妍,谢定源,丁璐,余永昊,罗鑫
(华中农业大学 食品科技学院,环境食品学教育部重点实验室,武汉 430070)
高尿酸血症与痛风都是分解的代谢产物,是体内尿酸生成过多或排泄过少引起的嘌呤代谢性障碍疾病[1]。研究表明,长期食用高嘌呤食物将大大提高痛风的发病率[2]。随着社会进步和经济发展,加上不良的饮食结构和生活习惯,痛风病明显上升,并引发“三高”病、糖尿病、肾病等相关疾病[3]。随着人们生活水平的不断提高,鸡肉和鸡汤受到越来越多消费者的欢迎。过多食用动物内脏、鱼、虾、肉汤等高嘌呤食物,会增加外源性嘌呤,导致血液尿酸升高。而属于高嘌呤食品中的肉汤,包括浓汁汤、鸡汤、鱼汤、火锅汤,痛风患者应禁食[4]。因此,准确测定鸡肉和鸡汤中的嘌呤含量可为消费者尤其是痛风患者提供科学的饮食指导。
目前国内外对于食品中嘌呤含量的检测还没有一个系统的标准检测方法。嘌呤的检测早在20世纪50年代就引起关注,目前应用较为广泛的方法有薄层色谱法、电泳法、纸层析法、气相色谱法、液相色谱法和离子色谱法等[5-10]。目前高效液相色谱法在食品检测中应用广泛[11-15],而对于嘌呤含量的检测,较主流的检测方法是高效液相色谱法[16]。对于不同的前处理方法会导致样品中嘌呤的提取率不同,从而导致不同的测定结果[17-18],对于提取条件的优化能为样品中嘌呤含量的准确测定奠定基础。本实验将通过正交实验优化提取鸡肉和鸡汤中嘌呤含量,并选择最佳的色谱条件,建立准确、可靠的检测鸡肉和鸡汤中嘌呤含量的方法,为痛风患者合理食用鸡肉和鸡汤提供了理论依据。
1 材料与方法
1.1 原料及药品
老母鸡:鸡龄在1年半到2年左右,养殖地黄陂,购于华农梧桐生鲜超市;腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤(色谱级,纯度>99.0%):上海源叶生物科技有限公司;甲醇(色谱纯)、氢氧化钾(分析纯):国药集团化学试剂有限公司;磷酸二氢钾(色谱纯)、三氟乙酸(色谱纯):麦克林公司;磷酸(色谱纯):Aladdin公司。
1.2 仪器及设备
R214型旋转蒸发仪 上海申生科技有限公司;PK-324型电热恒温水浴锅 上海精宏实验设备有限公司;LC-20A型高效液相色谱仪 日本岛津公司;SB-3200超声波清洗机 宁波新芝生物科技股份有限公司;MillQ型超纯水系统 美国Millipore公司;ME104E102型电子天平 梅特勒-托利多(上海)有限公司;TP-B3000型电子天平 福州华志科学仪器有限公司;pH818型pH计 香港希玛公司;ST22H1苏泊尔304不锈钢炖锅 苏泊尔股份有限公司;QSJ-B03D1型切碎机 广东小熊电器有限公司;9HB-III型循环水式多用真空泵 郑州恒岩仪器有限公司;TDZ4-WS型医用离心机 长沙平凡仪器仪表有限公司。
1.3 实验方法
1.3.1 溶液的配制
分别准确称取腺嘌呤、鸟嘌呤、次黄嘌呤及黄嘌呤标准品0.012 g,加入适量超纯水超声助溶,再分别转移至10 mL容量瓶中用超纯水定容,得到1200 mg/L的各嘌呤标准液,于4 ℃的冰箱中保存备用。移取等体积的嘌呤标准储备液,配制成混合标准储备液,质量浓度为300 mg/L,放入4 ℃冰箱贮藏备用。
1.3.2 色谱条件
采用LC-20A型岛津高效液相色谱仪,色谱柱为Waters Atlantis dC18(4.6 mm×250 mm,5 μm)。
1.3.2.1 甲醇-水色谱条件优化
参考程庆红等[19]的色谱方法:流动相为甲醇-水(5∶95,V/V),流速 1.0 mL/min,柱温 30 ℃,检测波长254 nm,进样量20 μL,在此基础上稍作修改,并进行优化和验证,得到在此流动相条件下最佳的色谱条件。
分别在流动相为V甲醇∶V水为2∶98、3∶97、5∶95、7∶93、10∶90的条件下对混合标准储备液进行测定,柱温30 ℃,流速1.0 mL/min,进样量10 μL,检测波长254 nm,根据分离效果确定最终的甲醇-水的配比。
选用确定的最佳甲醇-水的配比,在其他色谱条件保持不变的条件下,分别在流速为0.8,1.0,1.2,1.4 mL/min的不同流速下,对混合嘌呤标准品进行进样检测,根据分离效果确定最终的流速。
1.3.2.2 磷酸二氢钾色谱条件优化
参考刘镇等[20]的色谱方法:流动相为7×10-3mol/L KH2PO4-H3PO4(pH为4.0),流速 1.0 mL/min,柱温25 ℃,检测波长254 nm,进样量10 μL,在此基础上稍作修改,并进行优化和验证,得到在此流动相条件下最佳的色谱条件。
分别在流动相0.007 mol/L磷酸二氢钾的pH为3.4,3.6,3.8,4.0,4.2的条件下对混合嘌呤标准品进行测定,柱温30 ℃,流速1.0 mL/min,进样量10 μL,检测波长254 nm,根据分离效果确定最终的流动相pH值。
选用确定的最佳流动相的pH,在其他色谱条件保持不变的条件下,分别在流速为0.8,1.0,1.2,1.4 mL/min的不同流速下,对混合嘌呤标准品进行进样检测,根据分离效果确定最终的流速。
1.3.3 标准曲线的制作
移取等体积的嘌呤标准储备液,配制成混合标准储备液,质量浓度为300 mg/L,临用前用超纯水稀释为300,100,50,10,5,1,0.5 mg/L的系列梯度混合标准液。利用上述建立的最佳色谱条件,分别进样检测,记录峰面积。以混合液的浓度为横坐标,峰面积为纵坐标作线性回归,绘制4种嘌呤的标准曲线,确定线性范围。以3倍的信噪比(S/N)所对应的浓度作为检出限(LOD)。
1.3.4 方法精密度
取质量浓度为10 mg/L的混合标准液连续进样6次,进样量为10 μL,计算相对标准偏差(RSD),确定此方法的精密度。
1.3.5 鸡肉和鸡汤样品的制备
将购买的老母鸡(含内脏)切成均匀大小的肉块,上冷水冲洗,沥干称重,将鸡肉去骨,取可食部分用绞肉机搅碎,每份称取0.2 g分装,于4 ℃冰箱中贮藏备用。称取洗净的鸡肉,按料水比鸡肉∶水为1∶3(m/m)放入实验锅中,用旺火煮沸后,撇去上层浮沫,转小档继续煮制,时间为60 min(计时从水煮沸后开始)。鸡汤煮制好后,用双层200目绢布过滤,冷却后放入4 ℃冰箱中澄清24 h,去除上层黏稠鸡油,取清液过滤后放入4 ℃冰箱贮藏备用。
1.3.6 样品前处理方法的确定
参考杨平等[21]的前处理方法,并稍作修改。鸡肉前处理:称取0.2 g肉泥置于玻璃顶空瓶中,向其中加10 mL混合酸,其中三氟乙酸∶甲酸∶超纯水为5∶5∶1,90 ℃水浴中振荡15 min后迅速冷却,转移至250 mL烧瓶中,55 ℃减压浓缩至干,残余物用5 mL最佳流动相配比复溶,复溶后的液体以3000 r/min转速离心20 min,取约1 mL过0.45 μm水系滤膜后进样。鸡汤前处理:取1 mL肉汤置于玻璃顶空瓶中,处理方法与鸡肉前处理方法一致。
1.3.6.1 三氟乙酸浓度的确定
称取0.2 g鸡肉与1 mL鸡汤样品各15份,按1.3.6的样品处理方法进行操作,改变三氟乙酸浓度为80%、85%、90%、95%、100%,比较不同三氟乙酸浓度对鸡肉和鸡汤中嘌呤提取率的影响。
1.3.6.2 水解温度的确定
称取0.2 g鸡肉与1 mL鸡汤样品各15份,按1.3.6的样品处理方法进行操作,改变水解温度为75,80,85,90,95 ℃,比较不同水解温度对鸡肉和鸡汤中嘌呤提取率的影响。
1.3.6.3 水解时间的确定
称取0.2 g鸡肉与1 mL鸡汤样品各15份,按1.3.6的样品处理方法进行操作,改变水解时间为5,10,15,20,25 min,比较不同水解时间对鸡肉和鸡汤中嘌呤提取率的影响。
1.3.6.4 正交实验优化前处理方法
在单因素实验结果的基础上,设计L9(34)正交表进行正交实验,以嘌呤的提取率作为实验指标,确定最佳的鸡肉及鸡汤的前处理条件,实验方案见表1和表2。
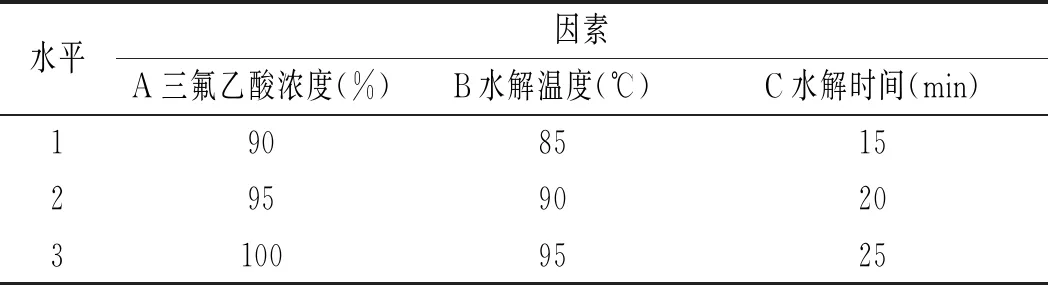
表1 鸡肉前处理正交实验表Table 1 The orthogonal experiment table of chicken pretreatment
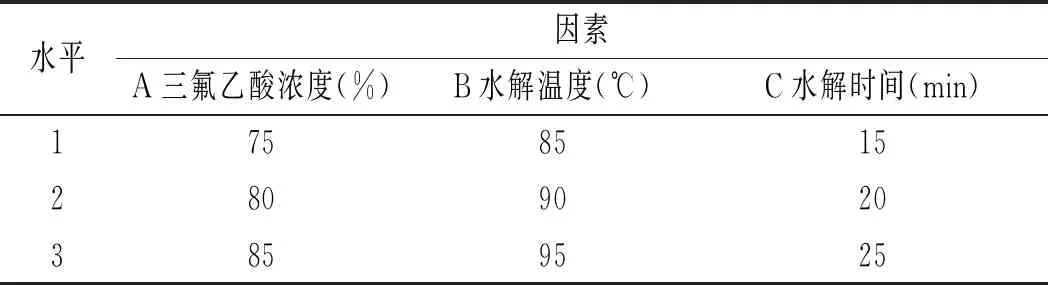
表2 鸡汤前处理正交实验表Table 2 The orthogonal experiment table of chicken soup pretreatment
1.3.7 重复性实验
取鸡肉及鸡汤样品各6份,按照确定的最佳前处理条件提取鸡肉和鸡汤中的嘌呤,再用选定的色谱条件进行进样分析,根据检测结果计算相对标准偏差(RSD),检验鸡肉和鸡汤前处理方法的重现性。
1.3.8 加标回收率
称取已知各嘌呤含量的鸡肉及鸡汤样品12份,分别按照每种嘌呤含量的5,8,10倍加入嘌呤标准品,配制成3个不同的浓度,再按照确定的最佳前处理条件以及色谱条件进行处理和进样分析,每个样品平行测定3次,取平均值,求出平均回收率。
1.4 数据分析
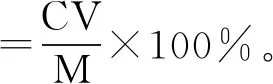
式中:C为嘌呤的质量浓度,mg/L;V为复溶后液体的体积,L;M为样品质量,g。
加标回收率(%)=(测定值-本底值)/加标量×100%。
数据采用Excel 13.0和SPSS 26.0进行分析,作图使用Excel 13.0。
2 结果与分析
2.1 优化的色谱条件
2.1.1 流动相为甲醇-水
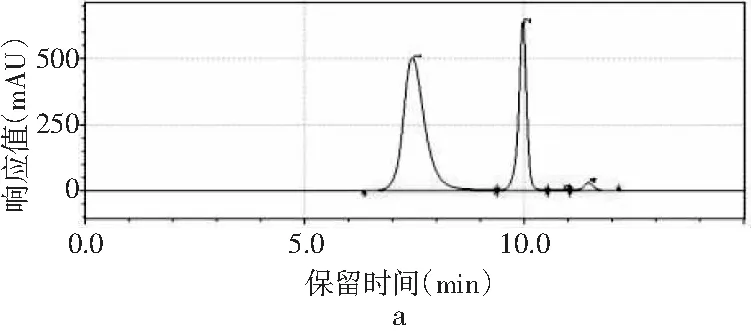
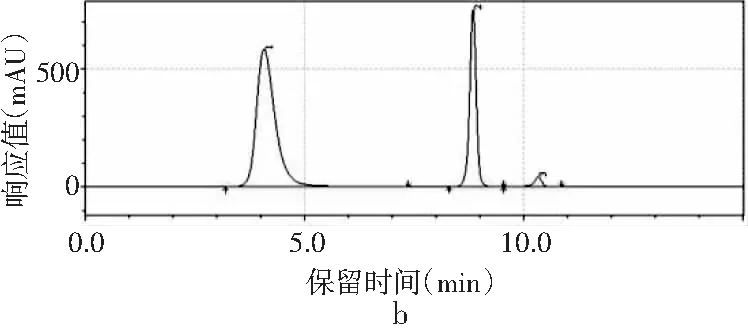
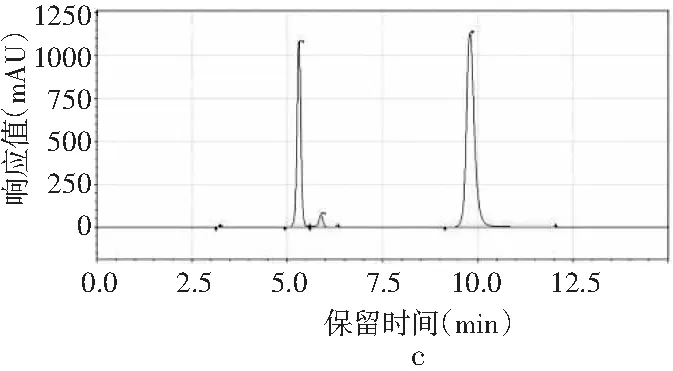
图1 4种嘌呤在不同甲醇-水配比下的分离情况Fig.1 The separation of four purines under different methanol-water ratios
采用甲醇-水作为流动相测定嘌呤标准品中4种嘌呤的含量。根据测定嘌呤单一标准品可知,4种嘌呤的出峰顺序依次是鸟嘌呤、腺嘌呤、次黄嘌呤、黄嘌呤。由图1中a可知,当流动相配比V甲醇∶V水为2∶98时,4种嘌呤可以完全分离,查看峰表可知4种嘌呤的保留时间分别是7.442,9.958,10.877,11.450 min。甲醇配比对4种嘌呤分离效果的影响见图1,随着甲醇比例的增加,当甲醇∶水的比例为3∶97、10∶90时,4种嘌呤无法完全分离,只出现3个峰,黄嘌呤和次黄嘌呤无法分离,因此甲醇比例的增加会导致4种嘌呤的分离效果变差,从而选择甲醇∶水的最佳配比为2∶98进行进一步的优化。
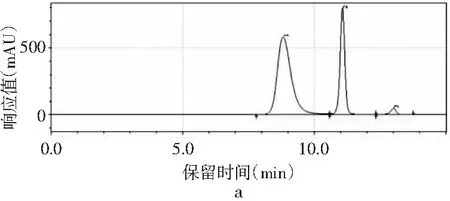
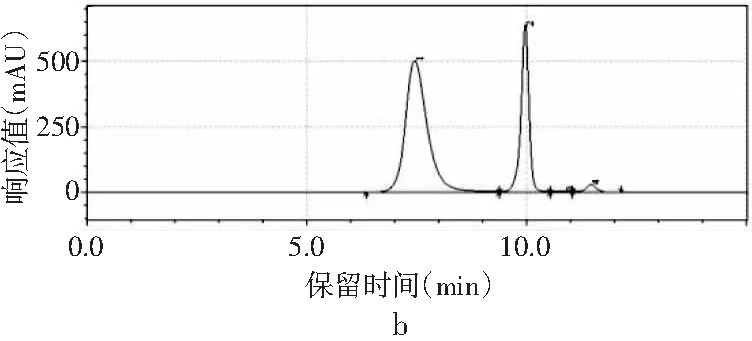
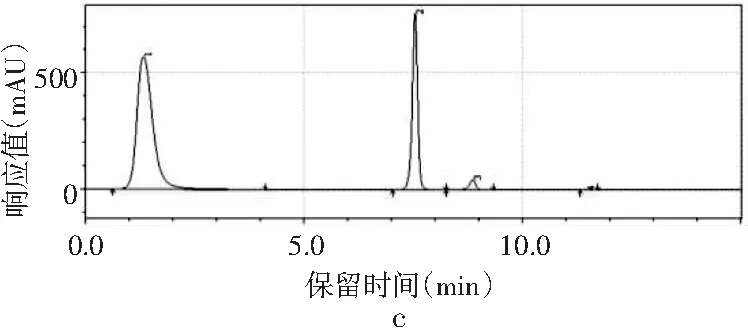
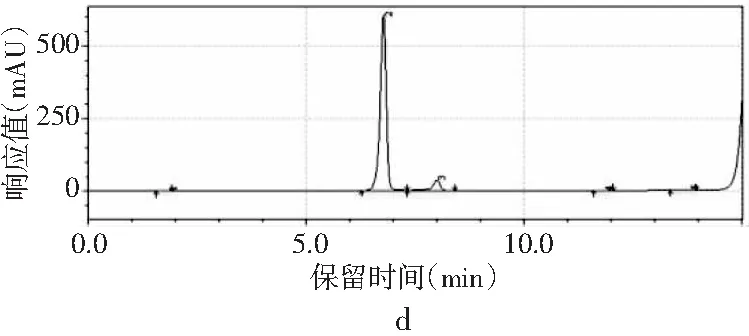
图2 4种嘌呤在不同流速下的分离情况Fig.2 The separation of four purines at different flow rates
当其他色谱条件不变,只改变流速时,由图2中a可知,当流速为0.8 mL/min时,只能出现3个峰,4种嘌呤无法完全分离。当流速增加时,分离度也随之增加。当流速增加到1.0 mL/min时,4种嘌呤分开,出峰顺序依次是鸟嘌呤、腺嘌呤、次黄嘌呤和黄嘌呤,出峰尖锐,峰形较好。当流速增加到1.2 mL/min时,各嘌呤的保留时间提前,分离度也进一步增大,峰形也较好。而当流速为1.4 mL/min时,在15 min内出峰不完整,且峰形较差,比较1.0 mL/min与1.2 mL/min发现,流速为1.0 mL/min时,次黄嘌呤与黄嘌呤的保留时间仅相差0.573 min,而流速为1.2 mL/min时,两者保留时间相差达到2.611 min,因此最终选择流速1.2 mL/min作为最佳流速。因此,以甲醇-水为流动相测定嘌呤标准品的最优色谱条件是:色谱柱为Waters Atlantis dC18(4.6 mm×250 mm,5 μm),流动相是V甲醇∶V水为2∶98,流速为1.2 mL/min,柱温为30 ℃,检测波长为254 nm,进样量为10 μL。
2.1.2 流动相为KH2PO4-H3PO4
磷酸二氢钾不同pH值对4种嘌呤的分离效果见图3。
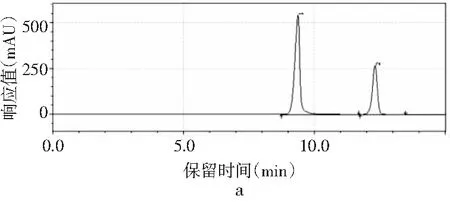
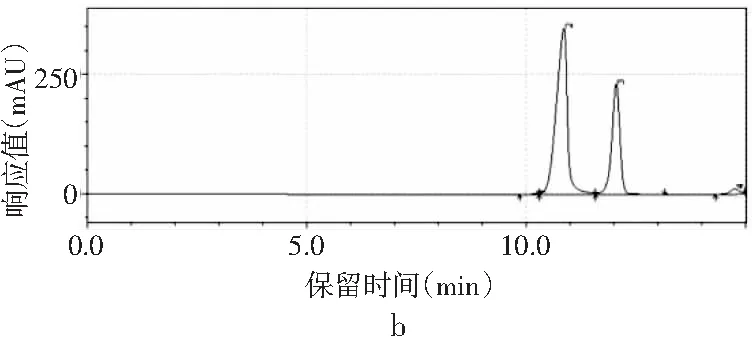
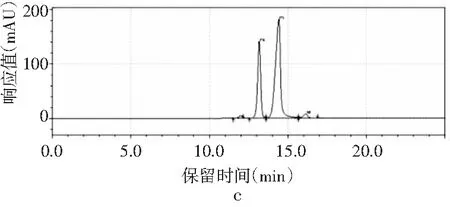
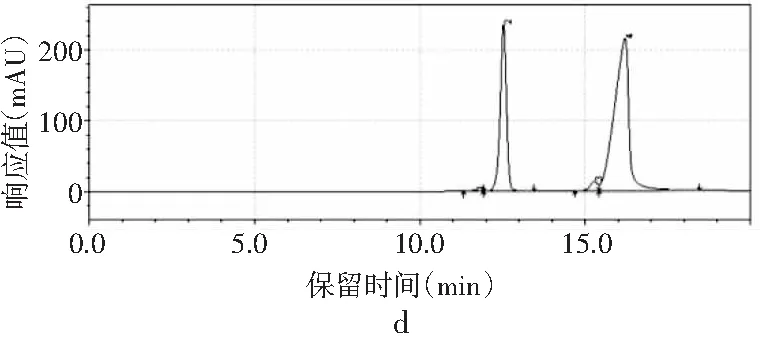
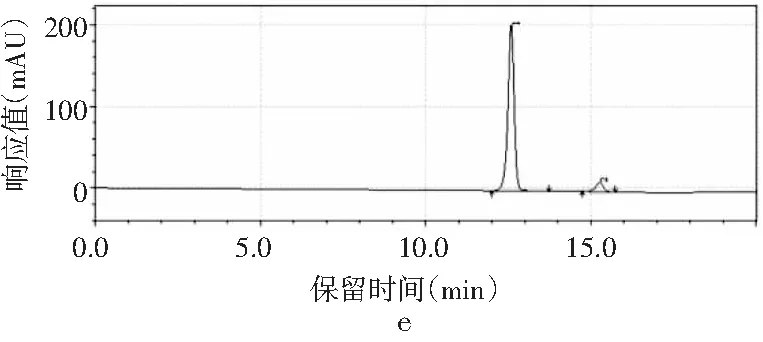
图3 4种嘌呤在磷酸二氢钾不同pH下的分离情况Fig.3 The separation of four purines at different pH values of potassium dihydrogen phosphate
由图3可知,当pH为3.4时,只出现2个峰,4种嘌呤无法完全分离,峰1是腺嘌呤与鸟嘌呤的混合峰,峰2是次黄嘌呤与黄嘌呤的混合峰。随着pH增大,4种嘌呤的分离度也随之增加。当pH为3.6时,出现4个峰,出峰顺序依次是鸟嘌呤、次黄嘌呤、腺嘌呤和黄嘌呤,但是鸟嘌呤与次黄嘌呤的保留时间仅相差0.624 min,两峰相隔太近,出峰效果较差。当pH增加到3.8时,4种嘌呤完全分离开,且峰形尖锐、完整,出峰效果好。而当pH进一步增大到4.0时,出现4个峰,但是腺嘌呤与黄嘌呤未出现明显分峰现象。当pH为4.2时,在20 min内只出现了2个峰,因此最终选择pH为3.8的磷酸二氢钾作为流动相进行进一步的优化。
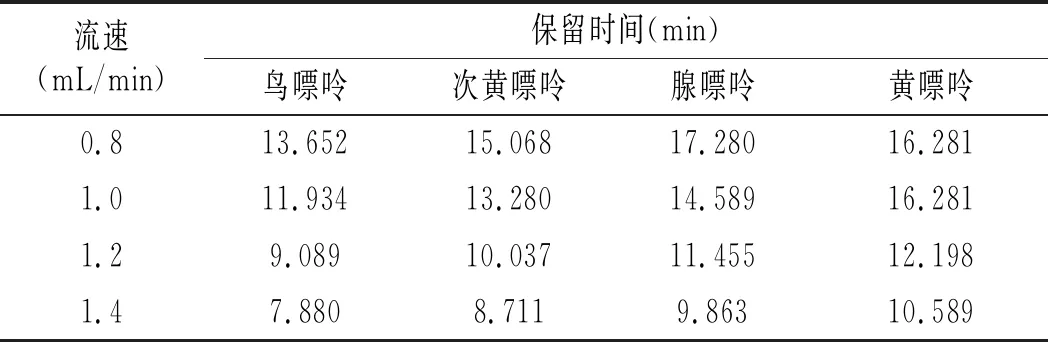
表3 不同流速下4种嘌呤的保留时间Table 3 The retention time of four purines at different flow rates
由表3可知,当其他色谱条件不变,只改变流速时,4种流速下均分离出4种峰,且峰形均较好。随着流速的增加,4种嘌呤的保留时间均提前,且腺嘌呤与黄嘌呤的分离程度也随之变化。流速对4种嘌呤保留时间的影响见表3。流速为0.8 mL/min时,腺嘌呤与黄嘌呤的保留时间仅相差1.022 min;流速为1.0 mL/min时,相差1.692 min;1.2 mL/min时,相差0.743 min;1.4 mL/min时,相差0.726 min。由此可见,当流速为1.0 mL/min时,腺嘌呤与黄嘌呤的分离程度最大,峰形最好,因此选择流速1.0 mL/min作为最佳流速。 以磷酸二氢钾作为流动相分离4种嘌呤的最优色谱条件是:色谱柱是Waters Atlantis dC18(4.6 mm×250 mm,5 μm);流动相为7.0×10-3mol/L的磷酸二氢钾(pH 为3.8),流速为1.0 mL/min,柱温为30 ℃,检测波长为254 nm,进样量为10 μL。
对比甲醇-水与磷酸二氢钾作为流动相时的色谱图可发现,以甲醇和水作为流动相时黄嘌呤的出峰效果不如以磷酸二氢钾作为流动相时的效果。并且相比两者的流速而言,磷酸二氢钾作为流动相的最佳流速为1.0 mL/min,而甲醇-水为1.2 mL/min,流速高时会减少色谱柱的使用寿命,因此在本实验中最终选择以7.0×10-3mol/L的磷酸二氢钾(pH为3.8)为流动相,色谱柱为Waters Atlantis dC18(4.6 mm×250 mm,5 μm);流速1.0 mL/min、柱温30 ℃、检测波长254 nm、进样量10 μL为最终的色谱条件。
2.2 标准曲线
根据2.1最终确定的色谱条件进样检测不同浓度的嘌呤混合标准品,以峰面积(Y)和质量浓度(X)做线性回归,线性实验结果见表4。4种嘌呤在0.5~300 mg/L质量浓度范围内线性关系良好,相关系数在0.9998~0.9999之间,检出限在0.024~0.129 mg/L之间。
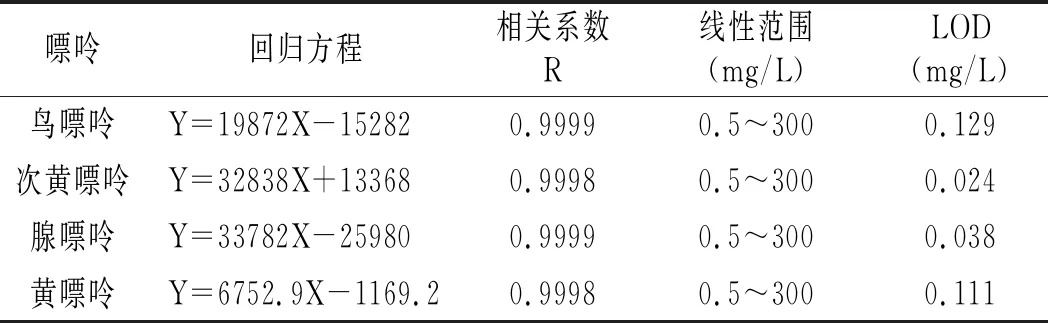
表4 线性实验结果Table 4 The linearity experiment results
2.3 方法精密度
检测方法精密度实验结果见表5。相对标准偏差在0.4673%~0.8132%之间,表明本实验建立的高效液相色谱检测方法精密度好,可用于样品中嘌呤含量的检测。
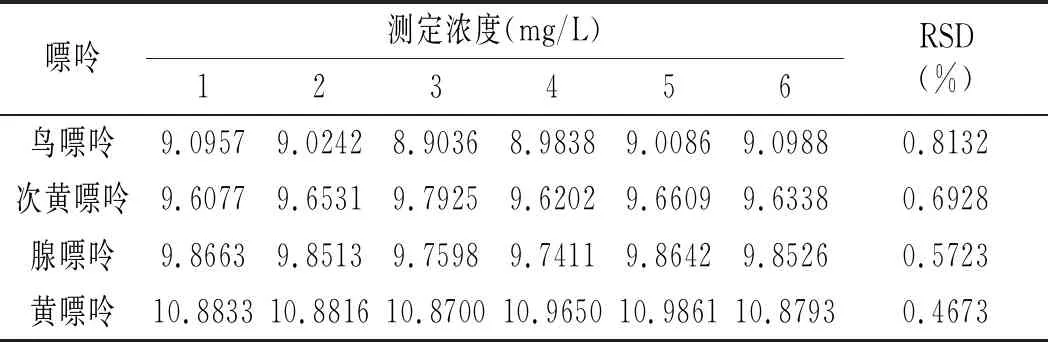
表5 精密度实验结果Table 5 The precision test results
2.4 优化的前处理条件
2.4.1 三氟乙酸浓度对嘌呤提取率的影响
利用SPSS统计分析,以5个三氟乙酸浓度,每组3个平行实验作因子,以总嘌呤提取率作实验指标进行单因素方差分析,分析结果见表6和表7。
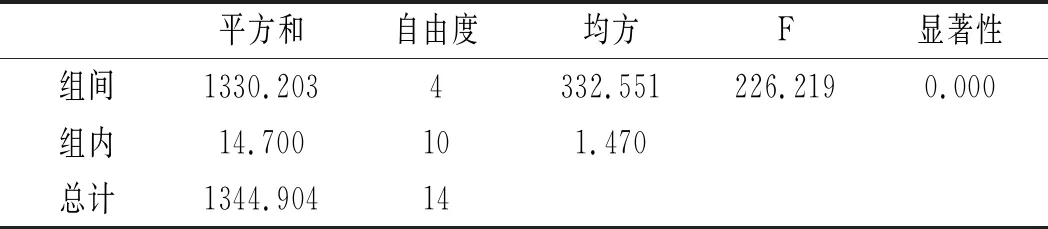
表6 鸡肉-三氟乙酸浓度方差分析结果Table 6 The variance analysis results of chicken- trifluoroacetic acid concentration
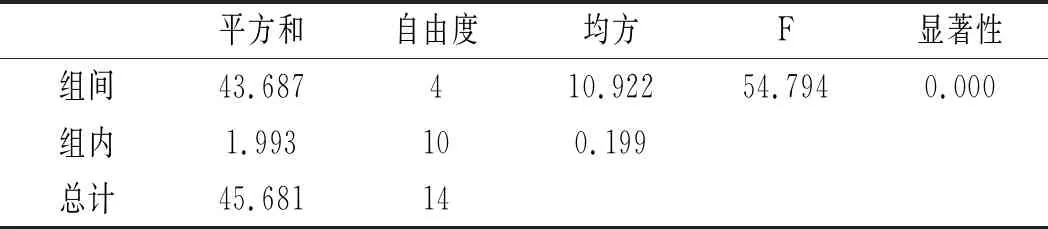
表7 鸡汤-三氟乙酸浓度方差分析结果Table 7 The variance analysis results of chicken soup- trifluoroacetic acid concentration
由表6和表7可知,当其余条件固定时,三氟乙酸浓度对鸡肉和鸡汤中嘌呤提取率的影响显著,其P值均为0.000<0.05。三氟乙酸浓度对鸡肉和鸡汤中4种嘌呤和总嘌呤提取率的影响见图4和图5。在浓度80%~95%之间,鸡肉中鸟嘌呤随浓度的增加而不断上升,次黄嘌呤提取率则随着浓度的增加不断上升,腺嘌呤与黄嘌呤整体上呈现先上升后下降的趋势。从总嘌呤提取率来看,当三氟乙酸浓度达到100%时总嘌呤提取率显著下降,说明高浓度的三氟乙酸反而会降解鸡肉样品中的嘌呤,造成嘌呤损失,因此选择95%三氟乙酸浓度作为鸡肉中总嘌呤提取率最优。随着三氟乙酸浓度的增加,鸡汤中鸟嘌呤呈现先下降后上升的趋势,腺嘌呤、黄嘌呤与次黄嘌呤的提取率呈现下降的趋势,总嘌呤的提取率随着三氟乙酸浓度的增加呈现不断下降后趋于稳定的趋势,总嘌呤提取率在三氟乙酸浓度为80%时最大,因此选择三氟乙酸浓度为80%时鸡汤中总嘌呤提取率最优。
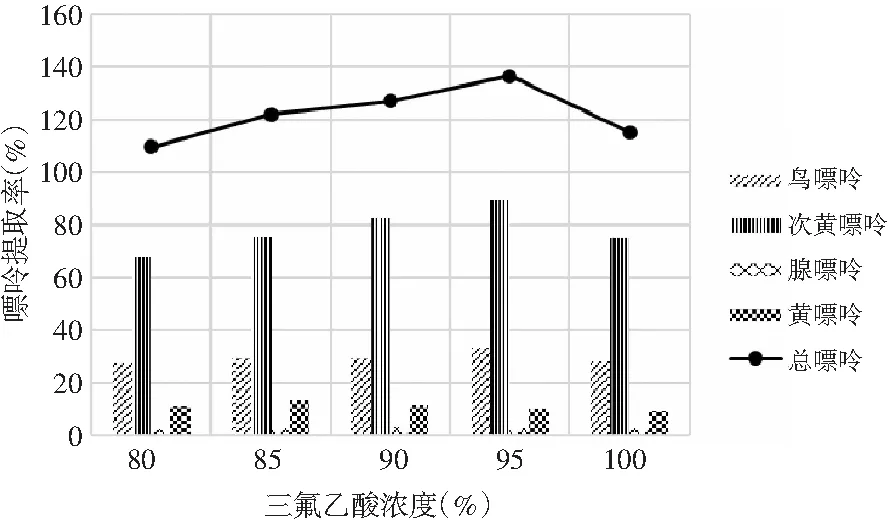
图4 三氟乙酸浓度对鸡肉中嘌呤提取率的影响Fig.4 The effect of trifluoroacetic acid concentration on the extraction rate of purine in chicken
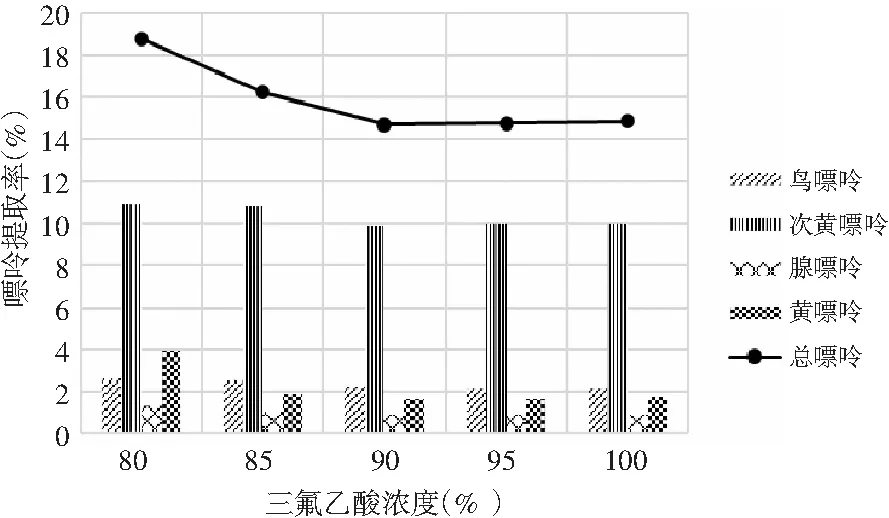
图5 三氟乙酸浓度对鸡汤中嘌呤提取率的影响Fig.5 The effect of trifluoroacetic acid concentration on the extraction rate of purine in chicken soup
2.4.2 水解温度对嘌呤提取率的影响
利用SPSS统计分析,以5个水解温度,每组3个平行实验作因子,以总嘌呤提取率作实验指标进行单因素方差分析,分析结果见表8和表9。
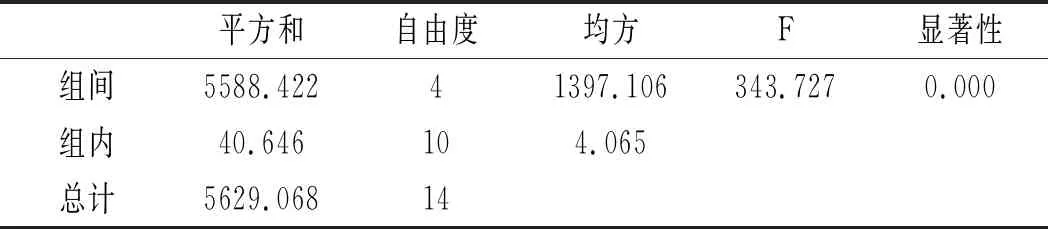
表8 鸡肉-水解温度方差分析结果Table 8 The variance analysis results of chicken- hydrolysis temperature

表9 鸡汤-水解温度方差分析结果Table 9 The variance analysis results of chicken soup-hydrolysis temperature
由表8和表9可知,当其余条件固定时,水解温度对鸡肉和鸡汤中嘌呤提取率的影响显著,其P值均为0.000<0.05。水解温度对鸡肉和鸡汤中4种嘌呤和总嘌呤提取率的影响见图6和图7。随着水解温度的增加,鸡肉中鸟嘌呤、次黄嘌呤、黄嘌呤整体上均呈现先上升后下降的趋势,腺嘌呤整体上呈上升的趋势,总嘌呤在90 ℃时有最大提取率。这是由于温度的升高使得分子间的运动加剧,嘌呤从鸡肉和鸡汤样品中的溶出速度加快。鸡汤样品中温度对嘌呤提取率的影响与鸡肉中一致,总嘌呤提取率在90 ℃时达最大。因此,选择水解温度为90 ℃时鸡肉和鸡汤中总嘌呤提取率最优。
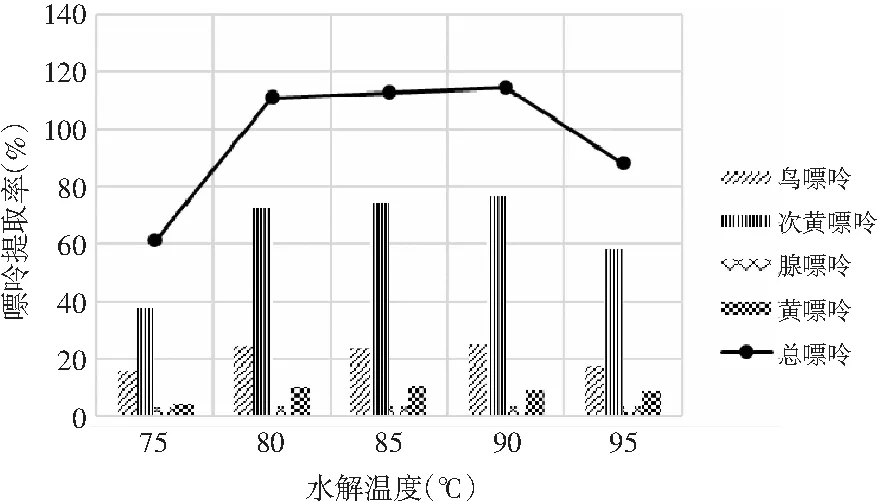
图6 水解温度对鸡肉中嘌呤提取率的影响Fig.6 The effect of hydrolysis temperature on the extraction rate of purine in chicken
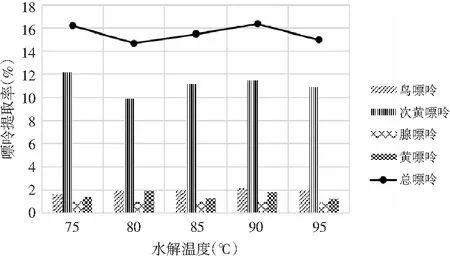
图7 水解温度对鸡汤中嘌呤提取率的影响Fig.7 The effect of hydrolysis temperature on the extraction rate of purine in chicken soup
2.4.3 水解时间对嘌呤提取率的影响
利用SPSS统计分析,以5个水解时间,每组3个平行实验作因子,以总嘌呤提取率作实验指标进行单因素方差分析,分析结果见10和表11。
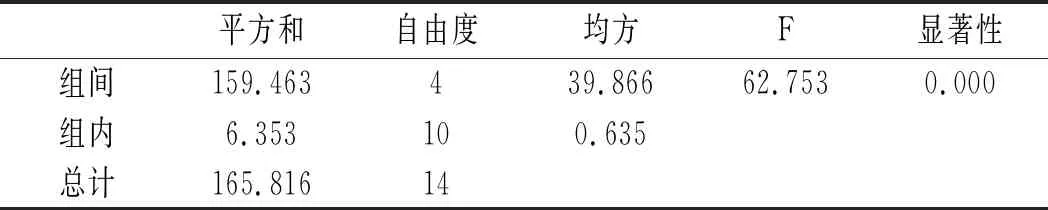
表10 鸡肉-水解时间方差分析结果Table 10 The variance analysis results of chicken- hydrolysis time
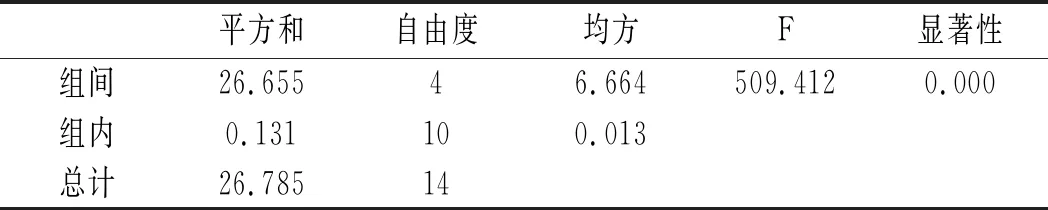
表11 鸡汤-水解时间方差分析结果Table 11 The variance analysis results of chicken soup-hydrolysis time
由表10和表11可知,当其余条件固定时,水解时间对鸡肉及鸡汤中嘌呤提取率的影响显著,其P值均为0.000<0.05。水解时间对鸡肉及鸡汤中4种嘌呤和总嘌呤提取率的影响见图8和图9。鸡肉中鸟嘌呤、腺嘌呤、黄嘌呤含量随着水解时间的增加呈现先上升后下降的趋势,而次黄嘌呤则在水解5 min时提取率最大,然后呈下降的趋势。总嘌呤含量在20 min时达最大值。鸡汤样品嘌呤提取率的变化与鸡肉类似,水解20 min时总嘌呤提取率达最大值。因此,选择水解时间为20 min时鸡肉和鸡汤中总嘌呤提取率最优。
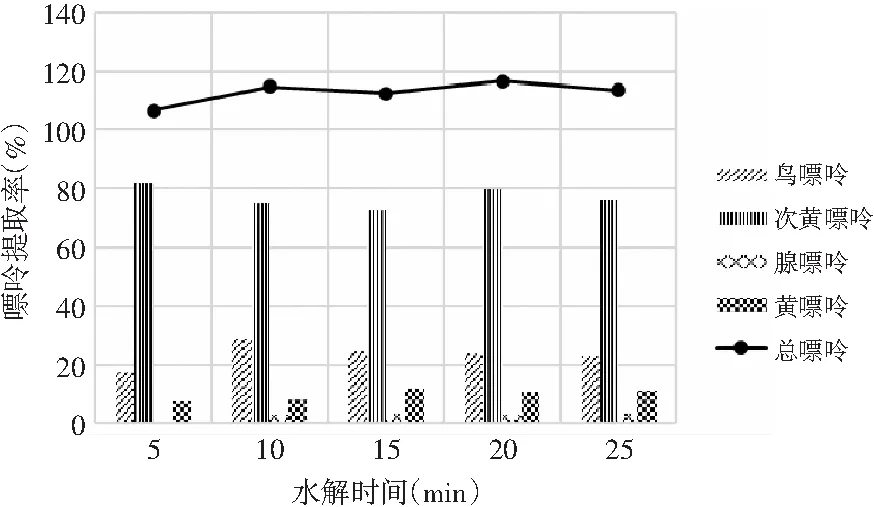
图8 水解时间对鸡肉中嘌呤提取率的影响Fig.8 The effect of hydrolysis time on the extraction rate of purine in chicken
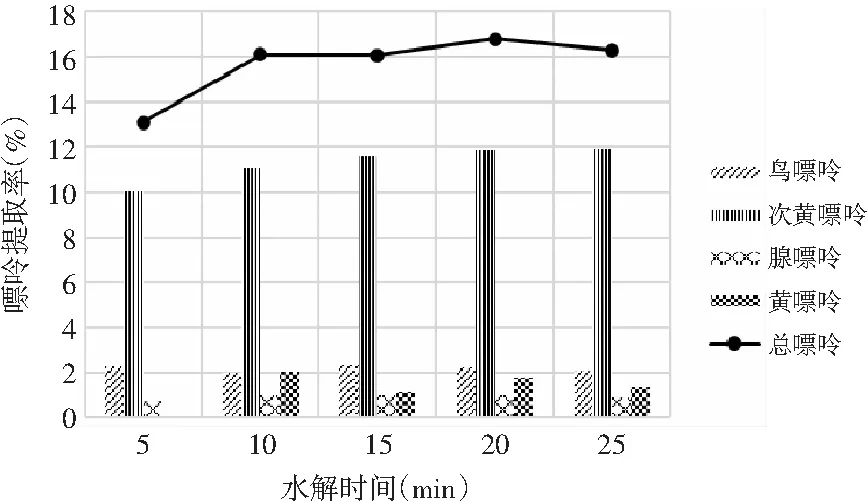
图9 水解时间对鸡汤中嘌呤提取率的影响Fig.9 The effect of hydrolysis time on the extraction rate of purine in chicken soup
2.4.4 正交实验优化
鸡肉及鸡汤样品的正交实验优化结果见表12和表13。
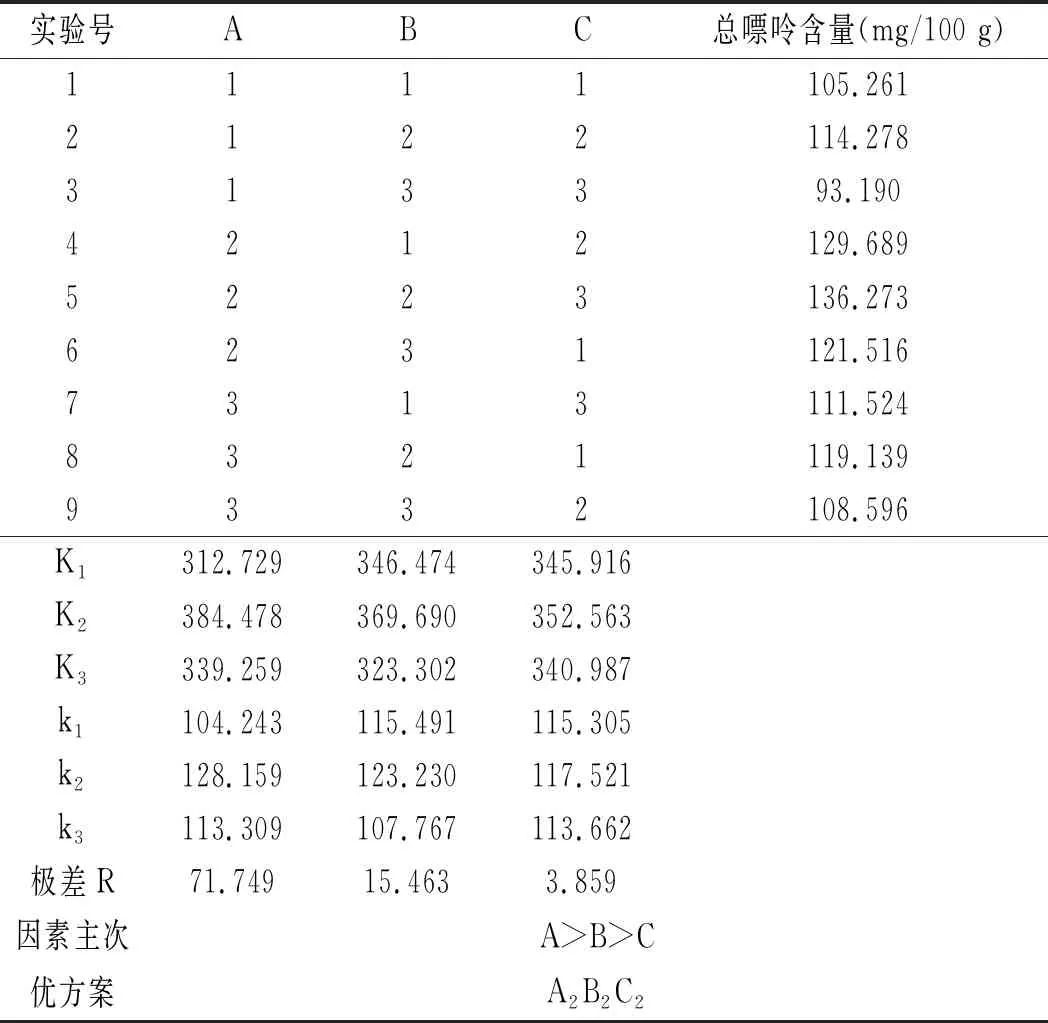
表12 鸡肉前处理正交实验结果Table 12 The orthogonal test results of chicken pretreatment
由表12可知,影响鸡肉中嘌呤提取率因素的顺序依次是三氟乙酸浓度>水解温度>水解时间,最佳组合是A2B2C2,即三氟乙酸浓度为95%,水解温度为90 ℃,水解时间为20 min。
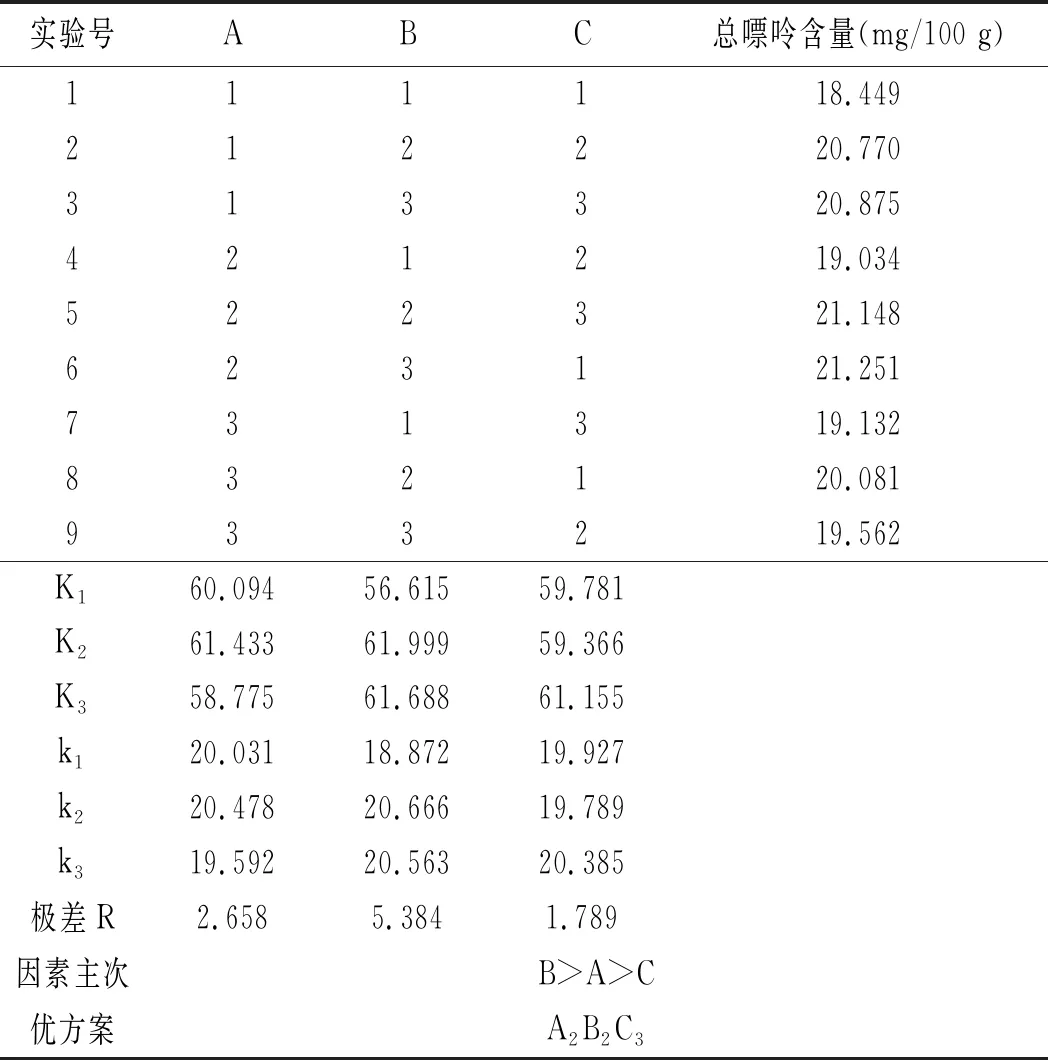
表13 鸡汤前处理正交实验结果Table 13 The orthogonal test results of chicken soup pretreatment
由表13可知,影响鸡汤中嘌呤提取率因素的顺序依次是水解温度>三氟乙酸浓度>水解时间,最佳组合是A2B2C3,即三氟乙酸浓度为80%,水解温度为90 ℃,水解时间为25 min。
2.5 重复性实验
按照2.1与2.4节确定的最佳色谱条件与前处理条件,取鸡肉样品与鸡汤样品各6份进行处理后进样分析,鸡肉与鸡汤重复性实验结果见表14和表15。结果显示:鸡肉中鸟嘌呤、次黄嘌呤、腺嘌呤与黄嘌呤4种嘌呤含量RSD分别为7.293%、2.494%、6.527%、3.935%,鸡汤中分别为2.202%、2.302%、4.705%、2.658%,重复性均较好。
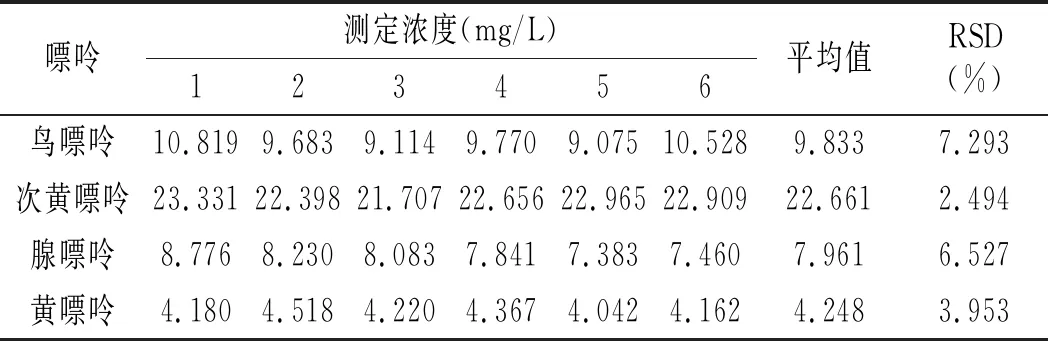
表14 鸡肉重复性实验结果Table 14 The reproducibility test results of chicken
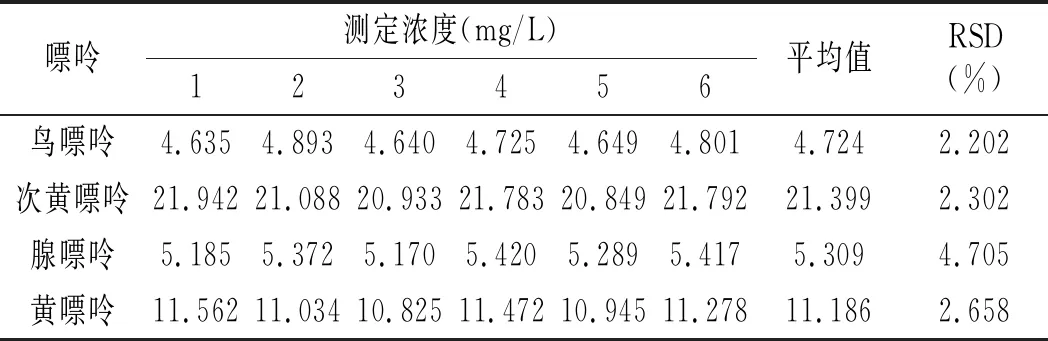
表15 鸡汤重复性实验结果Table 15 The reproducibility test results of chicken soup
2.6 加标回收率
鸡肉及鸡汤样品加标回收率结果见表16和表17。鸡肉样品中鸟嘌呤、次黄嘌呤、腺嘌呤与黄嘌呤平均回收率分别为91.6343%、95.9119%、94.0015%、92.0173%,鸡汤样品中分别是94.9030%、96.6424%、94.6847%、93.3189%,说明优化的前处理条件可以有效减少提取鸡肉及鸡汤嘌呤过程中的嘌呤损失,能很好地提取样品中的嘌呤。
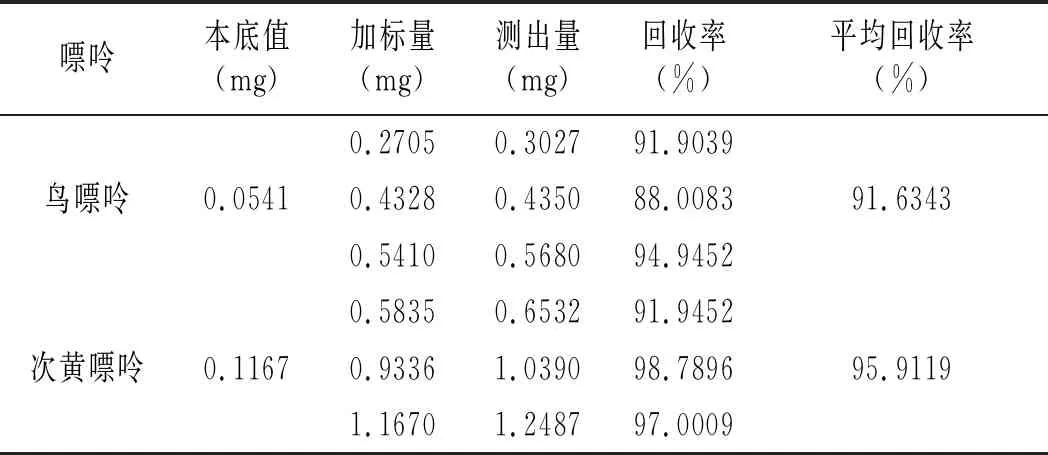
表16 鸡肉加标回收实验结果表Table 16 The chicken standard recovery experiment results
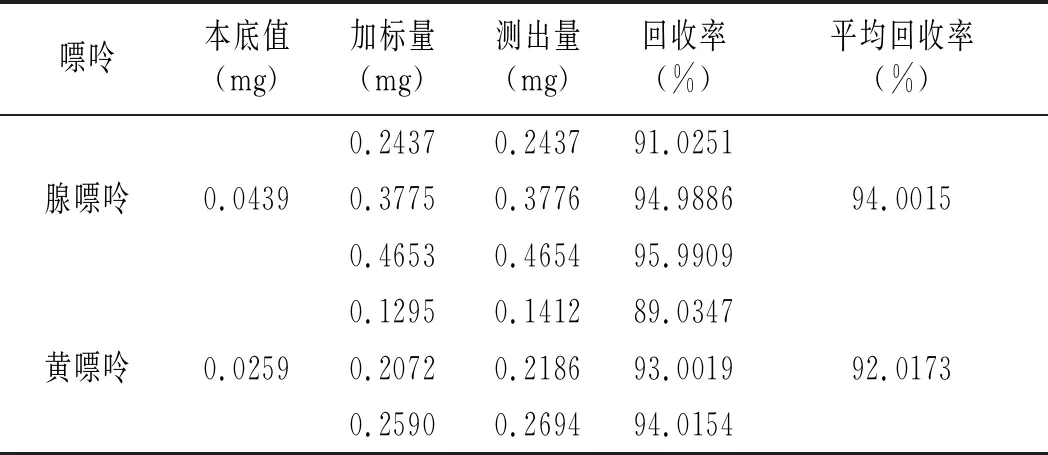
续 表
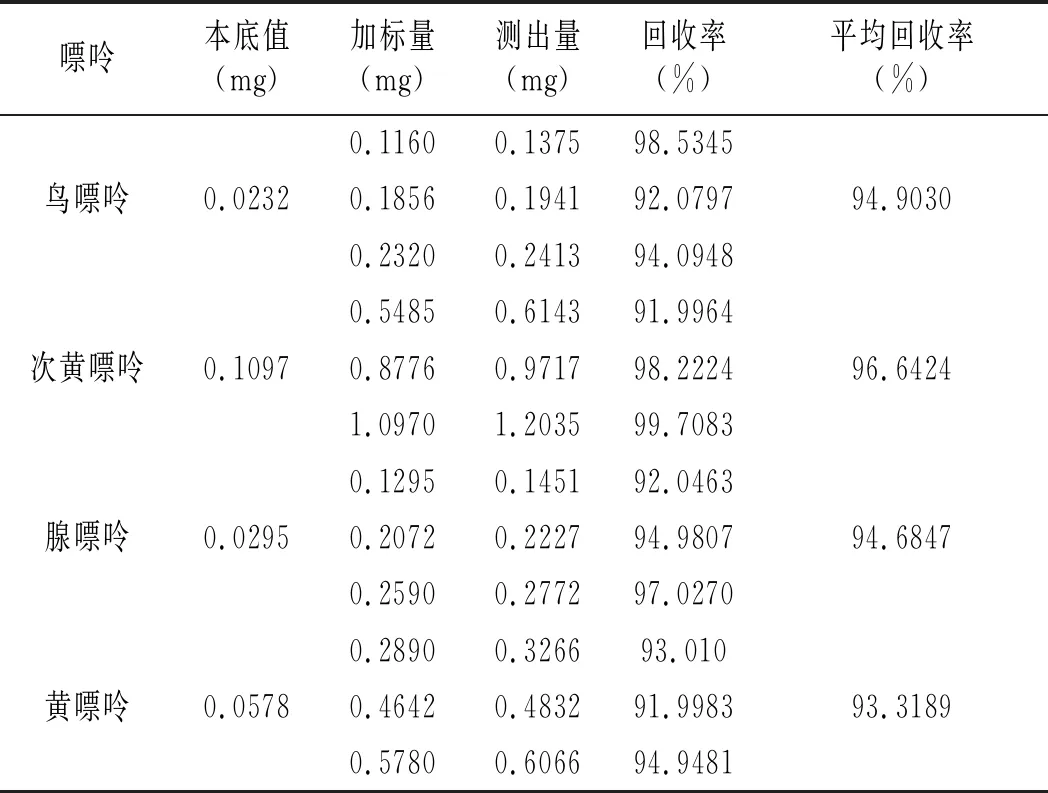
表17 鸡汤加标回收实验结果表Table 17 The chicken soup standard recovery experiment results
3 结论
本实验确定了提取鸡肉及鸡汤中4种嘌呤的最佳前处理方法,并建立了同时检测鸡肉及鸡汤中4种嘌呤的高效液相色谱法。使用Waters Atlantis dC18(4.6 mm×250 mm,5 μm)色谱柱,流动相为7×10-3mol/L的KH2PO4-H3PO4(pH为3.8),流速为1.0 mL/min,柱温为30 ℃,紫外检测器检测波长为254 nm,进样量为10 μL,检测鸡肉及鸡汤中的鸟嘌呤、次黄嘌呤、腺嘌呤和黄嘌呤。经方法学验证,4种嘌呤的质量浓度和峰面积在0.5~300 mg/L线性范围内,线性关系良好,相关系数R在0.9998~0.9999之间,检出限在0.024~0.129 mg/L范围内,检测方法精密度RSD为0.4673%~0.8132%。正交实验优化混合酸提取鸡肉及鸡汤中嘌呤实验结果表明,三氟乙酸浓度为95%,在90 ℃下水解20 min时,鸡肉中总嘌呤的提取效果最好;三氟乙酸浓度为80%,在90 ℃下水解25 min时,鸡汤中总嘌呤的提取效果最好,样品处理重复性RSD在2.202%~7.293%之间,鸡肉样品平均加标回收率在91.6343%~95.9119%之间,鸡汤样品平均加标回收率在93.3189%~96.6424%之间,适用于检测鸡肉及鸡汤中4种嘌呤含量。应用此方法测定鸡肉及鸡汤中的嘌呤含量可为痛风病人提供科学健康的饮食指导。

