酶解牡丹籽蛋白抗氧化特性的研究
王颖颖,李迎秋
(齐鲁工业大学(山东省科学院) 食品科学与工程学院,济南 250353)
牡丹籽油因富含不饱和脂肪酸(>90%),尤其是对人体营养与健康有益的α-亚麻酸(>40%),已被应用于各种食品和保健品中[1]。而从榨油后残留的牡丹籽粕中提取的牡丹籽蛋白具有合理的氨基酸组成和良好的功能特性,是一种优质的蛋白质资源,可作为食品工业中功能蛋白的替代物[2]。
部分食品在运输贮藏过程中易受到温度、水分和光等外界因素的影响,常会发生脂质或者蛋白氧化,从而导致食品的品质降低,货架期缩短,并产生对人体健康有害的代谢物[3-4]。因合成抗氧化剂存在对人体的安全风险,所以用于减少食品氧化的天然抗氧化剂受到大多数研究者的青睐。大量研究表明,天然抗氧化剂的添加对食品表现出保鲜、延缓氧化、产品护色等方面的良好效果[5]。而由酶解天然蛋白质制得的活性肽作为抗氧化剂应用于食品行业中也具有良好的抗氧化效果[6-7]。如由碱性蛋白酶和复合蛋白酶顺序酶解得到的玉米蛋白水解物,在生鸡肉糜中仅添加0.05%即可有效地延缓脂质的氧化,提高生鸡肉糜的外观和食用品质,延长生鸡肉糜的储存期。部分学者也从牡丹籽中分离得到可清除体内自由基、具有抗氧化作用的牡丹籽抗氧化肽,显示了牡丹籽蛋白能够作为水溶性抗氧化剂的新资源[8]。因此,为了提高牡丹籽加工副产物的综合利用率和产品附加值,本研究的目的是为了探讨蛋白酶和水解时间对牡丹籽蛋白水解物分子量大小、氨基酸组成和抗氧化性能的影响,以期为牡丹籽蛋白水解物作为抗氧化剂应用于食品工业中提供理论基础和数据支持。
1 试验仪器与材料
PB-10标准型pH计 德国赛多利斯有限公司;UV-1900双光束紫外-可见分光光度计 上海元析仪器有限公司;TGL-16M台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;L-8800氨基酸自动分析仪 日本日立公司;SCIENTZ-18N普通型冷冻干燥机 宁波新芝冻干设备股份有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂。
牡丹籽:购于山东菏泽华瑞科技有限公司;碱性蛋白酶和中性蛋白酶:购于诺维信(中国)有限公司;正己烷、三氯乙酸(TCA)、硫酸亚铁(FeSO4·7H2O)、H2O2、氯化亚铁(FeCl2)、铁氰化钾(K3[Fe(CN)6])、氯化铁(FeCl3):购自国药集团化学试剂有限公司;2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2'-azino-bis(3-ethylbenzothi azoline-6-sulfonic acid) diammonium salt,ABTS):购自上海阿拉丁生化科技股份有限公司;1,10-菲啰啉和菲啰嗪:购自美国Sigma公司;其他试剂均为分析纯。
2 试验方法
2.1 牡丹籽蛋白的制备
2.1.1 牡丹籽脱脂
将脱壳的牡丹籽在高速粉碎机中进行粉碎,取已粉碎的牡丹籽粉100 g于锥形瓶中并加入300 mL正己烷与之充分混匀,放置摇床中,在室温下脱脂2 d,脱脂完全后的牡丹籽粉在通风橱中干燥至正己烷完全挥发后过80目筛子,即可得到脱脂牡丹籽粉。
2.1.2 牡丹籽蛋白的制备
取80 g脱脂牡丹籽粉于1 L的烧杯中,加入800 mL的蒸馏水充分搅拌均匀后,用1.0 mol/L的NaOH将溶液的pH值调节至9.50,置于50 ℃的水浴锅中提取3.5 h,提取结束冷却至室温之后,将其在4 ℃,6000 r/min下离心5 min得到上清液。用1.0 mol/L的HCl调节上清液的pH值至3.60(等电点),再次离心(6000 r/min, 5 min)得到沉淀,最后将沉淀用蒸馏水洗至中性于-80 ℃冷冻干燥即得牡丹籽蛋白,样品储存在-20 ℃冰箱中备用。
2.2 蛋白酶活力的测定
采用福林酚比色法对蛋白酶进行酶活检测[9],并计算其酶活力。
X=[(A×K)/10]×4×n。
式中:X为样品酶活力,U/g;A为样品吸光度值;K为根据标准曲线求得的吸光常数;4为反应总体积,mL;10为反应时间10 min;n为稀释倍数。
2.3 牡丹籽蛋白的酶解
称取2 g冻干的牡丹籽蛋白溶于100 mL的蒸馏水配制2%的蛋白溶液(W/V),调节溶液的pH值后置于已设定温度的水浴锅中一段时间,使其达到碱性蛋白酶(pH 8.0,60 ℃)和中性蛋白酶反应(pH 7.0, 55 ℃)的最适条件。然后添加相同酶活(3000 U/g)的碱性蛋白酶和中性蛋白酶于混合溶液中并在恒温水浴锅中进行酶解。反应过程中,通过连续加入1 mol/L NaOH溶液来维持酶解液的pH值恒定。分别在1,2,3,4 h收集水解液,并在100 ℃下加热10 min使酶失活。冷却至室温后,在8000 r/min (4 ℃)下离心20 min取上清液,将所得上清液冷冻干燥,在-20 ℃保存至下次使用。
2.4 SDS-PAGE凝胶电泳
使用不连续缓冲液系统在15%分离凝胶和3%浓缩凝胶上进行还原性SDS-PAGE电泳。取2.3.3中等体积(100 μL)的水解液(20 mg/mL)与100 μL还原性样品缓冲液混合在100 ℃下煮沸5 min,冷却至25 ℃后,每种样品混合物各上样10 μL,在分离凝胶上以30 mA运行2 h,然后在浓缩凝胶上以15 mA运行1 h。,将凝胶染色并脱色过夜即可显示条带。
2.5 氨基酸组成的测定[10]
分别称取牡丹籽蛋白和水解产物各0.05 g于10 mL的水解管中,每管中加入10 mL 6 mol/L的HCl充分混匀,连续吹入氮气3次后,封口在110 ℃下进行酸水解22~24 h。水解结束后用双层滤纸过滤并用超纯水定容至50 mL,各取1~2 mL滤液在50 ℃下旋转蒸发以除去HCl后,加入适量0.02 mol/L的HCl将样品溶液稀释5倍,最后通过0.22 μm微滤膜过滤上样。氨基酸含量计算公式为氨基酸(g)/蛋白质(100 g)。
2.6 ABTS自由基清除能力测定[11]
ABTS自由基溶液的配制:向烧杯中加入200 mL浓度为7 mmol/L的ABTS溶液和3.52 mL浓度为2.45 mmol/L的过硫酸钾,超声2 min使之充分混合,置于黑暗处避光反应12~16 h,之后用浓度为0.05 mol/L,pH 7.4的磷酸盐缓冲液稀释使其在734 nm波长条件下的吸光度值为0.70±0.02,即为ABTS自由基溶液,在室温条件下静置30 min即可使用。
分别称取一定量的TPSP、碱性蛋白酶和中性蛋白酶水解物溶于蒸馏水中,配制成浓度为0.5 mg/mL的溶液。取0.15 mL上述样品与2.85 mL ABTS自由基溶液混合均匀,在室温下避光反应10 min,待其稳定后在734 nm处测定样品的吸光度值At。空白组是用0.15 mL的蒸馏水代替样品溶液,测得空白组的吸光值为A0,每组测定重复3次。ABTS自由基清除率的计算公式:
ABTS自由基清除率(%)=[(A0-At)/A0]×100。
2.7 ·OH自由基清除能力测定[12]
将TPSP、碱性蛋白酶和中性蛋白酶水解物溶于蒸馏水中配制成浓度为1.5 mg/mL的溶液。依次取1 mL 0.75 mmol/L 1,10-菲啰啉,2 mL 0.2 mol/L磷酸盐缓冲溶液(PB,pH 7.4),1 mL 0.75 mmol/L FeSO4·7H2O和1 mL上述样品溶液混匀,最后加入1 mL 0.01%(V/V)H2O2溶液,于37 ℃水浴锅中反应1 h,在536 nm处测定溶液的吸光值A1;空白组取1.0 mL水代替样品测定吸光值A2;对照组取2.0 mL水代替样品和H2O2测定吸光值A3,每组测定重复3次。·OH自由基清除率的计算公式:
·OH自由基清除率(%)=[(A1-A2)/(A3-A2)]×100。
2.8 Fe2+鳌合能力测定[13]
取1 mL浓度为0.5 mg/mL的样品溶液与2 mL 0.05 mmol/L FeCl2溶液及2 mL 0.5 mmol/L菲啰嗪溶液混匀,在室温下反应15 min,于562 nm处测定吸光值A1。以1 mL蒸馏水代替样品,测定吸光值A0,每组测定重复3次。Fe2+鳌合率的计算公式:
Fe2+鳌合率(%)=[(A0-A1)/A0]×100。
2.9 还原力测定[14]
取1 mL样品溶液(1.5 mg/mL)与2.5 mL浓度为0.2 mol/L的磷酸盐缓冲液(pH 6.6)及2.5 mL 的1% K3Fe(CN)6,在恒温50 ℃水浴锅中反应20 min,随后迅速使之冷却,并加入2.5 mL 10%的TCA溶液,以3000 r/min的转速离心10 min后分别取上清液2.5 mL,然后加入2.5 mL的蒸馏水及0.5 mL的0.1% FeCl3溶液,使之充分混合均匀,于室温下反应10 min后,在700 nm处测定吸光值,用蒸馏水调零,每个测定重复3次。
3 结果与分析
3.1 酶活测定
由于蛋白酶在实验室存放过程中其酶活力会逐渐丧失,故需要在试验前测定碱性蛋白酶和中性蛋白酶。由酪蛋白浓度与吸光值得到的标准曲线方程为y=0.0104-0.0087(R2=0.9956)见图1,计算所得K值为97.90,从而得到试验中碱性蛋白酶活力为1.8×105U/g,中性蛋白酶的酶活力为1.1×105U/g。
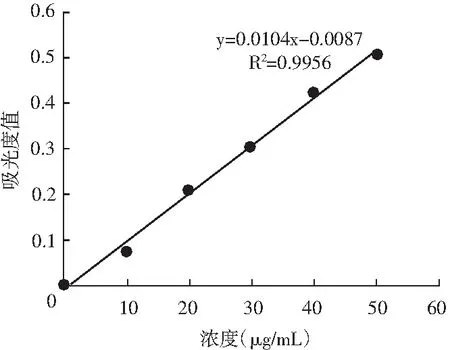
图1 酪氨酸标准曲线Fig.1 The standard curve of tyrosine
3.2 SDS-PAGE电泳分析
分子量的大小和氨基酸组成是影响多肽生物活性和功能特性的两个重要因素。以往的研究表明,蛋白质水解物拥有高含量低分子量肽的抗氧化作用强于高分子量肽。碱性蛋白酶和中性蛋白酶酶解牡丹籽蛋白还原性SDS-PAGE电泳见图2。

图2 牡丹籽蛋白水解物的SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoretogram of TPSP hydrolysates
由图2可知,在还原性条件下,牡丹籽蛋白(TPSP)的电泳条带主要包括60,48,38,23 kDa 4个条带。根据Gao等先前的结果,60 kDa条带是TPSP中的主要组分,其主要由酸性亚基(38 kDa)和碱性亚基(23 kDa)组成。在中性蛋白酶水解物中分子量为48,38,23 kDa的3个条带消失,一些小分子量条带经中性蛋白酶酶解后出现在分子量15 kDa以下,而60 kDa的条带随着时间的增加并未发生改变。对于碱性蛋白酶水解物,在牡丹籽蛋白中出现的所有蛋白质条带均完全消失,产生的低分子量条带(<15 kDa)强度随着水解时间的增加而逐渐增加。Shazly等[15]也得到了类似的结果。他们报道称在还原条件下,碱性蛋白酶可广泛水解所有酪蛋白组分,产生<3.5 kDa的分子量条带在SDS-PAGE图谱中。在长达4 h的水解过程中,经碱性蛋白酶水解的水解物中观察到了从较高分子量带向较低分子量带的明显转变,说明碱性蛋白酶具有较强的水解牡丹籽蛋白的能力,这可能是因为碱性蛋白酶是一种非特异性的内肽酶,适于生产小分子量肽,同时这也可能有利于获得具有较高活性的抗氧化肽。
3.3 氨基酸组成分析

Table 1 牡丹籽蛋白水解物的氨基酸组成Table 1 The amino acid composition of TPSP hydrolysates
除了分子量外,氨基酸的组成也会影响肽的抗氧化活性[16]。由表1可知,碱性蛋白酶和中性蛋白酶水解未对牡丹籽蛋白的氨基酸组成的种类造成影响,但对氨基酸的含量产生了显著的影响。牡丹籽蛋白及其酶解产物均含有丰富的天冬氨酸(Asp)、谷氨酸(Glu)、亮氨酸(Leu)和精氨酸(Arg)。其中,Asp和Glu在牡丹籽蛋白中共占整个氨基酸含量的22.67%,而在碱性蛋白酶和中性蛋白酶水解物中占据23.33%~28.61%。牡丹籽蛋白及其酶解产物富含酸性氨基酸(Asp+Glu=NCAA),这可能是因为酸性氨基酸为牡丹籽蛋白中典型的氨基酸。之前的研究报道在油菜籽蛋白和澳大利亚菜籽粕蛋白及其水解物中也存在高含量的酸性氨基酸[17-18]。另外,呈味氨基酸Asp、Glu、甘氨酸(Gly)和丙氨酸(Ala)在碱性蛋白酶水解物和中性蛋白酶水解物中分别占据30.15%~36.03%和29.38%~32.79%,说明牡丹籽蛋白水解物均能够提高原料的鲜味和甘味,可用来开发调味料。
疏水氨基酸(HAA)在碱性蛋白酶水解物中的含量随着酶解的进行逐渐增加,占总氨基酸含量的23.85%~28.26%,而在中性蛋白酶水解物中HAA的含量呈现先增加后减少的趋势,在酶解3 h时达到最大值25.56%。早有研究表明NCAA侧链中的羧基和氨基被认为是金属离子的螯合剂[19]。同时,也有研究报道称蛋白质水解产物的HAA具有供电子能力,从而赋予肽较强的自由基清除能力。因此,牡丹籽蛋白酶解产物中高含量的NCAA和HAA相对于未水解蛋白,这可能说明碱性蛋白酶和中性蛋白酶酶解有利于提高牡丹籽蛋白的抗氧化活性。除此之外,与牡丹籽蛋白相比(63.03%),总氨基酸含量(64.62%~69.31%)在碱性蛋白酶和中性蛋白酶水解物中均有所提升,除了中性蛋白酶在水解1 h时(62.31%)略微下降。而且,碱性蛋白酶和中性蛋白酶水解物含有丰富的必需氨基酸,其EAA/TAA的比值(30.31%~31.68%)明显高于未水解蛋白(28.31%),这说明碱性蛋白酶和中性蛋白酶水解有利于提高牡丹籽蛋白的营养价值。
3.4 抗氧化活性的分析
3.4.1 ABTS自由基的清除活性
浓度为0.5 mg/mL的牡丹籽蛋白及其酶解产物对ABTS自由基清除效果见图3。
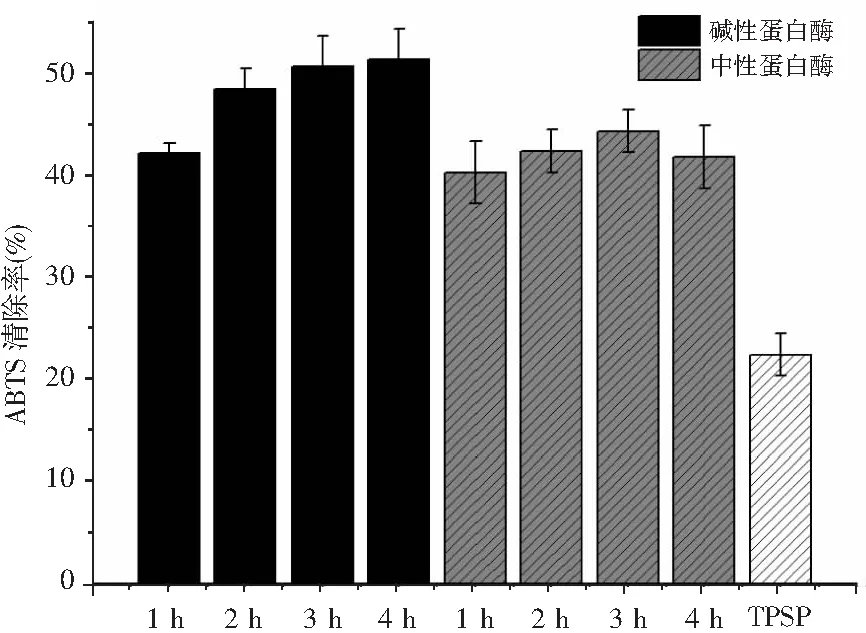
图3 牡丹籽蛋白水解物的ABTS自由基清除率Fig.3 ABTS free radical scavenging rate of TPSP hydrolysates
碱性蛋白酶和中性蛋白酶水解有利于提高牡丹籽蛋白对ABTS自由基的清除活性。随着酶解反应的进行,中性蛋白酶水解物对ABTS自由基清除能力呈现先增加后减小的趋势,在水解3 h时达到最大值44.23%,而随着水解反应时间增加到4 h,其清除率从44.23%下降到41.73%。而与中性蛋白酶相比,碱性蛋白酶水解牡丹籽蛋白4 h后的水解物对ABTS自由基的清除能力最高,达到了51.22%。碱性蛋白酶水解物对ABTS自由基的清除能力随着水解时间的增加而增加。牡丹籽蛋白水解物对ABTS自由基清除活性的差异可能是由于酶的种类和水解时间对肽的分子量大小和氨基酸组成造成的影响。Rajapakse等报道称蛋白水解物的自由基清除作用与HAA或肽的疏水性有关。由表1可知,HAA的含量在碱性蛋白酶水解物中(23.85%~28.26%)明显高于中性蛋白酶水解物(23.10%~25.56%)。因此,高含量的HAA增强了碱性蛋白酶水解物在脂类食品体系中的溶解度,从而促进其与引起氧化损伤的自由基之间更好地相互作用。而中性蛋白酶在酶解4 h时对ABTS自由基清除能力低于水解3 h,表明有限的水解相比于过度水解可导致更好的抗氧化能力,因为过度水解可导致肽的HAA或活性基团被水解酸,中性蛋白酶水解物在4 h时HAA含量的下降证明了这一点。
3.4.2 ·OH自由基清除活性
作为在人体内产生的活性氧种类之一,·OH自由基可以很容易地与生物分子发生反应,例如氨基酸、蛋白质、DNA,并导致机体生理异常。因此,清除·OH自由基可以防止某些疾病的产生。牡丹籽蛋白及其酶解产物(浓度1.5 mg/mL)对·OH自由基的清除能力见图4。
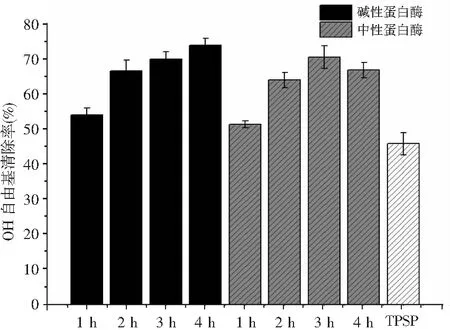
图4 牡丹籽蛋白水解物的·OH自由基清除活性Fig.4 ·OH free radical scavenging activity of TPSP hydrolysates
由图4可知,碱性蛋白酶和中性蛋白酶水解产物清除·OH自由基的效果相当。在水解的1 h时,碱性蛋白酶和中性蛋白酶酶解并未明显提高蛋白的·OH自由基清除能力,而随着水解反应的进一步进行,水解物的·OH自由基清除活性显著性增加。当水解反应到3 h时,碱性蛋白酶和中性蛋白酶水解物对·OH自由基的清除能力从45.69%(TPSP)分别增加到69.81%和70.3%。在整个水解过程中,中性蛋白酶水解物的最大清除率发生在水解3 h时。然而,对于碱性蛋白酶水解物,·OH自由基清除能力的变化趋势与ABTS自由基清除活性相似,随着水解时间的增加而增加,在水解反应4 h时达到最大清除率73.66%。碱性蛋白酶和中性蛋白酶在酶解1 h后可提高蛋白的·OH自由基清除能力,这可能是由于随着水解反应的进行更多的HAA被释放出来。
3.4.3 Fe2+螯合能力
过渡金属铁和铜等过渡金属离子可作为Fenton反应的催化剂,促进超氧阴离子的产生和过氧化氢向羟基自由基的转化,从而引发脂质过氧化反应。因此,具有螯合金属离子能力的水解产物可以有效地减少脂质氧化。牡丹籽蛋白及其酶解产物(浓度0.5 mg/mL)对Fe2+的螯合能力见图5。

图5 牡丹籽蛋白水解物的Fe2+螯合能力Fig.5 Fe2+ chelating capacity of TPSP hydrolysates
由图5可知,碱性蛋白酶和中性蛋白酶水解仅1 h,Fe2+的螯合能力分别从45.12%(TPSP)提高到63.36%和60.80%。随着酶解反应进行到3 h,其螯合率分别达到最大值70.39%和67.77%。这一结果说明,与未水解蛋白相比,水解肽作为电子或氢原子供体的能力有所提高。通常情况下,Fe2+的螯合能力归功于蛋白水解物中存在有高含量的NCAA,其侧链中的羧基和氨基被认为是金属离子的螯合剂。经氨基酸组成(见表1)分析证实,碱性蛋白酶和中性蛋白酶水解物均含有丰富的NCAA。
3.4.4 还原力
在测定自由基清除剂还原力试验中,强还原物质可以用作电子和氢的良好供体,使游离自由基变为稳定的物质,从而阻碍自由基链式反应的进行,并与过氧化物的前体物质结合,防止过氧化物的产生,从而达到抗氧化剂的作用[20]。有关研究显示物质的抗氧化活性与还原力之间存在着正相关性关系。还原性物质可以将溶液中的Fe3+还原为Fe2+,而自身发生氧化,使溶液的颜色发生改变,通过在700 nm波长下测定其吸光值可计算出铁被还原的程度,从而得到该物质的还原力的大小。牡丹籽蛋白及其酶解产物(浓度1.5 mg/mL)的还原力效果见图6。在中性蛋白酶水解的1,2,3 h内,所对应的还原力值从0.3850~0.3670无明显变化,而在水解4 h后出现最大值0.4127。相反,在碱性蛋白酶水解的4 h,还原力值从0.3533增加到0.4473。经碱性蛋白酶和中性蛋白酶水解后的水解物还原力得到明显提高。蛋白质水解产物还原能力的提高可以解释为蛋白质的肽链断裂被水解成小分子肽,从而具有抗氧化活性的氨基酸(如天冬氨酸、谷氨酸和组氨酸)的释放和自由基清除能力的提高。

图6 牡丹籽蛋白水解物的还原力Fig.6 Reducing capacity of TPSP hydrolysates
4 结论
碱性蛋白酶具有较强的水解牡丹籽蛋白的能力,仅在酶解1 h即可完全水解牡丹籽蛋白的所有条带。且其水解物具有较好的清除ABTS、·OH自由基和鳌合Fe2+的能力。碱性蛋白酶水解物中丰富的酸性氨基酸(Asp+Glu=NCAA)可作为Fe2+的鳌合剂,可以有效地抑制过渡金属离子(尤其是过渡金属铁)作为Fenton反应催化剂,引发的超氧阴离子及羟基自由基的产生,从而减少脂质过氧化反应。高含量的疏水性氨基酸(HAA)可以增强碱性蛋白酶水解物在脂类食品体系中的溶解度,从而促进其与引起氧化损伤的自由基之间更好地相互作用。因此,上述结果表明牡丹籽蛋白经碱性蛋白酶解后得到的水解物具有抑制食品因油脂或蛋白质氧化造成的腐败变质的潜力。本研究可为牡丹籽蛋白水解物作为一种天然抗氧化剂添加到食品中的实际应用效果提供参考依据。今后有必要开展碱性蛋白酶水解物在食品及其调味品中的实际应用研究,以拓展牡丹籽蛋白肽作为天然抗氧化剂在食品中的应用和开发。

