长链非编码RNA DLX6-AS1在肿瘤中的研究进展
段秋香?陈程?彭彬峰?姜孝新
【摘要】近年来,长链非编码RNA(lncRNA)可作为抑癌或促癌因子参与肿瘤的多种生物过程,包括增殖、抗凋亡、侵袭和迁移,其异常表达与患者预后、临床病理学特征及耐药紧密相关。DLX6-AS1是最近发现的一种新型lncRNA,其在多种恶性肿瘤中表达上调,并与肿瘤预后、TNM分期、淋巴结转移和远处转移相关,且可与多种微小RNA相互作用调节下游靶基因及相关信号通路发挥促癌作用。该文就lncRNA DLX6-AS1参与人类肿瘤的生物学过程和调控机制作一综述。
【关键词】长链非编码核糖核酸;DXL6-AS1;微小核糖核酸;肿瘤
Research progress on long non-coding RNA DLX6-AS1 in tumors Duan Qiuxiang, Chen Cheng, Peng Binfeng, Jiang Xiaoxin. Department of Laboratory Medicine, the First Affiliated Hospital of Nanhua University,Hengyang 421000, China
Corresponding author, Jiang Xiaoxin, E-mail: jiangxiaoxin168@ 126. com
【Abstract】In recent years, long non-coding RNA(lncRNA) has been reported to be involved in a variety of tumor biological processes as a tumor suppressor or tumor-promoting factor, including proliferation, anti-apoptosis, invasion and migration. Abnormal expression of lncRNA is closely correlated with patient prognosis, clinicopathological characteristics and drug resistance. As a newly-discovered lncRNA, DLX6-AS1 is abnormally expressed in a variety of malignant tumors, which is positively correlated with poor tumor prognosis, late stage, lymph node metastasis and distant metastasis. DLX6-AS1 interacts with microRNA to regulate the downstream target genes and signaling pathways and promote tumorigenesis. In this article, the role and regulatory mechanism of DLX6-AS1 in the biological process of human tumors were reviewed.
【Key words】Long non-coding ribonucleic acid;DLX6-AS1;Micro ribonucleic acid;Tumor
癌症是全球范围内导致死亡的主要原因,在过去的5年中,中国的新增癌症病例数和死亡人数逐年增加[1]。尽管目前有多种方法可用来治疗癌症,包括手术、放射治疗、化学治疗和靶向药物治疗等,但多类癌症的总生存率依旧不尽人意,大多数癌症早期诊断困难且进展迅速,一旦发现即为中晚期,因此在癌症的早期诊断、临床治疗和预后评估中,探索更加敏感且有效的新型肿瘤标志物和治疗靶点十分必要[2]。近年来,长链非编码RNA(lncRNA)逐渐成为研究的热点,这是一类长度大于200个核苷酸且不编码蛋白质的一类RNA,在过去被称为转录“噪音”,但随着研究的不断深入,现已发现它们在多种恶性肿瘤中异常表达。Evans等(2016年)认为lncRNA在对抗癌症中,已成为一类非常有研究前景和应用价值的基因。DLX6-AS1是最近发现的一种新型lncRNA,在多种恶性肿瘤中高表达并促进肿瘤的发生发展,本文就lncRNA DLX6-AS1在多种肿瘤中的作用及其分子机制作一综述。
一、lncRNA DLX6-AS1简介
LncRNA DLX6-AS1是DLX6的反义RNA,属于DLX基因家族,位于染色体7q21.3带的1990 bp的非编码转录体,其首次被发现是在人的正常脑组织中,并参与人体发育调控[3-5]。近年来的研究表明,DLX6-AS1在肝细胞癌、胃癌、胰腺癌、大肠癌、乳腺癌、宫颈癌等多种恶性肿瘤中表达上调,且参与细胞的增殖、凋亡、侵袭、转移等多种生物学过程的调控,与肿瘤大小、淋巴结转移、TNM 分期和患者总生存期有关,有望成为多种肿瘤的临床诊断标志物和临床治疗的新靶点[4-14]。
二、DLX6-AS1与肿瘤相关性及其分子机制
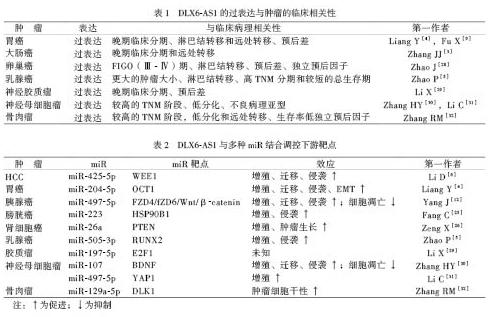
近年来多项实验证实,lncRNA DLX6-AS1参与了多种恶性肿瘤的进展,我们总结了DLX6-AS1与不同肿瘤患者临床病理特征的相关性(表1),通过与微小RNA(miR)和编码蛋白质的mRNA形成lncRNA/miR/mRNA轴调控多种肿瘤发生发展的生物学过程(表2)。
1.消化道肿瘤
1.1食管鳞状细胞癌(ESCC)
食管癌是常見的消化系统恶性肿瘤,欧美国家大多数食管癌病理类型为腺癌,而我国则以食管鳞癌居多(约占90%),其发病率和病死率较高[15]。Wu等[16]发现DLX6-AS1在ESCC组织中的表达水平明显升高,下调DLX6-AS1的表达,可抑制ESCC细胞的增殖和转移;一系列相关实验证实DLX6-AS1可通过膜吸附miR-577来促进食管鳞癌的发生和转移。Wang等(2019年)认为与癌旁组织相比,DLX6-AS1在ESCC组织中高度表达,并与肿瘤低分化、淋巴结转移、远处转移呈正相关。且DLX6-AS1基因敲除可明显抑制ESCC细胞的增殖、侵袭和迁移能力,促进细胞凋亡,影响ESCC细胞的上皮-间充质转化(EMT)过程。这些结果提示DLX6-AS1可能是治疗ESCC的新候选靶点。
1.2肝细胞癌(HCC)
HCC是全球公认最常见的恶性肿瘤,其发病率正在逐年增高[17]。Li等[6]报道,用实时定量PCR(qRT-PCR)检测到DLX6-AS1在HCC组织和細胞中均过表达,荧光素酶报告基因和RNA免疫沉淀实验证实,DLX6-AS1可与miR-424-5p的 3UTR 结合,且miR-424-5p的靶基因为原癌基因WEE1。Wu等[7]采用基于微阵列的分析方法,筛选出在HCC组织中差异表达的DLX6-AS1,发现其在肝癌细胞和肝癌干细胞(LCSC)中表达上调。沉默DLX6-AS1的表达可抑制LCSC球形细胞和集落的形成、肿瘤形成能力、LCSC相关标志物及多种LCSC下游相关基因的表达。此外,研究者还发现DLX6-AS1可以募集LCSC中甲基转移酶,导致细胞黏附分子1(CADM1)启动子甲基化,进而激活STAT3信号通路,促使HCC的发生。Zhang等[8]发现与癌旁组织相比,在60例HCC组织标本中DLX6-AS1的表达水平上调,且DLX6-AS1过表达与HCC患者预后不良相关,在体内或体外沉默DLX6-AS1的表达均能抑制肿瘤的生长。生物信息学分析及荧光素酶报告基因预测到miR-203与DLX6-AS1、MMP-2与miR-203a之间均存在靶向关系,后续研究验证了上述分子轴在HCC中的作用。
1.3胃 癌
胃癌早期难以诊断,大多数胃癌患者发现时已经是晚期乃至全身转移,而目前对于胃癌相关基因的研究仍然是一个难点[18]。Liang等[4] 和Fu等[9]有相同的发现,DLX6-AS1在胃癌组织和细胞系中均表达上调,并与胃癌晚期临床分期、远处转移和临床预后差有关。Wu等[10]证实DLX6-AS1通过介导多功能的DNA/RNA结合蛋白(FUS)调节丝裂原活化蛋白激酶1(MAPK1)促进胃癌细胞的增殖、迁移和EMT。
1.4胰腺癌
An等(2018年)认为DLX6-AS1在胰腺癌组织中过表达,且其过表达与肿瘤大小、肿瘤进展期和淋巴结转移呈正相关。沉默DLX6-AS1的表达可明显抑制肿瘤细胞的增殖、迁移和侵袭能力。研究者还发现在胰腺癌中miR-181b为DLX6-AS1的下游靶点,而miR-181b可作用于锌指E-box 结合同源盒2,这一信号轴可调节EMT过程。此外,Yang等[12]发现过表达的DLX6-AS1与胰腺癌患者的低存活率相关,且可促进胰腺癌细胞增殖、迁移和侵袭,并抑制细胞凋亡。皮下成瘤模型和BALB/c裸鼠模型中过表达DLX6-AS1明显促进肿瘤的生长,而沉默DLX6-AS1可以减少肺和肝脏中转移灶的数量。
1.5大肠癌
目前大肠癌的临床治疗方法主要包括手术切除、放射治疗和化学治疗,但其治愈率和五年生存率仍然很低[19]。有学者发现DLX6-AS1在60例大肠癌组织中表达上调,且DLX6-AS1过表达与肿瘤分期进展及远处转移呈正相关。细胞实验和动物实验表明,DLX6-AS1过表达可以促进大肠癌细胞系的增殖、侵袭、迁移及抑制细胞凋亡,而沉默DLX6-AS1则可抑制裸鼠移植瘤的生长。研究者还发现DLX6-AS1过表达可引起磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、p-AKT和雷帕霉素靶蛋白(mTOR)水平的升高,表明DLX6-AS1可能是通过PI3K/AKT/mTOR信号通路促进了大肠癌的病变。Zhou等(2019年)发现DLX6-AS1基因敲低可明显抑制大肠癌细胞的增殖、迁移和侵袭,且DLX6-AS1可通过在大肠癌中海绵化miR-577而充当竞争性内源RNA(ceRNA)。Kong等(2020年)发现处于晚期或已有淋巴结转移的大肠癌患者体内具有更高的DLX6-AS1表达水平,DLX6-AS1与miR-26a之间以及miR-26a与EZH2之间均存在靶向关系。
2.呼吸道肿瘤
2.1鼻咽癌
鼻咽癌是一种起源于鼻咽部黏膜上皮的恶性肿瘤,在我国南方地区较为高发。Yang等(2020年)认为DLX6-AS1在鼻咽癌中表达上调,进一步实验表明,敲低DLX6-AS1或上调miR-199a-5p均可在体外抑制鼻咽癌细胞的增殖、迁移和侵袭。研究者进一步发现DLX6-AS1可以作为一种ceRNA结合miR-199a-5p,从而调节低氧诱导因子-1的表达。以上研究表明,低氧诱导因子-1在肿瘤组织中的异常表达可能与DLX6-AS1和miR-199a/b-5p水平的紊乱有关,这说明lncRNA与人体微环境存在一定的联系。
2.2 喉鳞状细胞癌(LSCC)
Yang等[21]发现,与正常喉部组织相比,LSCC组织中DLX6-AS1的表达水平上调,而敲低DLX6-AS1可抑制LSCC细胞的侵袭和生长,减少S期阶段的细胞,增加G0 ~ G1期的细胞。研究表明miR-376c具有与DLX6-AS1的互补结合位点,且沉默DLX6-AS1后增强了LSCC细胞中miR-376c的表达。这些数据表明DLX6-AS1可能通过调节miR-376c在LSCC中起促癌作用。Liu等(2020年)认为DLX6-AS1表达水平与原发肿瘤的大小、临床分期和转移相关,Kaplan-Meier生存分析结果显示,DLX6-AS1表达较高的患者其总生存期较低。另外细胞功能实验和裸鼠成瘤实验证实高表达的DLX6-AS1可在体内和体外通过DLX6-AS1/miR-26a/TRPC3轴调节线粒体对钙的摄取和活性氧的产生,从而促进喉癌的增殖。
2.3 肺 癌
Sun等(2019年)认为DLX6-AS1在非小细胞肺癌(NSCLC)肿瘤组织和细胞系中过表达,其表达水平与NSCLC患者的肿瘤大小和临床分期呈正相关。DLX6-AS1的下调抑制了NSCLC细胞增殖、迁移和侵袭及克隆形成,也能有效抑制肿瘤的生长。此外,DLX6-AS1表达与miR-27b-3p表达呈负相关,与GSPT1表达呈正相关。Huang等[22]报道DLX6-AS1可以通过下调miR-144 和上调PRR11的表达,从而抑制 NSCLC体内肿瘤生长。
3.泌尿系统肿瘤
3.1膀胱癌
膀胱癌是我国泌尿外科癌症中影响男性健康的主要癌症之一。手术切除和化学治疗是膀胱癌治疗的两个主流[23]。Guo等[24]发现DLX6-AS1在膀胱癌组织和细胞表达上调,其高表达与TNM分期、淋巴结转移和远处转移密切相关。DLX6-AS1过表达可促进膀胱癌细胞的增殖、侵袭、迁移和EMT。异种移植裸鼠模型表明,敲低DLX6-AS1组可抑制癌细胞的生长、下调EMT相关标志物的表达和降低Wnt/β-catenin 信号转导。Fang等[25]利用生信分析和相关实验,确定了一个新的癌基因热休克蛋白90B1是miR-223的功能靶点,在膀胱癌细胞中通过介导miR-223发挥抑癌作用,随后找到与miR-223有结合位点,且与膀胱癌患者生存、预后紧密相关的lncRNA DLX6-AS1。
3.2肾细胞癌
Zeng等[26]发现DLX6-AS1在肾细胞癌中也高表达,且DLX6-AS1基因敲除能显著抑制癌细胞的生长,集落形成。此外,在异种移植瘤模型中发现DLX6-AS1基因敲除抑制了肾细胞癌的体内生长,研究者们还发现DLX6-AS1与miR-26a之间以及miR-26a与PTEN之间存在靶向关系。
4.生殖系统和乳腺肿瘤
4.1宫颈癌
Tian等[14]发现与正常宫颈组织相比,宫颈癌组织中DLX6-AS1的表达水平明显升高。DLX6-AS1基因敲除后,宫颈癌细胞的生长和侵袭能力均受到抑制,FUS的表达也受到明显抑制,裸鼠成瘤实验表明DLX6-AS1沉默后可抑制裸鼠成瘤的能力,于是推测DLX6-AS1可能通过上调FUS来促进宫颈癌细胞的增殖和转移。Xie等(2020年)认为DLX6-AS1在细胞中也过表达,下调DLX6-AS1后不仅减弱了细胞的增殖、迁移和EMT的能力,还促进了细胞凋亡。在异种移植小鼠模型中,沉默DLX6-AS1可抑制宫颈癌的生长。
4.2 卵巢癌
You等[27]发现DLX6-AS1在卵巢癌组织中的表达高于癌旁组织。DLX6-AS1基因敲除后,癌细胞迁移和侵袭受到抑制,而上调DLX6-AS1后结果相反。研究者发现miR-613是DLX6-AS1在卵巢癌中直接作用的靶点,后续功能实验证实DLX6-AS1可通过靶向miR-613,来增强卵巢癌细胞的迁移和侵袭能力。Zhao等[28]首次证实了DLX6-AS1在上皮性卵巢癌(EOC)患者中表达上调,过表达DLX6-AS1与肿瘤FIGO分期、淋巴结转移及预后差有明显相关性,DLX6-AS1是EOC患者的独立预后因子。在功能上,下调DLX6-AS1的表达可抑制EOC细胞的增殖、迁移及侵袭且加速细胞凋亡,其Notch信号的活性也受到了抑制。
4.3 乳腺癌
Zhao等[5]发现DLX6-AS1在乳腺癌组织中表达明显上调,其高表达的DLX6-AS1與患者病情恶化有关,包括肿瘤大小、淋巴结转移、TNM 分期和较短的总生存期。DLX6-AS1基因敲除可抑制癌细胞增殖,侵袭、迁移和EMT,并促进癌细胞凋亡。生信分析表明DLX6-AS1可充当miR-505-3p的海绵,且miR-505-3p可直接与致癌基因RUNT相关的转录因子2结合,后续相关研究验证了上述的预测。
5.中枢神经系统肿瘤
5.1神经胶质瘤
Li等[29]发现DLX6-AS1在神经胶质瘤组织和细胞中过表达,且DLX6-AS1的过表达与胶质瘤患者预后不良有关。沉默DLX6-AS1表达可抑制神经胶质瘤细胞的增殖、侵袭和生长。体内异种移植小鼠模型显示DLX6-AS1沉默可抑制体内肿瘤生长。且miR-197-5p可以同时作用于DLX6-AS1和转录因子E2F1,支持DLX6-AS1通过吸附miR-197-5p来减轻E2F1,加速了胶质瘤的发生。
5.2神经母细胞瘤(NB)
Zhang等[30]发现DLX6-AS1在NB的组织和细胞中高度表达,且其高表达与NB的高TNM分期、低分化相关。DLX6-AS1基因敲除可诱导神经元分化、促进NB细胞凋亡、抑制体内外NB的生长。有研究者还发现miR-107是DLX6-AS1的下游靶点,且能下调脑源性神经营养因子(BDNF)的表达。Li等[31]发现DLX6-AS1过表达与不良的病理亚型、晚期临床分期和MYCN癌基因扩增密切相关。Kaplan-Meier生存分析显示,DLX6-AS1的过表达与NB患者的低总体生存率相关。此外,DLX6-AS1可靶向miR-497-5p/Yes相关蛋白1(YAP1)轴促进NB的增殖、迁移和侵袭。
6.骨肿瘤
Zhang等(2019年)认为DLX6-AS1在骨肉瘤组织和细胞系中显著上调,且其高表达与患者的TNM分期,肿瘤分化程度和远处转移相关。敲低DLX6-AS1可抑制骨肉瘤细胞增殖、侵袭和迁移,并促进细胞凋亡。在骨肉瘤中,过表达的DLX6-AS1作为竞争性内源RNA负调节miR-641,进而上调同源盒蛋白HOXA9表达来促进骨肉瘤的进展。Zhang等[32]在80对骨肉瘤标本中发现DLX6-AS1过表达,且其过表达与患者晚期临床分期和不良组织学分级有关,单因素和多因素Cox分析表明DLX6-AS1的低表达和早期AJCC分期(Ⅰ ~ Ⅱ)延长了骨肉瘤患者总生存率,是骨肉瘤患者的一个独立预后因素。敲低DLX6-AS1的骨肉瘤细胞注入裸鼠后其肿瘤形成能力降低,进一步的机制实验证实了DLX6-AS1通过结合miR-129a-5p来上调DLK1,并触发WNT信号刺激骨肉瘤的干性。
7.其 他
Zhong等(2019年)认为DLX6-AS1在甲状腺癌中过表达,可通过下调UPF1基因促进甲状腺癌细胞的迁移和侵袭。Lei等(2019年)认为DLX6-AS1在尤因肉瘤中同样过表达,并能充当miR-124-3p的海绵,而miR-124-3p可以直接靶向细胞周期蛋白依赖性激酶4 mRNA的3-UTR,但这分子轴调控的生物学效应尚未阐明。
三、小結与展望
DLX6-AS1是近期发现的一种新型lncRNA,并作为一种致癌因子在多种恶性肿瘤中过表达。目前发现其主要的调控机制是充当竞争内源性RNA与miR结合调节下游靶基因发挥促癌作用。过表达的DLX6-AS1与患者临床病理学特征及预后密切相关,这表明它可以作为肿瘤患者临床诊断和预后评估的潜在生物学标志物,未来有望在临床诊断和治疗上运用。但DLX6-AS1在恶性肿瘤上游和下游的精确调控机制还未完全阐明,且其在血清或其他生物样品中的稳定性和表达水平也未明确,这使得其在临床运用上有一定的局限性,故需要研究者们更进一步的探究,揭示DLX6-AS1更多潜在功能。
参 考 文 献
[1] Wu C, Li M, Meng H, Liu Y, Niu W, Zhou Y, Zhao R, Duan Y, Zeng Z, Li X, Li G, Xiong W, Zhou M. Analysis of status and countermeasures of cancer incidence and mortality in China. Sci China Life Sci,2019,62(5):640-647.
[2] Chi Y, Wang D, Wang J, Yu W, Yang J. Long non-coding RNA in the pathogenesis of cancers. Cells,2019,8(9):1015.
[3] Zhang JJ, Xu WR, Chen B, Wang YY, Yang N, Wang LJ, Zhang YL. The up-regulated lncRNA DLX6-AS1 in colorectal cancer promotes cell proliferation, invasion and migration via modulating PI3K/AKT/mTOR pathway. Eur Rev Med Pharmacol Sci,2019,23(19):8321-8331.
[4] Liang Y, Zhang CD, Zhang C, Dai DQ. DLX6-AS1/miR-204-5p/OCT1 positive feedback loop promotes tumor progression and epithelial-mesenchymal transition in gastric cancer. Gastric Cancer,2020,23(2):212-227.
[5] Zhao P, Guan H, Dai Z, Ma Y, Zhao Y, Liu D. Long noncoding RNA DLX6-AS1 promotes breast cancer progression via miR-505-3p/RUNX2 axis. Eur J Pharmacol,2019,865:172778.
[6] Li D, Tang X, Li M, Zheng Y. Long noncoding RNA DLX6-AS1 promotes liver cancer by increasing the expression of WEE1 via targeting miR-424-5p. J Cell Biochem,2019,120(8):12290-12299.
[7] Wu DM, Zheng ZH, Zhang YB, Fan SH, Zhang ZF, Wang YJ, Zheng YL, Lu J. Down-regulated lncRNA DLX6-AS1 inhibits tumorigenesis through STAT3 signaling pathway by suppressing CADM1 promoter methylation in liver cancer stem cells. J Exp Clin Cancer Res,2019,38(1):237.
[8] Zhang L, He X, Jin T, Gang L, Jin Z. Long non-coding RNA DLX6-AS1 aggravates hepatocellular carcinoma carcinogenesis by modulating miR-203a/MMP-2 pathway. Biomed Phar-macother,2017,96:884-891.
[9] Fu X, Tian Y, Kuang W, Wen S, Guo W. Long non-coding RNA DLX6-AS1 silencing inhibits malignant phenotypes of gastric cancer cells. Exp Ther Med,2019,17(6):4715-4722.
[10] Wu Q, Ma J, Meng W, Hui P. DLX6-AS1 promotes cell proliferation, migration and EMT of gastric cancer through FUS-regulated MAP4K1. Cancer Biol Ther,2020,21(1):17-25.
[11] An Y, Chen XM, Yang Y, Mo F, Jiang Y, Sun DL, Cai HH. LncRNA DLX6-AS1 promoted cancer cell proliferation and invasion by attenuating the endogenous function of miR-181b in pancreatic cancer. Cancer Cell Int,2018,18:143.
[12] Yang J, Ye Z, Mei D, Gu H, Zhang J. Long noncoding RNA DLX6-AS1 promotes tumorigenesis by modulating miR-497-5p/FZD4/FZD6/Wnt/β-catenin pathway in pancreatic cancer. Cancer Manag Res,2019,11:4209-4221.
[13] Zhou FR, Pan ZP, Shen F, Huang LQ, Cui JH, Cai K, Guo XL. Long noncoding RNA DLX6-AS1 functions as a competing endogenous RNA for miR-577 to promote malignant development of colorectal cancer. Eur Rev Med Pharmacol Sci,2019,23(9):3742-3748.
[14] Tian Y, Wang YR, Jia SH. Knockdown of long noncoding RNA DLX6-AS1 inhibits cell proliferation and invasion of cervical cancer cells by downregulating FUS. Eur Rev Med Pharmacol Sci,2019,23(17):7307-7313.
[15] 黃楚坚, 蔡松华, 杜隆德, 马锴. 食管鳞癌以手术治疗为主的多学科治疗新研究进展.中国癌症防治杂志,2020,12(4):463-468.
[16] Wu SB, Wang HQ. Upregulation of long noncoding RNA DLX6-AS1 promotes cell growth and metastasis in esophageal squamous cell carcinoma via targeting miR-577. Eur Rev Med Pharmacol Sci,2020,24(3):1195-1201.
[17] Zhu Y, Cui PJ, Yao J, Zhang ZY, Yang J. Efficacy of transarterial chemoembolisation with or without antiviral therapy for patients with hepatocellular carcinoma after radical hepatectomy. Gastroenterol Res Pract,2018,2018:6414759.
[18] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin,2015,65(1):5-29.
[19] Sun S, Xia C, Xu Y. HIF-1α induced lncRNA LINC00511 accelerates the colorectal cancer proliferation through positive feedback loop. Biomed Pharmacother,2020,125:110014.
[20] 陈嘉荣, 阮扬皓, 张银英, 李坊铭, 邓利秾, 梁素霞, 陈国健. 阿片类药物治疗鼻咽癌患者放射性口腔黏膜炎疼痛的研究进展.新医学,2020,51(8):576-580.
[21] Yang Q, Sun J, Ma Y, Zhao C, Song J. LncRNA DLX6-AS1 promotes laryngeal squamous cell carcinoma growth and invasion through regulating miR-376c. Am J Transl Res,2019,11(11):7009-7017.
[22] Huang Y, Ni R, Wang J, Liu Y. Knockdown of lncRNA DLX6-AS1 inhibits cell proliferation, migration and invasion while promotes apoptosis by downregulating PRR11 expression and upregulating miR-144 in non-small cell lung cancer. Biomed Pharmacother,2019,109:1851-1859.
[23] Su Y, Feng W, Shi J, Chen L, Huang J, Lin T. circRIP2 accelerates bladder cancer progression via miR-1305/Tgf-β2/smad3 pathway. Mol Cancer,2020,19(1):23.
[24] Guo J, Chen Z, Jiang H, Yu Z, Peng J, Xie J, Li Z, Wu W, Cheng Z, Xiao K. The lncRNA DLX6-AS1 promoted cell proliferation, invasion, migration and epithelial-to-mesenchymal transition in bladder cancer via modulating Wnt/β-catenin signaling pathway. Cancer Cell Int,2019,19:312.
[25] Fang C, Xu L, He W, Dai J, Sun F. Long noncoding RNA DLX6-AS1 promotes cell growth and invasiveness in bladder cancer via modulating the miR-223-HSP90B1 axis. Cell Cycle,2019,18(23):3288-3299.
[26] Zeng X, Hu Z, Ke X, Tang H, Wu B, Wei X, Liu Z. Long noncoding RNA DLX6-AS1 promotes renal cell carcinoma progression via miR-26a/PTEN axis. Cell Cycle,2017,16(22):2212-2219.
[27] You Q, Shi HY, Gong CF, Tian XY, Li S. Long non-coding RNA DLX6-AS1 acts as an oncogene by targeting miR-613 in ovarian cancer. Eur Rev Med Pharmacol Sci,2019,23(15):6429-6435.
[28] Zhao J, Liu HR. Down-regulation of long noncoding RNA DLX6-AS1 defines good prognosis and inhibits proliferation and metastasis in human epithelial ovarian cancer cells via Notch signaling pathway. Eur Rev Med Pharmacol Sci,2019,23(8):3243-3252.
[29] Li X, Zhang H, Wu X. Long noncoding RNA DLX6-AS1 accelerates the glioma carcinogenesis by competing endogenous sponging miR-197-5p to relieve E2F1. Gene,2019,686:1-7.
[30] Zhang HY, Xing MQ, Guo J, Zhao JC, Chen X, Jiang Z, Zhang H, Dong Q. Long noncoding RNA DLX6-AS1 promotes neuroblastoma progression by regulating miR-107/BDNF pathway. Cancer Cell Int,2019,19:313.
[31] Li C, Wang S, Yang C. Long non-coding RNA DLX6-AS1 regulates neuroblastoma progression by targeting YAP1 via miR-497-5p. Life Sci,2020,252:117657.
[32] Zhang RM, Tang T, Yu HM, Yao XD. LncRNA DLX6-AS1/miR-129-5p/DLK1 axis aggravates stemness of osteosarcoma through Wnt signaling. Biochem Biophys Res Commun,2018,507(1-4):260-266.
(收稿日期:2020-05-12)
(本文編辑:杨江瑜)

