藏药佐太中单质硫对β-HgS中汞溶出的影响
刘志滔,张明,耿卢婧,杜玉枝,魏立新,尚靖
(1.中国科学院西北高原生物研究所,青海省藏药药理学和安全性评价研究重点实验室,青海 西宁 810008;2.中国科学院藏药研究重点实验室,青海 西宁 810008;3.中国科学院大学,北京 100049)
药物安全性评价是药物研究开发的基础[1-3],而汞化合物的药用历史已有数千年,目前传统民族药物中仍有大量口服含汞制剂用于临床,其安全性备受关注[4].藏药佐太是一种由水银和硫磺等原料经复杂炮制加工而制得黑色粉末状制剂,是珍宝类藏成药中最为核心的成分,至今仍是制备七十味珍珠丸、仁青常觉、仁青芒觉、坐珠达西和佐塔德子玛等名贵珍宝类藏药的必需原料,被誉为“藏药之王”[5].硫化汞(HgS)和单质硫(S0)是藏药佐太的主要成分[5-7],二者含量超过90%[8].佐太中HgS的主要存在形式是β-HgS[5-7,9],其性质不溶于水,理论上难以被机体吸收[10],但动物实验表明,β-HgS及藏药佐太口服后,其汞均可经胃肠道而被机体吸收[11-13].因此,藏药佐太中还含有的S0及胃肠道环境很可能是促进二者汞溶出的重要因素.
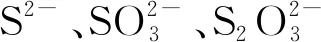
1 材料与方法
1.1 试剂
β-HgS(AR,英国Alfa Asear公司);升华硫(AR,天津恒兴化学试剂制造有限公司);L-Cys(美国Sigma-Aldrich公司);汞元素标准溶液(1 000 mg/L,国家有色金属及电子材料分析测试中心);硝酸(UP,苏州晶瑞化学股份有限公司);盐酸(GR,华北特种试剂有限公司);氯化钠、氢氧化钠、邻苯二甲酸氢钾、磷酸二氢钾、氯化钾、硼酸、重铬酸钾、九水硫化钠、无水亚硫酸钠、硫代硫酸钠均为分析纯试剂;试验中所用氧气、氮气纯度在99.99%以上.
1.2 仪器
固相液相直接测汞仪(DMA-80,意大利Milestone公司);超纯水仪(18.2 MΩ·cm,Milli-Q-Reference,美国Millipore公司);pH计(PB-10,美国Sartorius公司);十万分之一电子天平(ME204,瑞士Mettler Toledo公司);水浴恒温振荡器(SHA-BA,常州朗越仪器制造有限公司);高速冷冻离心机(3K-15,德国Sigma公司).
1.3 溶液的配制
汞标准贮备液(1 000 μg/L):向1 000 mL容量瓶中加入0.05%硝酸重铬酸钾溶液600 mL,然后加入1 mL汞元素标准溶液(1 000 mg/L),用0.05%硝酸重铬酸钾溶液定容至刻度,混匀后密封保存于4 ℃冰箱备用.
汞标准溶液:用汞标准储备液和0.05%硝酸重铬酸钾溶液配制系列浓度为0,2,5,10,20,50,100,150,200,300,500,700,1 000 μg/L的汞标准溶液.
模拟胃液(不含胃蛋白酶)和肠液(不含胰蛋白酶)的配制参照美国药典[18].模拟胃液:将2.0 g氯化钠溶于500 mL超纯水,加入7.0 mL浓盐酸,混匀后用超纯水定容至1 L,溶液pH值约为1.2.模拟肠液:将6.8 g磷酸二氢钾溶于250 mL超纯水,搅拌使之溶解后加入77 mL的0.2 mol/L的氢氧化钠溶液和500 mL超纯水,使用0.2 mol/L的氢氧化钠溶液或0.2 mol/L的盐酸调节pH值至6.8,用超纯水定容至1 L.
pH 1.2~9.6缓冲溶液的配制参考美国药典,配制过程如下:取A溶液50 mL置于200 mL容量瓶中,加入一定量的B液,用超纯水定容至刻度.A、B液的种类和加入体积见表1.
含200 mg/L L-Cys的模拟胃液和肠液:称取200.0 mg L-Cys置于蓝盖试剂瓶中,分别加入模拟胃液和肠液,摇晃使之溶解,即得.为了避免溶液中的氧气对L-Cys的氧化,加入的模拟胃液和肠液在使用前需通氮气饱和以去除其中的氧气,临用现配.
含200 mg/L L-Cys的pH 1.2~9.6缓冲溶液:称取L-Cys 40.0 mg,置于蓝盖试剂瓶中,分别加入氮气饱和过的pH 1.2~9.6缓冲溶液各200 mL,摇晃使之溶解,即得.临用现配.
硫化钠、亚硫酸钠、硫代硫酸钠浓度分别为1~1 000 mg/L的含200 mg/L L-Cys的模拟肠液:分别称取769.4 mg九水硫化钠,250.0 mg亚硫酸钠,250.0 mg硫代硫酸钠于220 mL模拟肠液中,振荡使之溶解,调节pH值至6.8,用模拟肠液定容至250 mL,即得硫化钠、亚硫酸钠、硫代硫酸钠浓度分别为1 000 mg/L的模拟肠液.然后再逐级稀释成硫化钠、亚硫酸钠、硫代硫酸钠浓度分别为1,2,5,10,20,50,100,200,500 mg/L的模拟肠液.称取L-Cys 50.0 mg,置于蓝盖试剂瓶中,分别加入氮气饱和过的硫化钠、亚硫酸钠、硫代硫酸钠浓度分别为1~1 000 mg/L的模拟肠液250 mL,摇晃使之溶解,即得.所有溶液调节pH值至6.8,临用现配.

表1 不同pH值缓冲溶液配制时A、B液的种类和加入量
1.4 体外溶出试验
根据佐太的炮制工艺中水银与硫磺的投料比计算[16],佐太中HgS和S0的含量分别约为54.4%和39.4%.为了模拟佐太中β-HgS和S0组成,试验中β-HgS和S0的称样量分别为35.0 mg和26.0 mg.本研究中试验的选择参考了胃肠道生理条件,pH范围为1.2~9.6,覆盖了胃肠道pH范围[19];L-Cys浓度为200 mg/L,为胃肠道中可能达到的L-Cys浓度[20].
体外溶出试验过程如下:①分别量取含或不含L-Cys的模拟胃、肠液和pH 1.2~9.6缓冲溶液45 mL于60 mL具塞广口瓶中,每种溶液设置β-HgS组和β-HgS+S0组(β-HgS组:溶液中含有35.0 mg β-HgS;β-HgS+S0组:溶液中含有35.0 mg β-HgS和26.0 mg S0),摇匀,平行操作5次.分别量取硫化钠、亚硫酸钠、硫代硫酸钠浓度为1~1 000 mg/L的含L-Cys的模拟肠液各45 mL于60 mL具塞广口瓶中,再分别加入35 mg β-HgS,摇匀,平行操作5次.根据胃肠道生理条件[21],将上述广口瓶置于水浴恒温振荡器中,在37 ℃下振荡温孵3 h,振荡速度为100 r/min.温孵结束后,吸取浸出液1.5 mL,转入离心管,在室温下以10 000g离心20 min.离心后取上清液0.8 mL,转入离心管,测定汞含量.
1.5 汞含量测量
本试验使用DMA-80型固相液相直接测汞仪测定汞含量.该仪器的线性范围分为2段:低浓度范围0~20 ng Hg;高浓度范围20~1 000 ng Hg.以0~1 000 μg/L浓度的汞标准溶液上样0.1 mL,仪器工作站软件根据汞吸收峰峰高自动绘制汞标准曲线,结果见图1.取0.1 mL汞标准溶液(100 μg/L)连续上样10次,计算测量值的相对标准偏差(RSD),结果见表2.
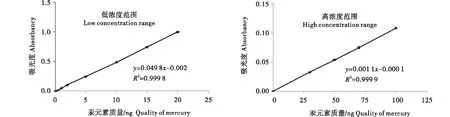
图1 汞工作曲线Figure 1 Working curve of mercury
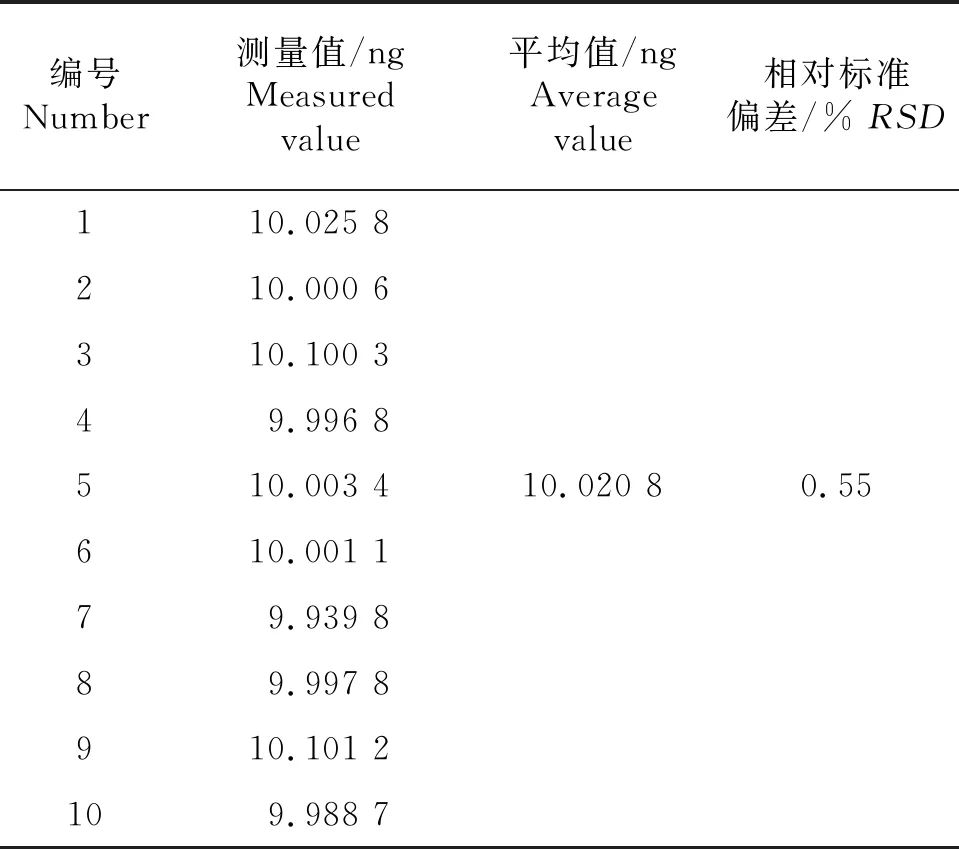
表2 DMA-80固相液相直接测汞仪精密度试验
1.6 统计学分析
2 结果与分析
2.1 汞含量测定标准曲线及精密度
如图1所示,低浓度范围的汞标准曲线为y=0.049 8x-0.002,R2=0.999 8;高浓度范围的汞标准曲线为y=0.001 1x-0.000 1,R2=0.999 9.其中,y代表吸光度,x代表汞元素质量(ng).这说明该方法在0~20 ng 及20~1 000 ng Hg范围内线性关系良好.由表2可知,10次测量值范围为9.939 8~10.101 2 ng,平均值为10.020 8 ng,RSD=0.55%,测量精密度良好.
2.2 S0对β-HgS中汞溶出的影响
2.2.1 S0对β-HgS在模拟胃液和肠液中汞溶出的影响 本试验测定了β-HgS、β-HgS+S0分别在含或不含200 mg/L L-Cys的模拟胃液和肠液中溶出的汞浓度,测定结果见表3.由表3可知,与β-HgS组比较,β-HgS+S0组在不含L-Cys的模拟肠液中溶出的汞浓度显著降低(P<0.01),其降低倍数为2.1倍;β-HgS+S0组在含L-Cys的模拟胃液和肠液中溶出的汞浓度显著降低(P<0.001),其降低倍数分别为2.5倍和174.8倍;β-HgS+S0组在不含L-Cys的模拟胃液中溶出的汞浓度无显著性差异.该结果表明,S0可抑制β-HgS在不含L-Cys的模拟肠液以及含L-Cys的模拟胃液和肠液中的汞溶出;S0对β-HgS在不含L-Cys的模拟胃液中的汞溶出无明显影响.
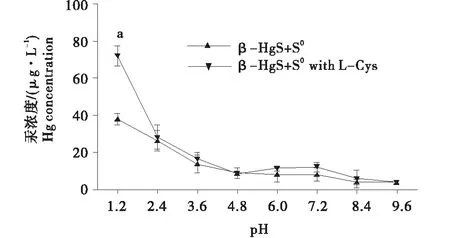
2.2.2 S0对β-HgS中汞溶出的影响与pH及L-Cys的关系 试验2.2.1中发现,S0对β-HgS在含或不含L-Cys的模拟胃液和肠液中汞溶出的作用存在一定差异.鉴于上述溶液的主要区别是pH和L-Cys,S0对β-HgS中汞溶出影响可能与此二者有关.为了探究S0对β-HgS中汞溶出影响与pH及L-Cys的关系,本试验测定了β-HgS、β-HgS+S0分别在含或不含200 mg/L L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度,测定结果见图2~3.

表3 β-HgS、β-HgS+S0分别在含或不含L-Cys的模拟胃液和肠液中溶出的汞浓度(n=5)
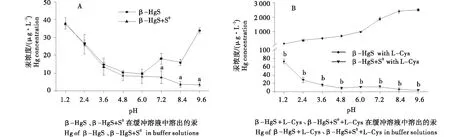
与β-HgS组比较,a表示P<0.01;与β-HgS with L-Cys组比较,b表示P<0.01.Comparing with β-HgS group,a indicates P<0.01;Comparing with β-HgS with L-Cys group,b indicates P<0.01.
与β-HgS+S0组比较,a表示P<0.001.Comparing with β-HgS+S0 group,a indicates P<0.001.图3 S0对β-HgS中汞溶出的影响与L-Cys的关系(n=5)Figure 3 The relation of L-Cys with the effect of sulfur on Hg dissolution of β-HgS(n=5)
由图2-A中可以看出,β-HgS在不含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度随着pH升高呈现“U”型的变化趋势(图中为β-HgS组);β-HgS+S0在不含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度随着pH升高呈现“逐渐降低”的趋势(图中为β-HgS+S0组).2组比较,β-HgS+S0在不含L-Cys的pH 7.2,8.4,9.6缓冲溶液中溶出的汞浓度均显著降低(P<0.01),在不含L-Cys的pH 1.2~6.0缓冲溶液中溶出的汞浓度无显著差异.由图2-B中可知,β-HgS在含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度随着pH升高呈现“逐渐升高”的趋势(图中为β-HgS with L-Cys组);β-HgS+S0在含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度随着pH升高呈现“逐渐降低”的趋势(图中为β-HgS+S0with L-Cys组).两组比较,β-HgS+S0在含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度均显著降低(P<0.01).该结果提示,S0抑制β-HgS中汞溶出的作用与pH有关.S0可抑制β-HgS在不含L-Cys的pH 7.2~9.6条件和含L-Cys的pH 1.2~9.6条件下的汞溶出,但对β-HgS在不含L-Cys的pH 1.2~6.0条件下的汞溶出无明显影响.
由图3中可以看出,β-HgS+S0在含或不含L-Cys的pH 1.2~9.6缓冲溶液中溶出的汞浓度随着pH升高均呈“逐渐降低”的趋势.两组比较,β-HgS+S0with L-Cys组仅在pH 1.2条件下溶出的汞浓度显著高于β-HgS+S0(P<0.001),其它pH条件下无显著差异.该结果提示,S0抑制β-HgS中汞溶出的作用与L-Cys关系较小.
综合以上结果,S0可抑制β-HgS在不含L-Cys的模拟肠液以及含L-Cys模拟胃液和肠液中的汞溶出.该抑制作用与溶液的pH条件有关,与溶液中L-Cys存在与否关系较小.
2.3 S0抑制β-HgS在含L-Cys的模拟肠液中汞溶出的机制探索
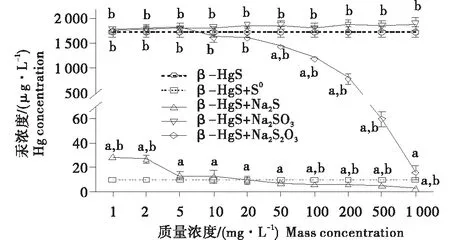
如前所述,S0极为显著地抑制了β-HgS在含L-Cys的模拟肠液中的汞溶出.为考察S0以何种离子影响了β-HgS在含L-Cys的模拟肠液中汞溶出,本试验用Na2S、Na2SO3、Na2S2O3分别代表这3种离子,测定了β-HgS在Na2S、Na2SO3、Na2S2O3浓度分别为1~1 000 mg/L的含200 mg/L L-Cys的模拟肠液中溶出的汞浓度,并将这三者对β-HgS中汞溶出的作用与S0的作用进行对比,测定及对比结果见图4.
由图4可以看出,β-HgS在Na2S和Na2S2O3浓度分别为1~1 000 mg/L的含L-Cys的模拟肠液中溶出的汞浓度随二者浓度的增加均呈现“逐渐降低”的趋势(图中分别为β-HgS+Na2S组和β-HgS+Na2S2O3组).β-HgS在Na2SO3浓度为1~1 000 mg/L的含L-Cys的模拟肠液中溶出的汞浓度随Na2SO3浓度的增加而呈现“平稳”的趋势(图中为β-HgS+Na2SO3组).
与β-HgS组比较,β-HgS+Na2S(1~1 000 mg/L)组和β-HgS+Na2S2O3(50~1 000 mg/L)组溶出的汞浓度均显著降低(P<0.01),但是β-HgS+Na2S2O3(1~20 mg/L)组和β-HgS+Na2SO3(1~1 000 mg/L)组溶出的汞浓度无显著变化.这提示Na2S和Na2S2O3分别在1~1 000 mg/L和50~1 000 mg/L下可抑制β-HgS在含L-Cys的模拟肠液中的汞溶出,抑制作用随着二者浓度升高而增强,但是Na2SO3在1~1 000 mg/L下对β-HgS的汞溶出无明显影响.
与β-HgS组比较,a表示P<0.01;与β-HgS+S0组比较,b表示P<0.01.β-HgS组和β-HgS+S0组不做比较.Comparing with β-HgS group,a indicates P<0.01;Comparing with β-HgS+S0 group,b indicates P<0.01.No comparison between β-HgS group andβ-HgS+S0 group.图4 Na2S、Na2SO3、Na2S2O3分别对β-HgS在含L-Cys的模拟肠液中溶出汞浓度的影响及其与S0影响的对比(n=5)Figure 4 Effect of Na2S,Na2SO3,Na2S2O3 on dissolved Hg concentrations of β-HgS in simulated intestinal fluid with L-Cys and the comparison with the effect of S0(n=5)
与β-HgS+S0组比较,β-HgS+Na2S(1~2 mg/L)组、β-HgS+Na2S2O3(1~500 mg/L)组和β-HgS+Na2SO3(1~1 000 mg/L)组溶出的汞浓度均显著高于β-HgS+S0组(P<0.01);β-HgS+Na2S(100~1 000 mg/L)组溶出的汞浓度显著低于β-HgS+S0组(P<0.01);仅β-HgS+Na2S(5~50 mg/L)组和β-HgS+Na2S2O3(1 000 mg/L)组溶出的汞浓度与β-HgS+S0组无显著性差异.这提示Na2S和Na2S2O3分别在5~50 mg/L和1 000 mg/L下抑制β-HgS在含L-Cys的模拟肠液中汞溶出的作用与S0的抑制作用相似.
3 讨论
前期研究表明,佐太在不含L-Cys的模拟肠液以及含L-Cys的模拟胃液和肠液中溶出的汞浓度显著低于β-HgS[15],但在不含L-Cys的模拟胃液中溶出的汞浓度显著高于β-HgS[114-15].本研究模拟佐太中β-HgS和S0组成,并比较β-HgS、β-HgS和S0混合物的汞溶出情况,其结果显示,S0可抑制β-HgS在不含L-Cys的模拟肠液以及含L-Cys的模拟胃液和肠液中的汞溶出,但对β-HgS在不含L-Cys的模拟胃液中的汞溶出无明显影响.虽然佐太的主要成分是β-HgS和S0,但是佐太中还含有少量的碳单质及其它金属的硫化物和氧化物等[5,22],仍无法判断S0是造成佐太与β-HgS汞溶出差异的原因.而S0对β-HgS在不含L-Cys的模拟胃液中溶出的汞浓度无明显作用的原因可能是S0在酸性条件下性质较为稳定[17].
本研究还发现,Na2S和Na2S2O3分别在5~50 mg/L和1 000 mg/L下抑制β-HgS在含L-Cys的模拟肠液中汞溶出的作用与S0的抑制作用相似.本试验是将26 mg S0溶于45 mL含L-Cys的模拟肠液中,其浓度为577.8 mg/L.根据S0的反应方程式[17],S0完全溶解后理论上可产生703.1 mg/L的Na2S和712.3 mg/L的Na2S2O3.但是实验中S0并未完全溶解,溶液中仍肉眼可见部分S0,故溶液中Na2S和Na2S2O3的实际浓度远低于其理论值.当溶液中Na2S和Na2S2O3浓度均较低时,Na2S2O3抑制β-HgS中汞溶出的作用远不及Na2S.有文献指出,S0在中性或弱碱条件下能够生成S2-[17],并且S2-可抑制β-HgS在pH 6.0~8.0条件下的汞溶出[23].本实验所用L-Cys的模拟肠液的pH为6.8,满足S0通过生成S2-抑制β-HgS汞溶出的条件.而曾克武等[24]的研究结果显示,Na2S可促进朱砂中汞的溶出.但朱砂中汞的存在形式为α-HgS,其存在形式的不同可能导致S2-对二者汞溶出的影响出现相反结果.同时,该研究中所用溶液的pH值远大于6.8,pH的不同也可能造成S2-对二者汞溶出影响的巨大差异.
4 结论
综上所述,S0是造成β-HgS在不含L-Cys的模拟肠液和含L-Cys的模拟胃、肠液中溶出的汞浓度显著降低的主要因素;S0主要通过生成S2-来抑制β-HgS在含L-Cys的模拟肠液中的汞溶出.通过本研究,探究了S0在藏药佐太中的存在意义,对佐太及含佐太的珍宝类藏药的安全性评价也具有重要的参考价值.

