何首乌九蒸九晒炮制工艺的优化研究
蒲俊安 张思敏 刘梦娇 肖望重 杨磊
摘 要 目的:建立测定何首乌中二苯乙烯苷、大黄素、大黄素甲醚和总多糖含量的方法,并优化何首乌传统九蒸九晒的炮制工艺。方法:采用高效液相色谱法检测二苯乙烯苷、大黄素、大黄素甲醚的含量;采用紫外分光光度法检测总多糖的含量。以蒸制时间、烘制时间、烘制温度为自变量,二苯乙烯苷、大黄素、大黄素甲醚和总多糖含量为指标,结合加权综合评分法和星点设计-效应面法优化何首乌九蒸九晒的炮制工艺并验证。结果:二苯乙烯苷、大黄素、大黄素甲醚检测进样量的线性范围分别为0.27~2.7 ?g(r=0.997 1)、0.063~0.63 ?g(r=0.999 9)、0.038~0.38 ?g(r=0.990 9),总多糖检测质量浓度的线性范围为2.07~12.42 ?g/mL(r=0.999 6);精密度、稳定性、重复性试验的RSD均小于2%;加样回收率分别为99.43%~101.06%(RSD=0.63%,n=6)、98.74%~120.33%(RSD=1.34%,n=6)、98.39%~102.44%(RSD=1.49%,n=6)、99.51%~101.98%(RSD=0.87%,n=6)。最优炮制工艺为蒸制时间4.5 h、烘制时间9 h、烘制温度66 ℃,反复炮制9次。3次验证试验结果显示,最优炮制工艺的平均综合评分为35.69分,與预测值(36.90分)的相对误差为3.30%。结论:所建含量测定方法操作简便、重复性好;优化所得炮制工艺预测性良好且稳定、可行。
关键词 何首乌;九蒸九晒;星点设计-效应面法;高效液相色谱法;紫外分光光度法;炮制工艺;含量测定;工艺优化
中图分类号 R283.3 文献标志码 A 文章编号 1001-0408(2020)22-2713-07
DOI 10.6039/j.issn.1001-0408.2020.22.05
ABSTRACT OBJECTIVE: To establish methods for the content determination of stilbene glycoside, emodin, emodin methyl ether and total polysaccharide in P. multiflorum, and to optimize the processing technology of traditional nine-time repeat steaming and sun-drying process of P. multiflorum. METHODS: HPLC method was adopted to determine the contents of stilbene glycoside, emodin, and emodin methyl ether. The content of total polysaccharide was determined by UV spectrometry. With steaming time, drying time and drying temperature as independent variables, the contents of stilbene glycoside, emodin, emodin methyl ether and total polysaccharide as indexes, the processing technology of nine-time repeat steaming and sun-drying process of P. multiflorum was optimized by weighted comprehensive score method and central composite design-response surface method, and the validation tests were conducted. RESULTS: The linear range of sample size of stilbene glycoside, emodin and emodin methyl ether were 0.27-2.7 ?g(r=0.997 1), 0.063-0.63 ?g(r=0.999 9), 0.038-0.38 ?g(r=0.990 9), respectively. The linear range of mass concentration of total polysaccharide was 2.07-12.42 ?g/mL(r=0.999 6), respectively. RSDs of precision, stability and reproducibility tests were all lower than 2%. The recoveries were 99.43%-101.06%(RSD=0.63%,n=6), 98.74%-120.33%(RSD=1.34%,n=6), 98.39%-102.44%(RSD=1.49%,n=6), 99.51%-101.98%(RSD=0.87%,n=6), respectively. The optimal processing technology was steaming time for 4.5 h, drying time for 9 h, drying temperatrue for 66 ℃ and repeat processing for 9 times. Results of 3 times of validation tests showed that the comprehensive score of optimal technology was 35.69, relative error of which to predicted value (36.90) was 3.30%. CONCLUSIONS: Established method is simple and reproducible, and the optimal processing technology is predicive, stable feasible.
KEYWORDS Polygonum multiflorum; Nine-time repeat steaming and sun-drying process; Central composite design- response surface methodology; HPLC; UV spectrometry; Processing technology; Content determination; Technology optimization
何首乌为蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根,其生品具有解毒、消痈、截疟、润肠通便的功效,炮制品则具有补肝肾、益精血、乌须发、强筋骨、化浊、降脂等作用[1],临床应用广泛。近年来,有关何首乌肝毒性的不良反应报道日益增多[2-4],使其用药安全受到质疑,因此何首乌的炮制方法受到学者普遍关注。九蒸九晒是何首乌的传统炮制方法[5],该炮制方法较2015年版《中国药典》(一部)收载的制何首乌蒸法(清蒸或黑豆汁拌匀后蒸至内外均为棕褐色)[1]更加细致、复杂。本课题组前期研究以及相关文献均初步证实,经九蒸九晒后,何首乌的肝毒性较生品降低[6-7],但这一炮制工艺尚无统一标准,炮制流程有待规范。何首乌成分较复杂,主要含有蒽醌类、黄酮类、甾体类、二苯乙烯苷等成分[8]。现代研究表明,二苯乙烯苷、游离蒽醌类及多糖类成分均具有抗衰老、抗氧化等药理作用[8],且多糖类成分还具有调剂免疫的作用[9],故其炮制工艺研究多以二苯乙烯苷、游离蒽醌或多糖为评价指标[10-11],但鲜有将3者同时作为炮制工艺考察指标的报道。
星点设计-效应面法因具有精密度好、可信度高、试验次数少、应用方便等特点而被广泛应用于中药炮制工艺的筛选研究[12-14]。基于此,本研究采用高效液相色谱法(HPLC)测定二苯乙烯苷、大黄素、大黄素甲醚的含量,采用紫外分光光度法(UV)测定总多糖的含量;以蒸制时间、烘制时间、烘制温度为自变量,二苯乙烯苷、大黄素、大黄素甲醚和总多糖含量为指标,同时结合加权综合评分法和星点设计-效应面法对何首乌九蒸九晒的炮制工艺进行优化,旨在为该炮制工艺的科学化与规范化提供参考。
1 材料
1.1 儀器
1260 Infinity Ⅱ型HPLC仪,包括二极管阵列检测器、LC1260色谱工作站(美国Agilent公司);UV-9000S型UV计(上海元析仪器有限公司);XMTB-8000型干燥箱(余姚市金宏仪器厂);AR2140型万分之一电子分析天平(上海海鸿仪器有限公司);SK5200H型超声波清洗器(上海科导超声仪器有限公司,功率:200 W,频率:53 kHz);TG16-WS型台式高速离心机(湖南湘仪实验仪器开发有限公司);DMD-J-24型经济型节能蒸柜(广州市多美多厨房设备有限公司)。
1.2 药品与试剂
何首乌药材(湖南南国药都中药饮片有限公司,批号:20180285)、黑豆饮片(湖南三湘中药饮片有限公司,批号:20180613)经湖南中医药大学第一附属医院药学部张志国教授鉴定分别为何首乌P. multiflorum Thunb.的干燥块根、黑豆Glycine max(L.) Merr.的干燥成熟种子;二苯乙烯苷对照品(批号:110844-201915,纯度:≥98%)、大黄素对照品(批号:110756-201913,纯度:≥98%)、D-无水葡萄糖对照品(批号:110833- 201908,纯度:≥98%)均购自中国食品药品检定研究院;大黄素甲醚对照品(批号:110758-201817,纯度:≥98%)购自成都曼思特生物科技有限公司;乙腈、甲醇、乙醇均为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 何首乌九蒸九晒样品的制备
参考前期试验方法[6],取何首乌药材10 kg,加入黑豆汁2.5 kg(取黑豆1 kg,加水5 kg,置于节能蒸柜中煎煮所得)搅拌均匀,待黑豆汁全部吸收,平均分成20份,分别按后续星点设计-响应面法设计相应试验条件重复蒸制9次,即得样品20批(编号:S1~S20)。
2.2 二苯乙烯苷的含量测定
2.2.1 色谱条件 色谱柱:Agilent ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈-水(25 ∶ 75,V/V);流速:1 mL/min;检测波长:320 nm;柱温:30 ℃;进样量:10 μL。
2.2.2 对照品溶液的制备 取二苯乙烯苷对照品2.7 mg,精密称定,置于10 mL量瓶中,加入50%乙醇溶解并定容,制成质量浓度为0.27 mg/mL的对照品溶液。
2.2.3 供试品溶液的制备 取“2.1”项下何首乌九蒸九晒样品,粉碎后取粉末0.2 g,精密称定,置于具塞锥形瓶中,加入50%乙醇25 mL,密塞,称定质量,加热回流提取30 min,放冷,再次称定质量,用50%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 空白对照溶液 以50%乙醇为空白对照溶液。
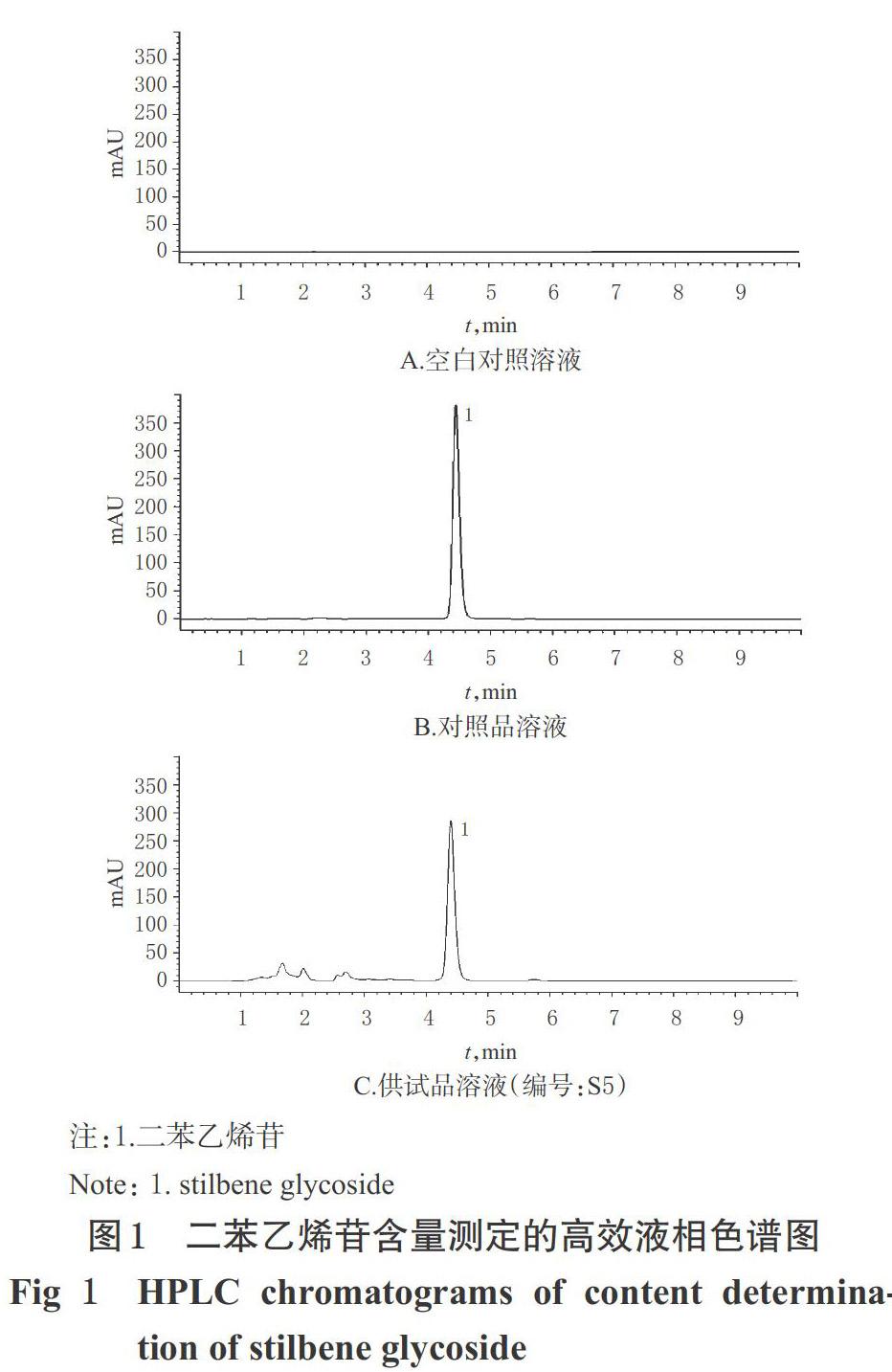
2.2.5 系统适用性试验 取上述空白对照溶液、对照品溶液、供试品溶液各适量,按“2.2.1”项下色谱条件进样测定,记录色谱图,详见图1。由图1可知,二苯乙烯苷对应色谱峰的分离度为4.71,理论板数为8 366,与其余成分均基线分离,且空白对照对测定无干扰。
2.2.6 线性关系考察 取“2.2.2”项下对照品溶液1、2、4、8、10 mL,分别置于10 mL量瓶中,加入50%乙醇稀释并定容,制得不同质量浓度的标准溶液,按“2.2.1”项下色谱条件进样,记录色谱图。以二苯乙烯苷进样量(X,?g)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果,二苯乙烯苷的回归方程Y=256.45X+1 364.9(r=0.997 1),表明二苯乙烯苷检测进样量的线性范围为0.27~2.7 ?g。
2.2.7 精密度试验 精密吸取“2.2.2”项下对照品溶液适量,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,二苯乙烯苷峰面积的RSD为0.98%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 精密称取“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末0.2 g,共6份,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果,二苯乙烯苷含量的RSD为0.99%(n=6),表明方法重复性良好。
2.2.9 稳定性试验 取 “2.2.3”项下供试品溶液(编号:S5,星点设计序号:5)适量,分别于室温下放置0、2、4、6、8、10、12、24 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,二苯乙烯苷峰面积的RSD为1.08%(n=8),表明供试品溶液于室温下放置24 h内稳定性良好。
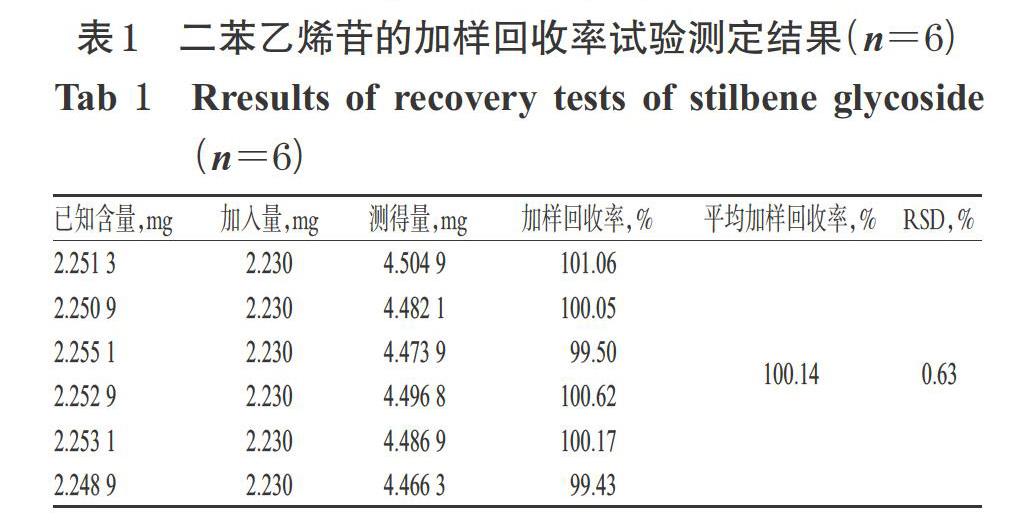
2.2.10 加样回收率试验 精密称取已知含量的“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末0.2 g,共6份,加入二苯乙烯苷对照品2.230 mg,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。
2.2.11 样品含量测定 取20批“2.1”项下九蒸九晒样品粉末适量,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。
2.3 游离蒽醌的含量测定
2.3.1 色谱条件 色谱柱:Agilent ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸水溶液(80 ∶ 20,V/V);流速:1 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:10 μL。
2.3.2 混合对照品溶液的制备 取大黄素、大黄素甲醚对照品适量,精密称定,加入甲醇溶解并定容,制成大黄素、大黄素甲醚质量浓度分别为63.0、38.4 ?g/mL的混合对照品溶液。
2.3.3 供試品溶液的制备 取“2.1”项下何首乌九蒸九晒样品粉末1 g,精密称定,置于具塞锥形瓶中,加入甲醇50 mL,密塞,称定质量,加热回流提取1 h,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.4 阴性对照溶液 以甲醇为阴性对照溶液。
2.3.5 系统适用性试验 取上述阴性对照溶液、混合对照品溶液、供试品溶液各适量,按“2.3.1”项下色谱条件进样测定,记录色谱图,详见图2。由图2可知,大黄素对应色谱峰的分离度为2.32,理论板数为13 513;大黄素甲醚对应色谱峰的分离度为20.33,理论板数为16 212;与其余成分均基线分离,且阴性对照对测定无干扰。
2.3.6 线性关系考察 取“2.3.2”项下混合对照品溶液1、2、4、8、10 mL,分别置于10 mL量瓶中,加入甲醇稀释并定容,制得不同质量浓度的标准溶液,按 “2.3.1”项下色谱条件进样测定,记录色谱图。以各待测成分进样量(X,?g)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果,大黄素、大黄素甲醚的回归方程分别为Y=202.04X-0.652 2(r=0.999 9),Y=56.176X+0.311 9(r=0.990 9),表明大黄素、大黄素甲醚检测进样量的线性范围分别为0.063~0.63、0.038~0.38 ?g。
2.3.7 精密度试验 精密吸取“2.3.2”项下混合对照品溶液适量,按“2.3.1”项下色谱条件连续进样测定6次,记录峰面积。结果,大黄素、大黄素甲醚峰面积的RSD分别为1.19%、0.99%(n=6),表明仪器精密度良好。
2.3.8 重复性试验 取“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末1 g,共6份,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果,大黄素、大黄素甲醚含量的RSD分别为1.62%、1.31%(n=6),表明方法重复性良好。
2.3.9 稳定性试验 取 “2.3.3”项下供试品溶液(编号:S5,星点设计序号:5)适量,分别于室温下放置0、2、4、6、8、10、12、24 h时按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,大黄素、大黄素甲醚峰面积的RSD分别为1.51%、1.27%(n=8),表明供试品溶液于室温下放置24 h内稳定性良好。
2.3.10 加样回收率试验 精密称取已知含量的“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末1 g,共6份,加入大黄素对照品1.290 mg、大黄素甲醚对照品0.890 mg,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.3.11 样品含量测定 取20批“2.1”项下何首乌九蒸九晒样品粉末适量,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。
2.4 总多糖的含量测定
2.4.1 对照品溶液的制备 取干燥至恒定质量的D-无水葡萄糖对照品适量,精密称定,加水稀释,制成质量浓度为0.207 mg/mL的对照品溶液。
2.4.2 供试品溶液的制备 取“2.1”项下何首乌九蒸九晒样品粉末1 g,精密称定,置于具塞锥形瓶中,加入95%乙醇20 mL,加热回流2 h,滤过,滤渣经95%乙醇洗涤3次并挥干,加水25 mL,于70 ℃超声提取50 min,放冷,以2 000 r/min离心5 min,取上清液,重复超声提取2次,合并上清液,取1 mL,加水定容至100 mL量瓶中,即得。
2.4.3 阴性对照溶液 取6%苯酚溶液1 mL、硫酸5 mL,置于10 mL具塞比色管中,加水至刻度,混勻,即得。
2.4.4 检测波长的确定 精密吸取上述对照品溶液0.5 mL、供试品溶液1.0 mL,分别置于10 mL具塞比色管中,精密加入6%苯酚溶液1 mL,混匀;加入硫酸5 mL,混匀;加水至刻度,混匀。另取阴性对照溶液10 mL。将上述溶液分别置于水浴中显色15 min后,于300~700 nm全波长范围内进行扫描。结果,对照品与供试品在490 nm波长处有最大吸收,阴性对照无干扰,故选择检测波长为490 nm,详见图3。
2.4.5 线性关系考察 分别精密吸取“2.4.1”项下对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,按“2.4.4”项下方法显色后,于490 nm波长处测定吸光度。以D-无水葡萄糖质量浓度(X,?g/mL)为横坐标、吸光度(Y)为纵坐标进行线性回归。结果,D-无水葡萄糖的回归方程为Y=1.225 3X+0.074(r=0.999 6),表明D-无水葡萄糖检测质量浓度的线性范围为2.07~12.42 ?g/mL。
2.4.6 精密度试验 取“2.4.1”项下对照品溶液0.5 mL,按“2.4.4”项下方法显色后,于490 nm波长处连续测定6次吸光度。结果,D-无水葡萄糖吸光度的RSD为1.34%(n=6),表明仪器精密度良好。
2.4.7 重复性试验 精密称取“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末1 g,共6份,按“2.4.2”项下方法制备供试品溶液,再按“2.4.4”项下方法显色后,于490 nm波长处测定吸光度并按标准曲线法计算样品含量。结果,总多糖含量(以D-无水葡萄糖计)的RSD为1.52%(n=6),表明方法重复性良好。
2.4.8 稳定性试验 取“2.4.2”项下供试品溶液(编号:S5,星点设计序号:5)适量,按“2.4.4”项下方法显色,分别于室温下放置0、2、4、6、8、10、12、24 h时于490 nm波长处测定吸光度。结果,D-无水葡萄糖吸光度的RSD为0.82%(n=8),表明供试品溶液于室温下放置24 h内稳定性良好。
2.4.9 加样回收率试验 精密称取已知含量的“2.1”项下何首乌九蒸九晒样品(编号:S5,星点设计序号:5)粉末1 g,共6份,按“2.4.2”项下方法制备供试品溶液;取1 mL,置于具塞比色管中,加入D-无水葡萄糖对照品溶液适量,按“2.4.4”项下方法显色后,于490 nm波长处测定吸光度并计算加样回收率,结果见表3。
2.5 炮制工艺的优化
2.5.1 试验设计 根据星点设计原理[15-16],并结合预试验结果,以蒸制时间(A)、烘制时间(B)、烘制温度(C)为自变量,二苯乙烯苷、游离蒽醌(大黄素、大黄素甲醚含量合计值)、总多糖含量为指标;同时,结合加权评分法,参考相关文献[6-7,9]及前期预试验结果进行权重处理,最终确定综合评分计算公式为:Y=Y1×30/Y(1max)+Y2×30/Y(2max)-Y3×40/Y(3max)。式中,Y为综合评分,Y1为各样品检测所得游离蒽醌含量,Y2为各样品检测所得多糖含量,Y3为各样品检测所得二苯乙烯苷含量,Y(nmax)为检测所得相应成分含量的最大值;综合评分越高表示主要药效成分(游离蒽醌、总多糖)含量越高、毒性成分(二苯乙烯苷)含量越低[8]。采用Design-Expert 7.0.1.0软件进行3因素5水平试验设计(α=1.732),因素与水平见表4,试验方案与结果见表5。
2.5.2 模型拟合 根据表5结果,以综合评分(Y)为因变量,采用Design-Expert 7.0.1.0软件进行多元非线性回归拟合,得二次多项式方程为Y=21.68+3.26A+2.95B+3.50C-1.80AB+2.53AC-1.56BC+2.75A2+2.00B2+0.77C2。该模型的拟合决定系数(R2)为0.811 6,模型的P<0.05,说明模型具有显著性;失拟项P>0.05,说明模型拟合良好。对响应值作用显著性顺序依次为C>A>B;交互项 AB、AC、BC及二次项 B2、C2的影响不显著(P>0.05),二次项A2影响显著(P<0.05),提示该模型中各因素对综合评分的影响不是简单的线性关系。方差分析结果见表6。
2.5.3 响应面分析 采用Design-Expert 7.0.1.0.软件绘制因变量随自变量变化的响应面图,详见图4。由图4可知,随着蒸制时间、烘制时间的延长,综合评分呈现出先降低后升高的趋势;随着烘制温度的升高,综合评分逐渐升高,且3个因素间交互作用不显著。
2.5.4 最优炮制工艺的确定 采用Design-Expert 7.0.1.0.软件求解二次多项式方程,得到最佳理论炮制工艺为蒸制时间4.58 h、烘制时间8.85 h、烘制温度65.77 ℃,炮制9次,理论预测综合评分为36.90分。为了满足实际生产需求,得最优炮制工艺为蒸制时间4.5 h、烘制时间9 h、烘制温度66 ℃,炮制9次。
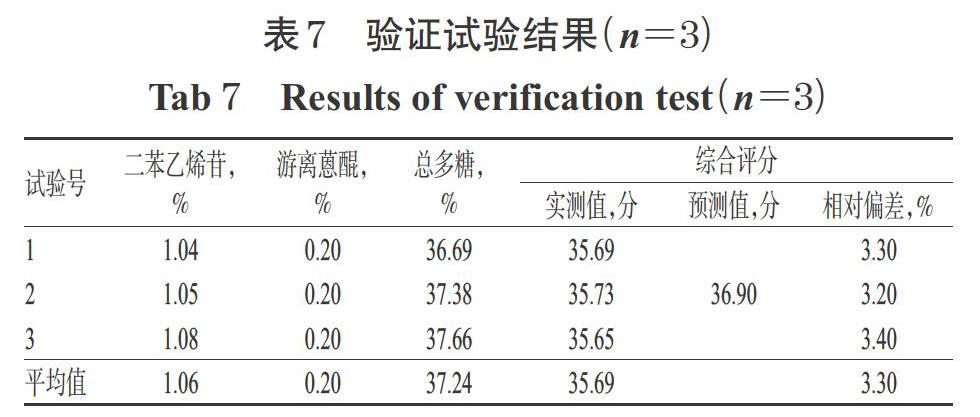
2.5.5 最优工艺验证 取何首乌药材10 kg按“2.5.4”项下最优炮制工艺制备何首乌九蒸九晒样品,平行操作3次;分别按“2.2”“2.3”“2.4”项下方法检测二苯乙烯苷、大黄素、大黄素甲醚、总多糖的含量,再按“2.5.1”项下方法计算综合评分,结果见表7。由表7可见,3次验证试验的平均综合评分为35.69分,与预测值的相对误差为3.30%,提示优化所得何首乌九蒸九晒炮制工艺稳定、可行。
3 讨论
九蒸九晒是古代何首乌常用的炮制方法之一,首载于《本草图经》,曰“采时乘湿以布帛拭去土,后用苦竹刀切,米泔浸一宿,曝干,九蒸九曝,乃可服”[17],其“九蒸九曝”即九蒸九晒。古代九蒸九晒主要有两种,一种为蒸晒各9次,另一种为蒸晒多次[18]。经文献分析得知,古人炮制何首乌的蒸晒次数多为7~12次,以炮制9次居多[19],故本研究选择蒸晒9次。
本研究试验前期,二苯乙烯苷定量分析时对乙腈-水、乙腈-0.1%甲酸溶液及游離蒽醌定量分析时的甲醇-水、甲醇-0.1%磷酸水溶液不同流动相体系进行了比较。结果,当流动相为乙腈-水或甲醇-0.1%磷酸水溶液时,对应各组分峰型较好,且分离度达到所需要求,故选择甲醇-0.1%磷酸水溶液为流动相。
本研究采用星点设计对影响何首乌炮制前后成分含量变化的蒸制时间、烘制时间、烘制温度等3个因素进行考察,获得了最优理论炮制工艺;采用响应面法建立质控指标与关键工艺参数的数学模型,对最佳理论工艺的结果进行预测,结果显示预测值与实际值的偏差在5%以内,表明两者相关性良好。但是,模型所得理论最优工艺中的蒸制时间(4.85 h)、烘制时间(8.85 h)以及烘制温度(65.77 ℃)不适用于现代工业化生产,故最终确定最优炮制工艺为蒸制时间4.5 h、烘制时间9 h、烘制温度66 ℃,炮制9次。验证试验结果显示,二苯乙烯苷与游离蒽醌含量均符合药典要求[1],表明该工艺炮制所得何首乌饮片含量合格。后续,本课题组用此最优工艺投产3批(每批15 kg),测得二苯乙烯苷含量为1.04%~1.09%,游离蒽醌含量为0.19%~0.21%,总多糖含量为36.73%~37.89%,表明该炮制工艺稳定、可行。
有研究指出,何首乌中二苯乙烯苷与蒽醌类成分在抗衰老、保护神经、促进骨形成等方面具有显著疗效,但二苯乙烯苷则是何首乌致肝损伤发生的主要原因[20]。多糖类成分能调节免疫活性、提高机体免疫力[21],这与何首乌的补益功能相符。前期预试验发现,随着何首乌炮制时间的延长,二苯乙烯苷含量整体呈下降趋势,偶见含量上升,这可能与生何首乌中含有的反式二苯乙烯苷稳定性差、不耐热,在炮制过程中受热转化为顺式二苯乙烯苷并水解成相应苷元有关[22]。同时,本研究在试验过程中发现,游离蒽醌和总多糖含量均有所增加,其中游离蒽醌含量增加可能与结合蒽醌在高温蒸晒过程中分解为游离蒽醌有关[23],总多糖含量增加可能与炮制过程中黑豆汁所含糖分渗入有关[24]。二苯乙烯苷、游离蒽醌和总多糖的含量变化是否为何首乌九蒸九晒增效减毒的主要物质基础还有待后续研究进一步证实。
综上所述,所建含量测定方法操作简便、重复性好;优化所得炮制工艺预测性良好且稳定、可行。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:176-177.
[ 2 ] 王海珍,李秀惠. 33例何首乌及其相关制剂致药物性肝损伤临床分析[J].中西医结合肝病杂志,2018,28(1):25-27.
[ 3 ] 徐男,时海燕,李晓宇,等.何首乌制剂不良反应研究进展与成因分析[J].中国实验方剂学杂志,2017,23(4):208-213.
[ 4 ] 吴欣,郭杨志,杜霄壤,等. 75例中药诱导的肝损伤患者临床特征分析[J].实用肝脏病杂志,2019,22(5):668-671.
[ 5 ] 宋海波,杜晓曦,郭晓昕,等.基于中医药古籍的何首乌安全性及风险因素分析[J].中国中药杂志,2015,40(5):985-988.
[ 6 ] 刘梦娇,蒲俊安,戴冰,等.何首乌“九蒸九晒”炮制工艺优选及对L02肝细胞生长的影响[J].中国中医药信息杂志,2020,27(4):70-73.
[ 7 ] 周杨静,唐俊峰,高峰,等.基于“九蒸九晒”炮制法的何首乌主要化学成分含量变化及对大鼠肝脏的影响实验研究[J].中南药学,2020,18(4):543-548.
[ 8 ] 颜世伦.制何首乌的化学成分研究[D].天津:天津大学,2014.
[ 9 ] 何钢,颜军,郭晓强,等.生何首乌多糖的单糖组成及清除羟自由基的活性测定[J].西北师范大学学报(自然科学版),2013,49(4):70-75.
[10] 郑英,李玮,赵贵,等.基于过程控制的何首乌产地加工与炮制一体化方法分析[J].中国实验方剂学杂志,2018,24(15):29-35.
[11] 田源红,张丽艳,杨玉琴,等.综合评分法优化何首乌产地加工工艺[J].时珍国医国药,2007,18(11):2668-2669.
[12] 曹凤媚,李越,许蕊蕊,等.星点设计-效应面优化法优选酒制丹参的炮制工艺[J].中医药导报,2019,25(16):55-60.
[13] 邓仙梅,黄斯敏,陈玉玲,等.星点设计-响应面法优选高良姜的砂烫炮制工艺[J].中国药房,2019,30(7):931- 936.
[14] 崔永霞,李会,吴明侠,等.星点设计-效应面法优化金银花炭炮制工艺[J].中国医院药学杂志,2018,38(18):1931-1935.
[15] 刘艳杰,项荣武.星点设计效应面法在药学试验设计中的应用[J].中国现代应用药学,2007,24(6):455-457.
[16] 吴伟,崔光华.星点设计-效应面优化法及其在药学中的应用[J].国外医学:药学分册,2000,27(5):292-298.
[17] 苏颂.本草图经[M].合肥:安徽科学技术出版社,1994:314-315.
[18] 鱼光强.何首乌炮制历史沿革[J].北方药学,2014(3):63-64.
[19] 严淑婷,樊浩,李若岚,等.中药“九蒸九晒”的历史沿革及现代研究[J].中国药师,2020,23(1):136-141.
[20] 王丽.何首乌炮制后化学成分及药理作用分析[J].中国现代药物应用,2020,14(6):229-231.
[21] 王娅,闫丽娜,孙甜甜,等.何首乌多糖的结构表征及其免疫调节活性研究[J].中草药,2019,50(10):2290-2295.
[22] 郭志烨,韩丽,杨明,等.制何首乌中二苯乙烯苷对光和热的不稳定性[J].中成药,2014,36(11):2280-2285.
[23] 刘振丽.何首乌炮制后化学成分的变化及中药中的Maillard反应[D]. 北京:中国中医科学院,2009.
[24] 李旻,吴彬,黄丽凤.何首乌与制何首乌中多糖及水溶性总糖的含量测定[J].四川中医,2010,28(10):52-54.
(收稿日期:2020-07-20 修回日期:2020-10-19)
(编辑:陈 宏)

