河南省首次发现梨孢镰刀菌引起的小麦赤霉病
徐飞 王俊美 杨共强


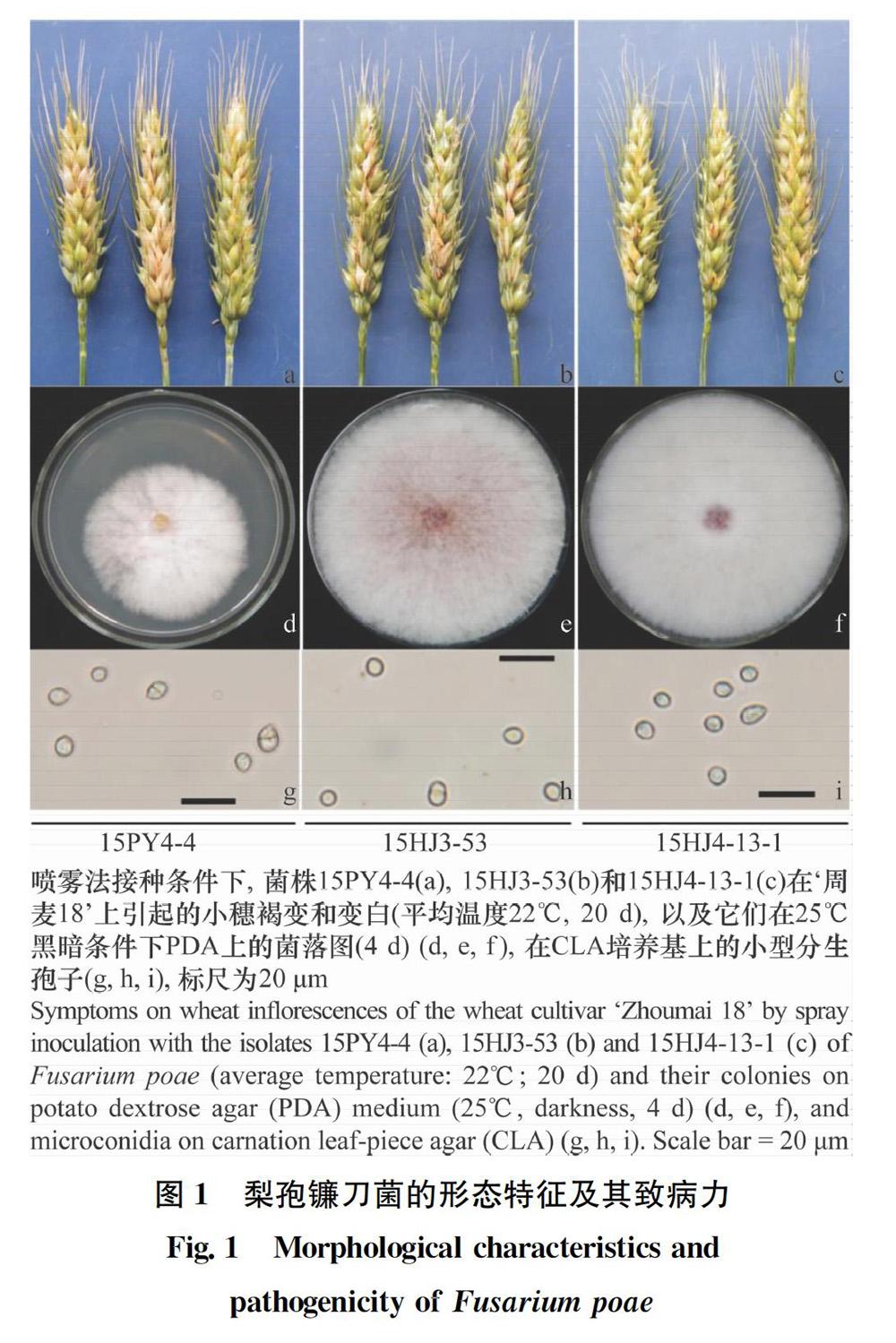
摘要 2015年从河南省田间小麦赤霉病病穗上分离得到一种生长速度较慢的镰刀菌,通过形态学和分子鉴定明确其分类地位,通过田间单小花滴注法和喷雾法接种测定其致病力,并通过高效液相色谱串联质谱分析对麦穗中的毒素种类进行测定,明确其产毒特征。结果表明:分离得到的8个菌株均为梨孢镰刀菌,在马铃薯葡萄糖琼脂(PDA)培养基上为白色菌落,菌落底部产生少量红色色素,平均生长速度为13.3 mm/d;小型分生孢子为椭球形葡萄状,平均大小为7.1 μm×5.8 μm,未见大型分生孢子和厚垣孢子;致病力弱,且不侵染穗轴,单小花滴注法接种条件下平均病级为0.1,喷雾法接种条件下平均病小穗率为6.5%;供试的8个镰刀菌菌株均不产生T-2和HT-2毒素,均产生雪腐镰刀菌烯醇(NIV)毒素,NIV毒素含量水平为371.74~5 282.80 μg/kg,其中3个菌株产生少量脱氧雪腐镰刀菌烯醇(DON)毒素(86.13~227.22 μg/kg)。
关键词 小麦; 小麦赤霉病; 梨孢镰刀菌; 雪腐镰刀菌烯醇
中图分类号: S 435.121.45
文献标识码: A
DOI: 10.16688/j.zwbh.2019483
Abstract In 2015, eight slow-growing Fusarium strains were isolated from the diseased wheat heads with Fusarium head blight in the field in Henan province. The species status was identified by morphological and molecular characters. The pathogenicity of these isolates was determined by the single-spikelet point inoculation and spray inoculation, and the toxin types of these isolates in wheat heads were determined by HPLC/electrospray ionization tandem mass spectrometry system. The results showed that all the eight isolates were Fusarium poae, with white colonies on PDA and a small amount of red pigments produced at the bottom of the colony. The average growth rate of these isolates was 13.3 mm/d. The average size of microconidia was 7.1 μm×5.8 μm, globose and napiform, without macroconidia and chlamydospores. The pathogenicity of these isolates was weak, and they did not infect the spike axis. The average disease level was 0.1 under the single-spikelet point inoculation. The average spikelet rate was 6.5% under the spray inoculation. These isolates did not produce T-2 and HT-2, but all of them produced nivalenol (NIV). The level of NIV was 371.74-5 282.80 μg/kg, and three isolates produced a small amount of deoxynivalenol (DON) (86.13-227.22 μg/kg).
Key words wheat; Fusarium head blight; Fusarium poae; nivalenol
由鐮刀菌引起的小麦赤霉病不仅能造成产量损失,而且病原菌产生毒素污染籽粒,造成人畜中毒[1]。禾谷镰刀菌复合群Fusarium graminearum species complex,黄色镰刀菌F.culmorum和燕麦镰刀菌F.avenaceum是分布广泛的主要致病种,而梨孢镰刀菌F.poae也是引起小麦赤霉病的重要病原之一[2]。梨孢镰刀菌不仅能产生B型非大环类单端孢霉烯族类毒素,包括雪腐镰刀菌烯醇(nivalenol,NIV)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3ADON)及15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyldeoxynivalenol,15ADON),还能产生A型非大环类单端孢霉烯族类毒素,包括T-2毒素和HT-2毒素[3]。由于梨孢镰刀菌产毒种类多,且在不同地域或气候条件下产生不同的毒素[3],而我国梨孢镰刀菌产毒情况未见报道,因此我国的梨孢镰刀菌的产毒情况仍需研究。
近年来,梨孢镰刀菌在阿根廷、加拿大、德国和意大利等国家的小麦上分离频率增加[4-5]。在我国仅湖北报道4个菌株为梨孢镰刀菌[6],之后未有报道。本研究旨在明确河南省梨孢镰刀菌的分布和产毒种类。
1 材料与方法
1.1 材料来源
供试镰刀菌的小麦病穗样本于2015年采集自河南省新乡市获嘉县(35°3′45″N, 113°37′51″E, 海拔82.8 m和35°3′44″N, 113°37′51″E, 海拔79.5 m)和濮阳市濮阳县(35°32′3″N, 115°13′54″E, 海拔53.1 m)的小麦-水稻连作地块。
1.2 病原菌的分离纯化和形态学鉴定
将样品中发病的小穗剪下,剪掉麦芒,在超净工作台里分别在70%乙醇中处理10 s,3%NaClO中消毒1 min,然后用无菌水冲洗3次;用灭菌的滤纸片吸干水分并在工作台中吹干;最后将病组织置于含有抗生素的马铃薯葡萄糖琼脂培养基(PDA,150 μg/mL硫酸链霉素和 75 μg/mL氨苄青霉素钠盐)上,于25℃培养箱中黑暗条件下培养3~7 d,待病组织周围长出类似镰刀菌菌落后,挑取至新的PDA培养基上培养。每个发病的麦穗分离1个菌株。随后连续3次挑取边缘菌丝进行纯化获得纯化菌株。将分离得到8个菌株的菌丝块分别放入20%甘油-75℃冻存。
将收集来的康乃馨叶片制作康乃馨叶片培养基[7],制作方法为将叶片冲洗干净后,再用无菌水冲洗,剪成约10 mm×10 mm的小块,放入锡箔纸中包裹,在70℃条件下烘干3 h。在直径6 cm的培养皿中倒入灭菌的2%水琼脂培养基,凝固后用无菌的镊子将6块烘干的康乃馨叶片放在培养基上。将各纯化菌株挑取至康乃馨叶片培养基中间,在25℃条件下,12 h黑暗12 h光照条件下培养7~14 d。挑取叶片边缘的分生孢子进行显微观察,测量并记录其大小。每个菌株记录20个孢子并计算其平均值。比对镰刀菌鉴定手册中的孢子大小进行初步鉴定[7]。
1.3 分子鉴定
将各菌株用挑针转移到PDA培养基上,25℃培养7 d后,用无菌牙签挑取气生菌丝50~100 mg装在2 mL的离心管中。然后用液氮速冻,存放在-20℃的冰箱里待用。每个2 mL的离心管加入5颗直径2 mm的钢珠(提前加入试剂盒中提取液300 μL),使用德国莱驰球磨仪(MM400)30次/s振荡2 min,然后加入试剂盒中提取液200 μL,使用E.Z.N.A.TM HP Fungal DNA Kit (OMEGA, 货号:D3195)按提取步骤进行DNA提取。DNA提取后,置于1.5 mL的离心管中于-20℃保存备用。扩增8个菌株的EF-1α基因序列进行系统发育分析,确定其种类,PCR引物和程序参考ODonnell等[8]和Proctor等[9]。引物EF1 (5′-ATGGGTAAGGA(A/G)GACAAGAC-3′)和EF2 (5′-GGA(G/A)GTACCAGT(G/C)ATCATGTT-3′)用来扩增EF-1α基因部分序列,扩增产物送至生工生物工程(上海)股份有限公司测序。然后使用特异性引物Fp82F(5′-CAAGCAAACAGGCTCTTCACC-3′)和 Fp82R(5′-TGTTCCACCTCAGTGACAGGTT-3′)进行特异性检测,进一步明确其种类[10]。
1.4 致病力测定
将-75℃冻存的镰刀菌菌株在新鲜的PDA平板上活化,25℃黑暗条件下培养3 d,打取5块(5 mm)边缘菌丝块转接到装有羧甲基纤维素酯培养基(CMC)(carboxymethyl-cellulose 150 g/L, NH4NO3 1.0 g/L, KH2PO4 1.0 g/L, MgSO4·7H2O 0.5 g/L, 酵母提取物1.0 g/L)的小三角瓶(100 mL),25℃,150 r/min摇培3~7 d,待产生大量分生孢子后,分别将供试菌株的分生孢子悬浮液经擦镜纸过滤,用血球计数板对滤液中分生孢子进行计数,用无菌水调整浓度为1×107个/mL和1×106个/mL分别用于单小花滴注接种和喷雾接种。禾谷镰刀菌对照菌株15HJ1-12用相同的方法获得分生孢子,其单小花滴注接种的分生孢子浓度为5×105个/mL。
于小麦品种‘周麦18扬花初期(2016年5月3日),采用单小花滴注法和喷雾法两种方法分别接种。单小花滴注法采用剪刀剪去麦穗中部小穗的内外颖壳顶部少许,滴入镰刀菌分生孢子懸浮液20 μL,每个麦穗接种1个小穗,每个品种接种30穗,10穗为1个重复,分别套透明塑料袋保湿,并记录接种后的天气情况,2 d后去掉保湿袋,接种后第10 天分别记录每穗的病级,病级标准参照《小麦抗病虫性评价技术规范 第4部分:小麦抗赤霉病评价技术规范》(NY/T 1443.4-2007)[11]中单小花滴注法的严重度分级来进行调查记载,平均病级=调查穗总病级/总调查穗数;喷雾法接种采用镰刀菌分生孢子悬浮液喷雾,每平方米喷雾50 mL,每个品种接种30穗,10穗为1个重复,分别套透明塑料袋保湿,接种后第10天分别记录每穗的病小穗数和总小穗数,并计算病小穗率,接种后10 d的病小穗率=病小穗数/总小穗数×100%。小麦成熟后,将喷雾法接种的病穗分别装入网袋,晾干后4℃冰箱中保存,以进行后续的麦穗组织毒素种类和含量测定。
1.5 毒素种类测定
将收回的麦穗剪碎,然后使用德国莱驰粉碎仪(ZM200, 1.5 mm不锈钢环筛)进行粉碎,过20目筛装入不同的自封袋中备用。每个样品粉碎后,严格清理以避免相互污染。寄往江苏省农业科学院农产品质量安全与营养研究所通过高效液相色谱串联质谱分析进行产毒类型和产生量分析[12]。
2 结果与分析
2.1 病原菌形态学鉴定
在25℃黑暗条件下,8个菌株在PDA上菌落为白色,底部能产生少量红色色素,生长速度为12.0~14.3 mm/d(平均为13.3 mm/d);其小型分生孢子呈椭球形,葡萄状,多数无分隔,偶见1个分隔,大小为(6.3~7.9)μm×(5.4~6.2)μm(平均为7.1 μm×5.8 μm),未见大型分生孢子和厚垣孢子(图1,表1)。形态学鉴定结果与梨孢镰刀菌相符。
2.2 分子鉴定
通过EF-1α基因序列测定,整合后在GenBank上进行BLAST比对,结果表明:8个菌株的序列(登录号为:KX298968~KX298972, KX298974~KX298976)与DNA序列库中登录号为MG889924和KP639705的梨孢镰刀菌的EF-1α基因序列同源性为100%。通过特异性引物Fp82F/R扩增,电泳后均产生0.22 kb的条带,再次确认8个菌株为梨孢镰刀菌。
2.3 致病力測定和再分离结果
供试的8个镰刀菌菌株接种后保湿2 d的条件下,单小花滴注法接种10 d后,70%~90%的接种小穗不发病,10%~30%的接种小穗能够产生明显褐变,且不侵染至穗轴,8个镰刀菌菌株的平均病级为0.1~0.3(平均为0.1)。禾谷镰刀菌对照菌株15HJ1-12的平均病级为1.2。喷雾法接种10 d后,小穗能产生明显褐变,但不侵染穗轴,病小穗率为1.6%~15.8%(平均为6.5%)。将喷雾法接种后的发病小穗按照菌株分别取样,每个菌株3个小穗,进行组织分离,分离得到白色菌落菌株,并用装50 mL CMC进行摇培,得到椭圆形葡萄状小型分生孢子,因此确定为梨孢镰刀菌(图1,表1)。
2.4 毒素种类测定
供试的8个镰刀菌菌株均不产生T-2和HT-2毒素,均产生NIV毒素,NIV毒素含量水平为371.74~5 282.80 μg/kg。另外,8个菌株中,只有菌株15PY4-4产生ZEN毒素(20.12 μg/kg);4个菌株不产生DON、3ADON和15ADON毒素;3个菌株(15PY4-4、15HJ4-49和15HJ4-13-1)产生DON毒素(86.13~227.22 μg/kg),2个菌株(15HJ4-13-1和15PY4-4)产生3ADON毒素(58.64、159.23 μg/kg),3个菌株(15PY4-4、15HJ3-53和15HJ4-13-1)产生15ADON毒素(29.11~293.14 μg/kg)(表1)。
3 结论与讨论
河南省小麦赤霉病菌主要是禾谷镰刀菌和亚洲镰刀菌[13],而梨孢镰刀菌较少。单小花滴注接种条件下,梨孢镰刀菌(平均病级为0.1)致病力比禾谷镰刀菌(平均病级为1.2)弱,且不侵染穗轴。梨孢镰刀菌致病力极弱,可能是其没有在中国大面积发生的原因。但是Audenaert等[14]发现三唑类杀菌剂(戊唑醇、丙硫菌唑、氟环唑和叶菌唑)防治小麦赤霉病造成梨孢镰刀菌的比例上升。随着我国小麦赤霉病菌对多菌灵抗性的升高,戊唑醇已经成为防治小麦赤霉病的主要药剂,并且丙硫菌唑及其复配药剂已在中国登记并使用。因此监测梨孢镰刀菌在中国的流行对我国小麦赤霉病的防治具有重要意义。
河南省梨孢镰刀菌主要分布在新乡市获嘉县的红旗渠和濮阳市濮阳县的沿黄稻-麦连作田块中,可能原因是梨孢镰刀菌更喜欢湿润的环境[15]。河南省梨孢镰刀菌主要产生雪腐镰刀菌烯醇毒素,不产生T-2和HT-2毒素,与阿根廷菌株一样[5],而与挪威菌株产生HT-2毒素不一样[16]。本研究首次在河南省发现梨孢镰刀菌,其主要分布在沿黄稻麦连作区,致病力弱并主要产生雪腐镰刀菌烯醇毒素,为梨孢镰刀菌的监测流行提供有利信息。
参考文献
[1] BAI G, SHANER G. Scab of wheat: prospects for control [J]. Plant Disease, 1994, 78(8): 760-766.
[2] 陆维忠, 程顺和, 王裕中. 小麦赤霉病研究[M]. 北京: 科学出版社, 2001.
[3] STENGLEIN S A. Fusarium poae: a pathogen that needs more attention [J]. Journal of Plant Pathology, 2009, 91(1): 25-36.
[4] XU Xiangming, PARRY D, NICHOLSON P, et al. Predominance and association of pathogenic fungi causing Fusarium ear blight in wheat in four European countries [J]. European Journal of Plant Pathology, 2005, 112(2): 143-154.
[5] STENGLEIN S A, DINOLFO M I, BARROS G, et al. Fusarium poae pathogenicity and mycotoxin accumulation on selected wheat and barley genotypes at a single location in Argentina [J]. Plant Disease, 2014, 98(12): 1733-1738.
[6] ZHANG Jingbo, WANG Jianhua, GONG Andong, et al. Natural occurrence of Fusarium head blight, mycotoxins and mycotoxin-producing isolates of Fusarium in commercial fields of wheat in Hubei [J]. Plant Pathology, 2013, 62(1): 92-102.
[7] LESLIE J F, SUMMERELL B A. The Fusarium laboratory manual [M]. Oxford, UK: Blackwell Publishing, 2006.
[8] ODONNELL K, WARD T J, GEISER D M, et al. Genealogical concordance between the mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within the Fusarium graminearum clade [J]. Fungal Genetics and Biology, 2004, 41(6): 600-623.
[9] PROCTOR R H, MCCORMICK S P, ALEXANDER N J, et al. Evidence that a secondary metabolic biosynthetic gene cluster has grown by gene relocation during evolution of the filamentous fungus Fusarium [J]. Molecular Microbiology, 2009, 74(5): 1128-1142.
[10]PARRY D W, NICHOLSON P. Development of a PCR assay to detect Fusarium poae in wheat [J]. Plant Pathology, 1996, 45(2): 383-391.
[11]中华人民共和国农业部. 小麦抗病虫性评价技术规范—第4部分: 小麦抗赤霉病评价技术规范NY/T 1443.4-2007 [S]. 北京:中国标准出版社,2007:1-6.
[12]QIU Jianbo, SHI Jianrong. Genetic relationships, carbendazim sensitivity and mycotoxin production of the Fusarium graminearum populations from maize, wheat and rice in eastern China [J]. Toxins, 2014, 6(8): 2291-2309.
[13]徐飞, 杨共强, 王俊美, 等. 河南省小麦赤霉病菌种群组成及致病力分化 [J]. 植物病理学报, 2016, 46(3): 294-303.
[14]AUDENAERT K, LANDSCHOOT S, VANHEULE A, et al. Impact of fungicide timing on the composition of the Fusarium head blight disease complex and the presence of deoxynivalenol (DON) in wheat[M]∥NOORUDDIN T. Fungicides: Beneficial and harmful aspects. Rijeka, Croatia: InTech, 2011: 79-98.
[15]LACEY J, BATEMAN G L, MIROCHA C J. Effects of infection time and moisture on development of ear blight and deoxynivalenol production by Fusarium spp. in wheat [J]. Annals of Applied Biology, 1999, 134(3): 277-283.
[16]LANGSETH W, RUNDBERGET T. The occurrence of HT-2 toxin and others trichothecenes in Norwegian cereals [J]. Mycopathologia,1999, 147(3): 157-165.
(責任编辑:田 喆)

