‘红颜’草莓中果糖激酶基因FaFRK3 的克隆与表达分析
吕文远,张丽勍,高清华,段 可*
(1 上海海洋大学水产与生命学院,上海201306;2 上海市农业科学院林木果树研究所,上海201403)
草莓果实中的可溶性糖主要有3 种:蔗糖、葡萄糖、果糖,其中果糖甜度最高,‘红颜’草莓果实中果糖含量相对较高[1]。 植物光合作用主要产物是蔗糖,蔗糖和尿苷-5’-二磷酸二钠盐(UDP)在蔗糖合酶(Sucrose Synthase,SS,EC2.4.1.13)的作用下水解为果糖和尿苷二磷酸葡萄糖(UDPG),该过程是可逆的[2]。 果糖在果糖激酶(Fructokinase,FRK,EC2.7.1.4)的作用下进一步磷酸化生成6-磷酸果糖。 己糖激酶(Hexokinase,HK,EC 2.7.1.1)主要磷酸化葡萄糖,果糖激酶主要磷酸化果糖[3],FRK 在果糖代谢过程中具有十分重要的作用。 已知的FRKs 是碳水化合物嘌呤激酶家族的成员,被称为磷酸果糖激酶B(pfkB)家族[4],该家族与植物中的果糖代谢合成途径密切相关。 对FRK基因表达的研究有助于揭示植物中果糖的代谢与合成。
马铃薯[5]、鳄梨[6]、大麦[7]、豌豆[8-9]、水稻[10]和柑橘[11]等作物中的FRK基因均已被分离出来。 甘蔗中有7 个与果糖激酶相关的基因(ScFRK1—ScFRK7),其中ScFRK1 和ScFRK5 是主效基因,ScFRK1 基因表达量最高,ScFRK5 基因次之,ScFRK4 基因在赤霉素的胁迫下表达量明显上升[12]。 在拟南芥中,果糖激酶AtFEK1 和AtFRK2 基因对果糖具有较高特异性[13]。 在日本梨果实中,随着果糖含量的增加,果糖激酶的活性会持续下降[14]。 Qin 等[15]在枇杷中分离出果糖激酶EjFRK基因,通过动态监测EjFRK基因转录本和FRK 酶活性的变化,发现EjFRK基因在果实发育早期的表达水平较高,成熟期表达水平较低,与FRK 酶活性的变化趋势相似,而FRK 酶活性的变化与果实发育进程方向相反,高FRK 酶活性不利于枇杷果实果糖积累。 赵建华等[16]从‘宁杞1 号’枸杞果实中分离得到LbFRK7 基因,发现该基因在枸杞果实的发育过程中对果糖转化具有一定的作用,特别是在果实成熟过程中对果糖含量的升高具有重要作用。Yang 等[17]研究发现,苹果的茎尖和幼果中,MdFRK2 基因的表达非常高。 草莓果实糖分积累研究较多,但有关草莓果实甜度控制重要的果糖代谢和果糖激酶基因的研究尚未见报道。 本试验以‘红颜’草莓果实为材料,克隆和分离获得草莓果实中FaFRK3 基因的cDNA 全长序列,并对‘红颜’植株不同器官以及草莓果实发育各个时期的FaFRK3 基因的表达进行分析,以期为后续基因功能分析和果实甜度遗传控制奠定基础。
1 材料与方法
1.1 植物材料及试剂
选取2017 年10 月种植于上海市农业科学院庄行试验站塑料大棚中生长状况良好的草莓品种‘红颜’(Fragaria×ananassaDuchesne ‘Benihoppe’)为试验材料,分别选取绿果期(G,果实绿色,瘦果紧密聚合)、白果期(W,果实白色膨大,瘦果不再紧密聚合)、转色期(T,果实着色面积达25%—50%)、成熟期(R,果实完全着色成熟)4 个发育阶段的草莓果实,以及‘红颜’植株的根、短缩茎、叶、花、种子5 个器官。每个时期的果实设置3 次生物学重复,随机选取同一时期的10 个果实混为一组,共3 组进行液氮磨样,存放于-80 ℃冰箱中备用。
所用载体为入门载体pDONR221,大肠杆菌TOP10 和根癌农杆菌GV3101 购于上海唯地生物技术有限公司,质粒小抽试剂盒和DNA 纯化试剂盒购于天根生化科技有限公司,植物RNA 提取试剂盒为E.Z.N.A Plant RNA Kit(美国OMEGA 公司),SYBR GreenⅠ荧光染料购于上海生工生物工程股份有限公司,反转录试剂盒购于大连TaKaRa 公司,引物由上海生工生物工程股份有限公司合成。
1.2 试验方法
1.2.1FaFRK3 基因全长cDNA 的克隆
利用E.Z.N.A.Plant RNA 试剂盒从‘红颜’草莓果实中提取RNA,利用Oligo 软件进行FaFRK3 基因CDS 引物(FaFRK3-F 和FaFRK3-R)设计(表1),使用MLV 反转录酶、RNase Inhibitor 进行反转录,得到单链cDNA。 PCR 反应体系为:25 μL 2 ×Es Taq MasterMix(Dye),上下游引物各2 μL,1 μL cDNA,加水至50 μL 体系。 PCR 反应程序:98 ℃预变性5 min;98 ℃变性30 s,62 ℃退火30 s,72 ℃延伸2 min,共30个循环,72 ℃延伸5 min。 扩增后的PCR 产物使用胶回收试剂盒回收得到FaFRK3 基因的目的片段,连接到pDONR221 入门载体上[18],重组载体转入TOP10 大肠杆菌感受态细胞中,菌液检测呈阳性的单克隆送至上海生工生物工程股份有限公司进行测序。
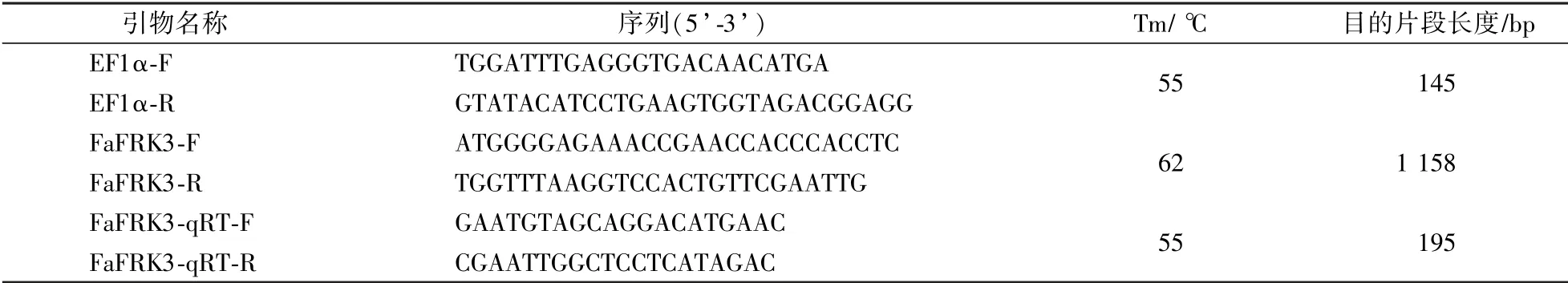
表1 试验所用引物Table 1 Primers used in the experiment
1.2.2 生物信息学分析
通过Pfam 分析得到果糖激酶保守结构域pfkB(PF00294.24)氨基酸序列,将该序列在GDR(https:∕∕www.rosaceae.org∕)中进行BLAST 分析,得到草莓中基因序列mrna07897.1-v1.0-hybrid。 BLAST 分析表明,该基因序列与FRK3 基因一致性最高,因此将其命名为FaFRK3。 使用MEGA5 构建Neighbor-Joining系统进化树,bootstrap 重复次数为1 000 次(图2)。 利用ProtParam(http:∕∕web.expaasy.org∕protparam∕)对FaFRK3 蛋白进行蛋白质性质分析,通过DNAMAN 进行序列相似性分析,利用HMMER(http:∕∕www.hmmer.org∕)对基因序列结构域和功能进行分析,利用ProtScale(http:∕∕web. expasy. org∕protscale∕)对FaFRK3 蛋白进行亲疏水性分析。
1.2.3 FaFRK3 基因表达分析
使用Oligo 软件进行实时荧光定量分析引物(FaFRK3-RT-F、FaFRK3-RT-R)设计(表1),内参引物为EF1α。 参照吕文远等[19]定量方法对FaFRK3 基因进行实时荧光定量分析,3 次生物学重复。 采用2-ΔΔCT方法进行数据处理。
2 结果与分析
2.1 ‘红颜’草莓FaFRK3 基因克隆分析
利用Oligo 软件设计的引物(FaFRK3-F∕R)进行PCR 扩增,获得目的基因(图1),FaFRK3 基因含有一个1 158 bp 的开放阅读框(ORF),编码有386 个氨基酸,其编码蛋白理论等电点和相对分子质量分别为5.04 和94 292.57 ku,FaFRK3 蛋白分子式为C3757H6241N1275O1611S270,脂肪酸系数为20.47,不稳定系数为39.46,是一个稳定的蛋白,属于pfkB 糖激酶家族。 通过DNAMAN 进行序列比对显示,其与FRK 蛋白氨基酸序列相似性较高,其中与月季的FRK 蛋白氨基酸序列相似性最高(图2)。
2.2 FaFRK3 蛋白结构分析
对测序所得基因序列结构域和功能进行分析,利用SignalP 工具进行信号肽预测显示,该基因含有一个信号肽,位置为1—27 碱基,分值为0.450(图3)。 利用ProtScale 进行亲疏水性分析表明,FaFRK3 蛋白大部分氨基酸属于疏水性氨基酸(图4),说明蛋白质结构稳定。
2.3 FaFRK3 基因定量表达分析
由定量分析结果可以看出,FaFRK3 基因在‘红颜’草莓茎中的相对表达量最低,在种子中的相对表达量最高(图5)。FaFRK3 基因在‘红颜’草莓果实绿果期表达量最高,随后逐渐降低,成熟期FaFRK3 基因表达量最低(图6)。
3 结论与讨论
植物中的FRK基因对植物的果糖积累具有明显的影响。 草莓果实中的FaFRK3 蛋白氨基酸序列与月季(Rosachinensis,XP_024157436.1)中的氨基酸序列相似率高达90.16%,与水蜜桃(Prunus persica,XP_007205340.1)、枣(Ziziphus jujuba,XP_015873836.1)、番木瓜(Carica papaya,XP_021909927.1)、克里曼丁橘(Citrus clementina,XP_006425063.1)等植物也高度同源。 氨基酸序列比对分析表明,FaFRK3 蛋白具有pfkB 糖激酶家族的明显特征,属于pfkB 糖激酶家族,提示FaFRK3 基因是‘红颜’草莓果实中果糖激酶蛋白的关键编码基因之一。 定量表达分析发现,FaFRK3 基因在‘红颜’草莓果实不同发育时期的表达量差别较大,并且在不同器官中相对表达量明显不同。 随着‘红颜’草莓果实的成熟,FaFRK3 基因的相对表达量明显减少,这与枸杞中的LbFRK7 基因[16]和杨梅中的MrFRK2 基因[20]表达趋势分析结果一致。

