核糖核酸-蛋白质复合物规模化富集与鉴定技术的研究进展
樊智雅, 秦伟捷
(军事科学院军事医学研究院生命组学研究所,北京蛋白质组研究中心,国家蛋白质科学中心(北京),蛋白质组学国家重点实验室,北京 102206)
核糖核酸(RNA)是细胞基因组转录的产物,根据结构和功能的不同可分为编码蛋白质的信使RNA(mRNA)和非编码RNA(ncRNA),RNA参与很多重要的生命活动,是细胞中必不可少的一类生物大分子。RNA在细胞中并非单独存在,从它们产生到被降解的过程中与大量蛋白质发生相互作用,在真核细胞中存在上千种RNA结合蛋白(RNA-binding proteins,RBPs)与RNAs结合形成种类纷繁复杂的RNA-蛋白复合物(RP复合物),并以这种复合物的形式发挥生理功能。以mRNAs为例,pre-mRNAs被转录合成后经过5′端加帽、剪接、多聚腺苷酸化到成熟,再经过出核、定位和翻译到最终被降解,mRNAs的整个生命周期都依赖着多种mRBPs与之结合才能发挥作用[1]。同时,非编码RNA也在RBPs的参与下介导组蛋白修饰和基因调控过程[2]。
这些功能实现的前提是RP复合物的正确组装,RNAs或RBPs任一组分的异常与缺失都会影响RNAs的正常功能,从而影响基因表达[3],RBPs还有可能通过干扰癌细胞能量代谢使癌症恶化[4]。这些都会导致生理过程紊乱和疾病的发生,包括代谢异常、肌肉萎缩症、神经系统疾病、自身免疫性疾病和癌症[5-7]。例如,RBP HuR(human antigen R)的过表达能在转录后水平调节信号通路,使癌细胞适应恶劣的肿瘤微环境,促进癌细胞增殖。在体外使用siHuR或小分子抑制剂选择性拮抗HuR或HuR-RNA相互作用能显著抑制肿瘤的生长。因此,定性定量分析RBPs的表达谱及其在正常细胞和癌细胞中与RNAs靶标之间的复杂相互作用网络有助于挖掘RP复合物在肿瘤发生发展中的作用,并为开发肿瘤生物标志物和治疗方式提供了新的思路。
目前研究者们已经不再满足于研究单个RP复合物的功能,在组学层面上研究和理解RNAs与RBPs的相互作用是必然趋势。生物质谱具有灵敏度高、动态范围宽、通量大的特点,是组学研究的必要分析手段。但由于RNAs与RBPs相互作用的动态性和网络复杂性,全面系统的阐述RP复合物的组成及动态变化并非易事。而作为系统性解析RP复合物组成、含量和功能的第一步,大规模富集RP复合物极具挑战性。为了解决这一难题,研究者们发展了各种富集鉴定策略,本文针对RP复合物富集策略的最新进展进行了综述,比较分析了它们的技术原理、优缺点及应用,并提出了需要解决的技术挑战,为富集策略的发展提供新的思路。
1 RP复合物富集策略
早期在富集RP复合物时通常利用RBPs与RNAs之间保持天然结合的特性在体外条件下实现富集,然而利用非内源性RNA和蛋白质,在非体内环境的结合会产生相当程度的假阳性结果,高洗涤强度也会导致RP复合物中结合力低的组分丢失。而体内条件下形成的RP复合物比通过体外方法获得的RP复合物更具有生物学相关性,能更真实地反映体内RNA-蛋白质相互作用的生理状态,近年最新发展的富集策略主要是在体内环境下实现RP复合物的富集。同样,为了克服因洗脱造成的部分RP复合物丢失的难题,需要增强核酸与蛋白质的相互作用。最简单有效的方法就是进行交联(cross-linking),主要分为化学交联和紫外光(UV)交联。化学交联通常采用甲醛试剂----一种双功能交联剂,可轻易渗透细胞并在0.2 nm以内的大分子之间形成可逆的共价键,因而会形成蛋白质-蛋白质复合物干扰RP复合物的鉴定。紫外光交联则是在RP复合物研究中应用更为广泛的“零距离”交联方式,UV可特异性地引发蛋白质与RNA之间形成不可逆的共价交联,从而排除在甲醛交联中不可避免的蛋白质-蛋白质交联,降低结果的假阳性。UV交联无疑成为体内研究RP复合物的基础,围绕UV交联诞生了许多经典的研究策略,下面将详细阐述。
1.1 UV交联和免疫沉淀及衍生技术
2003年Darnell等[8]提出了一种用于RP复合物富集的UV交联和免疫沉淀(crosslinking and immunoprecipitation,CLIP)策略,其目的是捕获并检测与特定蛋白质结合的RNA片段,他们使用CLIP策略联合Sanger测序鉴定到了340个与小鼠脑中剪接因子Nova1、Nova2相互作用的RNA序列。随后,Darnell团队又对细节进行了优化[9],CLIP的技术路线是:首先通过UV(254 nm)照射使RBP与RNA共价交联,然后使用RNA酶(RNase)温和酶切,与RBP结合的RNA会因RBP的保护而留下一定长度的片段,再将RNA片段的3′-磷酸基团进行去磷酸化,防止RNA片段的环化自连接,而RNA片段的5′末端将进行放射性同位素标记(32P标记),接着用修饰有目标蛋白质抗体的微球/磁珠将目标RBP蛋白及RNA片段富集下来,再使用蛋白酶K将蛋白质降解,得到的RNA片段将采用逆转录-聚合酶链式反应技术(reverse transcription-polymerase chain reaction,RT-PCR)扩增,最后进行测序分析就可以得到目标RBP结合RNA的种类以及结合的位点信息,具体流程如图1。
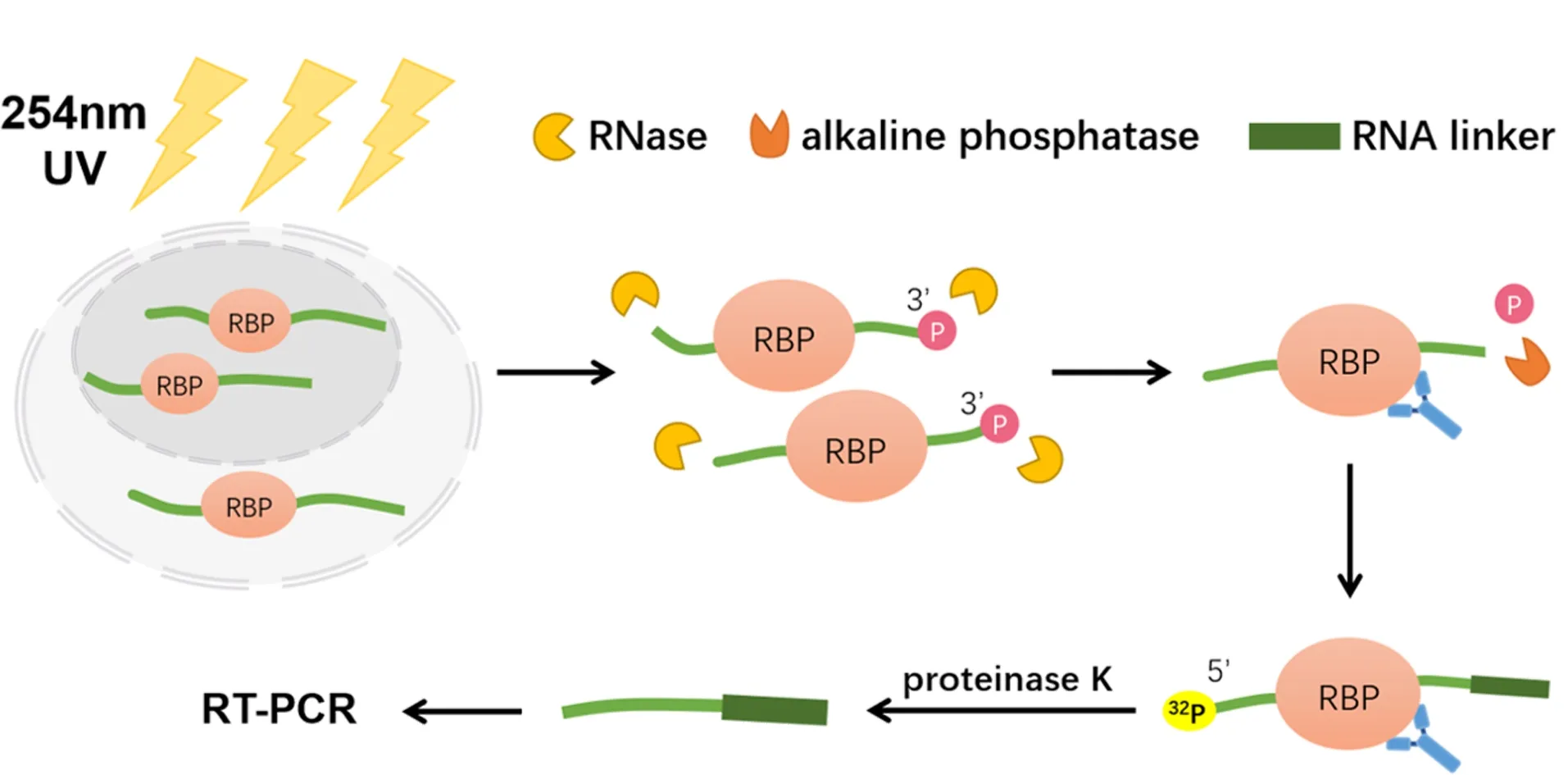
图 1 CLIP技术鉴定RNAs蛋白结合位点示意图Fig. 1 A schematic representation of CLIP for identification of protein binding sites on RNAs
CLIP技术一经提出就获得了高度关注,但是该方法也面临着通量低、UV存在偏好性、穿透力弱、交联效率低(大约仅为1%~5%)等问题。尽管可以通过对组织样品低温研磨和不断混合使UV更高效地穿透细胞促进样品的均匀交联,但高能量UV长时间照射可能会导致RNA的降解[10]。在此基础上,越来越多的研究者投入研究并不断改进,产生了许多各具特色的衍生CLIP技术。
为了提高交联效率,Hafner等[11]发展了一种光活化核苷增强的CLIP策略(photoactivatable-ribonucleoside-enhanced crosslinking and immunoprecipitation,PAR-CLIP)。他们将光活性更强的核苷代谢进入RNA,可以使RNA和蛋白质在更长波长的UV(如365 nm)照射下交联。具有代表性的核苷有4-硫代尿苷(4-thiouridine,4SU)和6-硫代鸟苷(6-thioguanosine,6SG),4SU比6SG的交联效率更高。与常规的254 nm UV交联相比,PAR-CLIP可将交联效率提高100到1 000倍。此外,PAR-CLIP的另一项优势是,4SU与蛋白质发生交联后,该位点在逆转录时受到非交联寡核糖核苷酸背景的影响,多达70%的RNA序列中的尿嘧啶(uracil,U)被识别为胞嘧啶(cytosine,C),于是会得到相对应的cDNA序列中的胸腺嘧啶(thymine,T)到C的突变,由此可推测该位点是RBP的结合位点。但是PAR-CLIP技术也有一定局限性:由于需要在细胞培养时将4SU或6SG代谢进入RNA,此方法仅限于细胞水平,不适用于组织样品;细胞倾向于不使用非天然核苷酸类似物,这限制了4SU或6SG代谢进入细胞的效率;长时间的摄入4SU或6SG可能会引起细胞毒性[12]。因此,仍然需要新的方法来提高交联效率并且实现对RP复合物的更深覆盖。
CLIP及其衍生技术被广泛应用于酵母、真菌、哺乳动物的RNA-蛋白质相互作用研究中。值得一提的是,Castello等[13,14]利用UV交联结合oligo(dT)富集与质谱鉴定poly(A) RBP,发展了RIC(RNA-interactome capture)策略,可以大规模富集RBP。结合生物质谱技术,该策略在人宫颈癌细胞HeLa中鉴定到860个高置信的RBPs,极大地补充了人们对RBPs的认知。然而,这种方法基于RNA的poly(A)尾巴(主要是mRNA),而mRNA仅占细胞中RNA总质量的3%~5%[3]。并且不是所有mRNA都带有poly(A)尾巴[15],poly(A)的长度也不尽相同[16],导致部分mRNA也很难被oligo(dT)捕获。因此,RIC策略遗漏了大量RP复合物,无法鉴定ncRNA-蛋白质复合物乃至全类型RNA-蛋白质复合物。

图 2 CARIC策略工作流程示意图[17]Fig. 2 Schematic of the workflow of click chemistry-assisted RNA-interactome capture (CARIC)[17]
1.2 基于“点击化学”的富集策略
鉴于RIC策略的局限性,最近一种基于代谢标记结合“点击化学”反应的RNA捕获策略能够不依赖RNA的poly(A)尾巴,更广泛的富集鉴定RP复合物。Huang等[17]开发的CARIC(click chemistry-assisted RNA-interactome capture)策略能富集全类型RP复合物,见图2。其主要思路是:首先将5-炔基尿苷(5-ethynyluridine,5-EU,简称EU)与4SU代谢进同一条RNA中,EU提供了进行点击化学反应的炔基,然后在UV 365 nm照射下使RNA与RBP交联,接着利用叠氮与炔基的生物正交“点击化学”反应在EU的位置上引入生物素基团,最后利用生物素与链霉亲和素之间的强相互作用实现细胞中所有RP复合物的富集与捕获,其中一部分使用蛋白酶K处理进行RNA-seq分析,另一部分使用RNase A处理进行蛋白质组学分析。与之类似的,Bao等[18]开发的RICK(RNA interactome using click chemistry)策略也利用代谢标记结合“点击化学”反应将生物素标记在RNA上用于富集鉴定,不同之处是他们只将EU代谢进RNA,在254 nm UV条件下交联。利用这种基于“点击化学”的方法可以鉴定到除mRNA之外的各种类型的ncRNA,包括长非编码RNA(long non-coding RNA,lncRNA)、微小RNA(microRNA,miRNA)和核小RNA(small nuclear,snRNA),是方法学上的重大突破。然而,由于需要将非天然核苷代谢进RNA,这种策略面临和PAR-CLIP类似的局限性,例如仅限于细胞水平研究和存在一定的细胞毒性,并且分析的灵敏性很大程度上取决于EU的代谢标记效率。
1.3 基于相分离的富集策略

图 3 基于相分离的RP复合物富集方法[20]Fig. 3 Phase separation-based approaches to enrich RP-complexes[20]
早期研究RNA提取时常采用基于酸性苯酚的相分离法[19]。首先破碎细胞,将核酸蛋白复合物中的蛋白质变性并释放出核酸,接着采用苯酚抽提,苯酚的诱导极化作用会使蛋白质内外翻转,疏水性侧链暴露在外部,极性残基翻转到内部,从而将水相中的蛋白质萃取出来。同时,由于DNA和RNA在特定pH值下的溶解度不同,低pH条件下(pH<5)的苯酚使RNA进入水相,而DNA维持不溶解的状态。最终在酸性苯酚萃取下RNA进入上层水相,而大多数DNA和蛋白质则保留在中间层或者下层有机相中。最近发展了一系列基于UV交联和相分离原理的富集策略,交联后的RP复合物会集中在水相与有机相之间的界面,再经过进一步纯化可以实现RP复合物的分离富集,见图3[20]。正交有机相分离(orthogonal organic phase separation,OOPS)策略[21]正是基于这种思路,使用酸性异硫氰酸胍-苯酚-氯仿(acidic guanidinium-thiocyanate-phenol-chloroform,AGPC)作为有机相,通过连续多次AGPC萃取后得到RP复合物,然后通过RNase消化RNAs获得分配到有机相的RBPs,最后通过质谱鉴定在HEK293、U2OS和MCF10A 3种人类细胞系中共鉴定到了1 838个RBPs,包括926个推定的RBPs,其中约80%的RBPs与先前报道的不依赖poly(A)的策略(CARIC和RICK)结果一致,这说明OOPS具有更全面的分离富集RP复合体的能力,此外OOPS还可以进行RNA-蛋白质相互作用的动态分析。另一种基于相分离的策略是苯酚-甲苯萃取(phenol-toluol extraction,PTex)策略[10],不同之处是有机相为pH 7.0的苯酚-甲苯(50∶50,v/v)混合溶液。在这种体系下,RNAs、蛋白质和RP复合物分配在上层水相中,DNA和脂质在中间层,回收水相后与酸性苯酚混合进行多次萃取得到RP复合物。通过这种分离策略从HEK293细胞中鉴定出共3 037个RBPs,回收率约为30%~50%。为了进一步提高RP复合物的富集选择性,一种新的策略XRNAX(protein-crosslinked RNA extraction)联合TRIzol(total RNA isolation)试剂相分离与二氧化硅实现RP复合物的富集[22]。TRIzol常用于总RNA分离纯化,能保持RNA的完整性,主要成分是苯酚。XRNAX的主要思路是:首先利用TRIzol将DNA、蛋白质和RP复合物分布在中间层,回收中间层后通过DNase消化DNA。由于硅胶柱在标准条件下可以保留RNA,但不保留与蛋白质交联的RNA,通过蛋白酶部分酶解得到RNA-肽段复合物使其可以保留在硅胶柱中,从而有效富集了RNA-肽段复合物。除去非交联的肽段后,对RBPs的富集选择性从69%增加到89%。结合在3种细胞系(MCF7、HeLa和HEK293)中的应用结果,共鉴定到1 753个RBPs,其中有858个RBPs是3种细胞系共有的。
相分离策略不依赖于RNA特定序列,完全根据RP复合物的理化性质实现分离富集,然而由于利用了UV交联,相分离策略也面临着UV偏好性、穿透力弱、交联效率低等问题,而且糖蛋白具有与RP复合物类似的理化性质,可能会污染富集产物。
2 总结与展望
RP复合物富集策略的不断创新使方法学取得了重大进步,从而大大提高了RBP在不同物种中的覆盖深度,为基因表达和转录后调控的研究提供了重要的参考依据。本文对不同方法的优缺点进行了比较和讨论,以方便研究者们选择合适的策略来解决感兴趣的生物学问题。由于当前的RP复合物富集方法仍然存在效率低和操作繁琐等问题,因此迫切需要高效、易于实施并适用于不同类型样品的新方法。目前亟待解决的问题包括:1)基于UV或甲醛的交联策略仍存在选择性和交联效率有限等局限,因此需要开发新的交联剂或交联策略。2)目前已经成功鉴定出数千个RBPs,而与RNAs的结合RBP位点鉴定数量却较少(仅报道了几百个)。因此,需要更为特异的RNA-蛋白质交联策略和高灵敏度质谱分析方法。3)目前用于验证新发现的RBPs的方法通量较低,难以满足大规模验证RNA-蛋白质相互作用的重大需求。

