硅对甘蔗黑穗病菌的体外抑菌效果研究
王文举 孙婷婷 岑光莉 娄文月 陈燕玲 阙友雄 尤垂淮 苏亚春

摘 要:由鞭黑粉菌(Sporisorium scitamineum)引起的黑穗病是甘蔗(Saccharum spp.)生產上最重要的真菌病害。硅是植物生长过程中的有益矿质元素,能够提高植物对生物和非生物胁迫的抗性。目前,关于外源硅对甘蔗黑穗病菌的体外抑菌作用尚未见报道。本研究以硅酸钠(sodium silicate, Na2SiO3)和硅酸钾(potassium silicate, K2SiO3)处理甘蔗黑穗病菌,观察黑穗病菌的孢子萌发、菌落直径和菌丝生长情况,评价不同硅剂和pH对甘蔗黑穗病菌的体外抑菌效果。结果显示,0.5~20.0 mmol/L Na2SiO3和K2SiO3均完全抑制甘蔗黑穗病菌的孢子萌发,但1.0 mmol/L Na2SiO3促进甘蔗黑穗病菌菌落和菌丝的生长,10.0、20.0 mmol/L Na2SiO3和K2SiO3则显著抑制菌落和菌丝的生长,表明Na2SiO3和K2SiO3均会影响甘蔗黑穗病菌的生长,高浓度Na2SiO3和K2SiO3的抑菌效果明显。在不同pH条件下,低pH(5.87~10.86)处理下的甘蔗黑穗病菌孢子有萌发,但其萌发率随着pH的增大逐渐降低,高pH(≥10.96)完全抑制孢子萌发,此外,pH为9.40和11.57对菌落直径的抑制效果明显。调整pH为6.0的低浓度Na2SiO3(0~5.0 mmol/L)和K2SiO3(0~3.5 mmol/L)对孢子萌发影响小,但pH为6.0的高浓度Na2SiO3(7.0~20.0 mmol/L)和K2SiO3(5.0~20.0 mmol/L)显著抑制孢子萌发,表明相同pH水平下的K2SiO3比Na2SiO3及其对应pH处理对甘蔗黑穗病菌孢子萌发的抑制作用更为明显。研究结果为外源硅在甘蔗抗黑穗病的药效试验和防治机理研究提供参考。
关键词:甘蔗黑穗病菌;硅;pH;抑菌作用
中图分类号:S435.661 文献标识码:A
Abstract: Smut caused by Sporisorium scitamineum is the most important fungal disease in Saccharum spp. production. Silicon is a beneficial mineral element in plant growth, which can improve plant resistance to biotic and abiotic stresses. At present, the antifungal effect of exogenous silicon on S. scitamineum in vitro has not been reported. In this study, the spore germination, colony diameter and mycelium growth of the S. scitamineum were observed using sodium silicate (Na2SiO3) and potassium silicate (K2SiO3) to evaluate the antifungal effects of different silicon agents and pH on S. scitamineum in vitro. The spore germination of S. scitamineum was completely inhibited by 0.5–20.0 mmol/L Na2SiO3 and K2SiO3. The colony and hyphal growth of S. scitamineum were promoted by 1.0 mmol/L Na2SiO3, but was significantly inhibited by 10.0 mmol/L and 20.0 mmol/L Na2SiO3 and K2SiO3. The results suggested that Na2SiO3 and K2SiO3 could affect the growth of S. scitamineum, and high concentrations exhibited obvious antifungal effects. The spores could germinate at low pH (5.87–10.86), but the germination rate gradually decreased with the increase of pH. High pH (≥10.96) completely inhibited the spore germination. In addition, pH 9.40 and pH 11.57 significantly inhibited the colony growth. After adjusting pH to 6.0, low concentrations of Na2SiO3 (0–5.0 mmol/L) and K2SiO3 (0–3.5 mmol/L) had little effects on the spore germination, but high concentrations of Na2SiO3 (7.0–20.0 mmol/L) and K2SiO3 (5.0–20.0 mmol/L) significantly inhibited the spore germination. The results indicated that at the same pH level, the inhibition effect of K2SiO3 on the spore germination of S. scitamineum was better than that of Na2SiO3 and the corresponding pH treatment. This study would provide references for further pesticide effect test and control mechanism research on the resistance of sugarcane to smut.
Keywords: Sporisorium scitamineum; silicon; pH; antifungal effect
DOI: 10.3969/j.issn.1000-2561.2021.12.028
甘蔗(Saccharum spp.)是重要的糖料作物。由鞭黑粉菌(Sporisorium scitamineum)引起的甘蔗黑穗病是甘蔗生产上最重要的真菌病害,严重威胁甘蔗的产量和品质[1-2]。通过分析甘蔗鞭黑粉菌的遗传多样性和群体遗传结构推测该病原菌起源于亚洲,后期可能通过感病甘蔗传播到非洲和美洲[3-4]。鞭黑粉菌侵染种蔗后,导致萌芽早、分蘖增多、茎细小,且大部分的分蘖会抽出黑鞭,造成无可用的原料蔗,此外,该病害还会随着宿根年限的延长而加重[5-8]。目前,生产上采用加强栽培管理、实行种苗脱毒处理和更换良种等措施来防治甘蔗黑穗病,其中,培育抗黑穗病甘蔗新品种或寻找新型高效环保的技术手段以控制甘蔗黑穗病具有重要意义[9]。
硅(silicon)是植物生长发育过程中的有益矿质元素,它主要通过改善植物形态结构和生理过程,增加营养元素的吸收,抑制重金属铜、锌和铅等有害元素的吸收,从而促进植物生长和发育,增强植物对逆境胁迫的响应[10-12]。此外,增加硅的施用会提高作物的产量和品质,且目前已知硅通过物理、生物化学和分子水平防御机制等作用于植物[13]。已有研究报道,硅剂如硅酸钠(sodium silicate, Na2SiO3)、硅酸钾(potassium silicate, K2SiO3)和硅酸钙(calcium silicate, CaSiO3)等可有效控制某些病原体及其相应疾病的发展,在植物抗病方面发挥重要作用[14-15]。Bi等[16]研究显示,Na2SiO3在体外可以显著抑制链格孢菌(Alternaria alternata)、半裸镰刀菌(Fusarium semitectum)和粉红单端孢(Trichothecium roseum)等单孢的生长。Mostowfizadeh-Ghalamfarsa等[17]发现Na2SiO3和K2SiO3可以抑制黃连疫霉菌(Phytophthora pis-taciae)的菌丝体生长、孢子囊产生以及囊肿萌发,但Na2SiO3处理比K2SiO3处理对开心果(Pistacia vera)疫霉病的防治更有利。郭玉蓉等[18]发现Na2SiO3和正硅酸乙酯(tetraethyl orthosilicate, TEOS)可以显著抑制粉红单端孢的活性,但纳米硅(nc-Si:H)则无影响。梁巧兰等[14]揭示低浓度(25 µg/mL)的K2SiO3、Na2SiO3和水杨酸(salicylicacid, SA)对豆链格孢菌(Alternaria azukiae)的抑制率低,最高不超过4.59%,但其诱导白三叶草(Trifolium repens)的抗叶斑病率分别高达53.73%、48.69%和53.18%。由此可见,硅对病原物的抑制作用具有广谱性,且不同硅剂的抑菌效果存在差异,其对植物病虫害的作用机理涉及诱导寄主的防卫反应或对病原物的直接抑制效用[19-20]。此外,由于硅溶液呈碱性,推测其抑菌机理还可能与pH相关[17, 21-22]。
目前,关于外源硅对甘蔗黑穗病菌的体外直接作用尚未见报道。因此,本研究离体测定10个不同浓度Na2SiO3和K2SiO3及其对应pH处理(即针对不同硅剂浓度的pH所设置的不含硅剂的相对应pH溶液)对甘蔗黑穗病菌的孢子萌发、菌落直径和菌丝生长的影响,评价不同硅剂和pH对甘蔗黑穗病菌的体外抑菌效果,为进一步研究甘蔗抗黑穗病药效试验及其机理提供科学依据。
1 材料与方法
1.1 材料
甘蔗黑穗病菌混合孢子采集于福建农林大学农业农村部福建甘蔗生物学与遗传育种重点实验室甘蔗基地,黑穗病鞭子置37 ℃烘干后分装于纸袋密封,4 ℃保存备用。
1.2 方法
1.2.1 试验处理 试验共设6个处理:(1)不同浓度Na2SiO3溶液处理;(2)不同浓度K2SiO3溶液处理;(3)不同浓度Na2SiO3溶液对应pH处理;(4)不同浓度K2SiO3溶液对应pH处理;(5)pH为6.0的不同浓度Na2SiO3溶液处理;(6)pH为6.0的不同浓度K2SiO3溶液处理。Na2SiO3和K2SiO3溶液的终浓度分别设置为0、0.5、1.0、1.7、2.0、3.5、5.0、7.0、10.0、20.0 mmol/L。试验用硅剂为购自西陇科学股份有限公司的Na2SiO3·9H2O粉末(分析纯)和K2SiO3晶体(分析纯)。
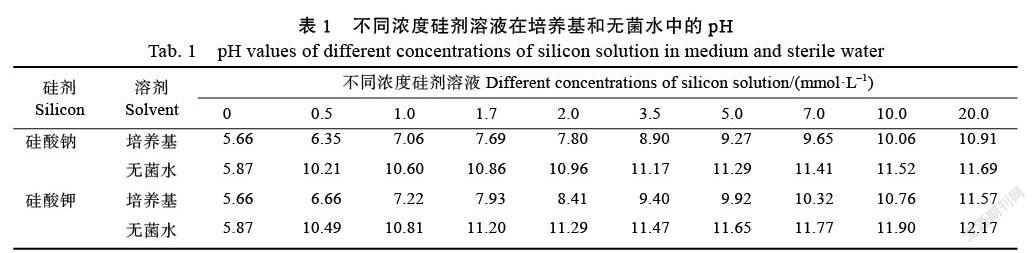
1.2.2 不同浓度Na2SiO3和K2SiO3溶液pH的测定 分别用高压的无菌蒸馏水和马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA)配置10个浓度分别为0、0.5、1.0、1.7、2.0、3.5、5.0、7.0、10.0、20.0 mmol/L的Na2SiO3和K2SiO3溶液,置于28 ℃恒温水浴锅中30 min,然后用pH计(亚速旺,中国上海)测定0~20 mmol/L Na2SiO3和K2SiO3溶液对应的pH(表1)。参照表1,以下试验中的PDA培养基或无菌蒸馏水中与10个不同浓度Na2SiO3和K2SiO3溶液对应的pH(5.66~ 10.91、5.87~11.69、5.66~11.57、5.87~12.17)采用经高压灭菌的1.0%氢氧化钠(sodium hydroxide, NaOH)、1.0%氢氧化钾(potassium hydroxide, KOH)和1.0%盐酸(hydrochloric acid, HCl)溶液进行调节。
1.2.3 不同浓度Na2SiO3和K2SiO3溶液及其对应pH处理对甘蔗黑穗病菌孢子萌发的影响 借助血球计数板,用无菌蒸馏水将甘蔗黑穗病菌孢子悬浮至5×106个/mL(含0.01%吐温–20作表面活性剂,V/V),取100 L孢子悬浮液与8 mL高压灭菌后的10个不同浓度的Na2SiO3和K2SiO3水溶液或其对应pH(5.87~11.69和5.87~12.17)的无菌水溶液或pH为6.0的不同浓度Na2SiO3和K2SiO3水溶液于15 mL试管中混合均匀。置于28 ℃下,100 r/min震荡培养,6 h和12 h分别取80 μL培养液于单凹玻片上,使用光学显微镜(20×倍镜,Leica,徕卡仪器有限公司)观察计算孢子萌发率,每个处理随机观察5个视野且孢子总数不少于300个,每个处理重复3次。计数时,当芽管长度超过甘蔗黑穗病菌冬孢子直径的一半时,则认为该孢子已萌发。
1.2.4 不同浓度Na2SiO3和K2SiO3溶液及其对应pH处理对甘蔗黑穗病菌菌落直径的影响 将100 μL甘蔗黑穗病菌孢子悬浮液涂布于PDA培养基(含75 μg/mL链霉素),置于28 ℃培养3~5 d。挑选甘蔗黑穗病菌单孢,分别接种于含10个不同浓度的Na2SiO3和K2SiO3溶液或其对应pH(5.66~10.91和5.66~11.57)或pH为6.0的含不同浓度Na2SiO3和K2SiO3溶液的PDA培养基上,置于28 ℃培养。利用十字交叉法分别测定接种后0、1、2、3、5、7、10、15、20 d的菌落直径,记录数值,并拍照,每个处理重复5次。计算抑制率,抑制率=[1-(处理组菌落直径-初始菌落直径)/(对照组菌落直径-初始菌落直径)]×100%,结果以平均值±标准误表示。
1.2.5 不同浓度Na2SiO3和K2SiO3溶液及其对应pH处理对甘蔗黑穗病菌菌丝生长的影响 将稀释后的100 μL甘蔗黑穗病菌孢子悬浮液涂布于PDA培养基(含75 μg/mL链霉素),置于28 ℃培养3~5 d。挑选甘蔗黑穗病菌单孢,置于25 mL含75 μg/mL链霉素的马铃薯葡萄糖水(potato dextrose water, PDW),于28 ℃摇床震荡培养至菌液浓度达OD600=0.6。参考Kaiser等[22]的方法,取100 μL菌液涂布于含10个不同浓度的Na2SiO3和K2SiO3溶液或其对应pH(5.66~10.91和5.66~ 11.57)或pH为6.0的含不同浓度Na2SiO3和K2SiO3溶液的PDA培养基上,每个处理重复5次。置于28 ℃培养0、1、2、3、5、7、10、15、20 d,分别拍照记录菌丝生长情况。
1.3 数据处理
利用Image-Pro Plus 6.0、DPS 7.05和Excel 2016软件进行实验数据的统计处理,显著性分析采用Duncan’s新复极差法,借助Power point 2016和Origin 8.0软件作图。
2 结果与分析
2.1 不同硅剂和pH对甘蔗黑穗病菌孢子萌发的影响
表2和表3显示,低pH(5.87~10.86)溶液处理下的甘蔗黑穗病菌孢子有萌发,但其萌发率随着pH的增大逐渐降低,而0.5~20.0 mmol/L Na2SiO3(10.21≤pH≤11.69)和K2SiO3(10.49≤pH≤12.17)以及高pH(≥10.96)处理均能抑制孢子萌发。经pH为6.0的10个不同浓度Na2SiO3和K2SiO3处理后,甘蔗黑穗病菌孢子萌发率均大于76.19%,其中,pH为6.0的低浓度
Na2SiO3溶液(0~5.0 mmol/L)和K2SiO3溶液(0~ 3.5 mmol/L)對黑穗病菌孢子萌发影响不大,但pH为6.0的高浓度Na2SiO3溶液(7.0~20.0 mmol/L)和K2SiO3溶液(5.0~20.0 mmol/L)显著降低黑穗病菌孢子的萌发。由此可见,Na2SiO3、K2SiO3和pH均会影响甘蔗黑穗病菌孢子的萌发,但pH处理液对孢子萌发的抑制效果不及同一pH水平下添加Na2SiO3和K2SiO3处理液的抑制效果,且同一pH水平下添加K2SiO3处理液对孢子萌发的抑制效果优于添加相同浓度的Na2SiO3和对应pH处理的抑制效果。
2.2 不同硅剂和pH对甘蔗黑穗病菌菌落直径的影响
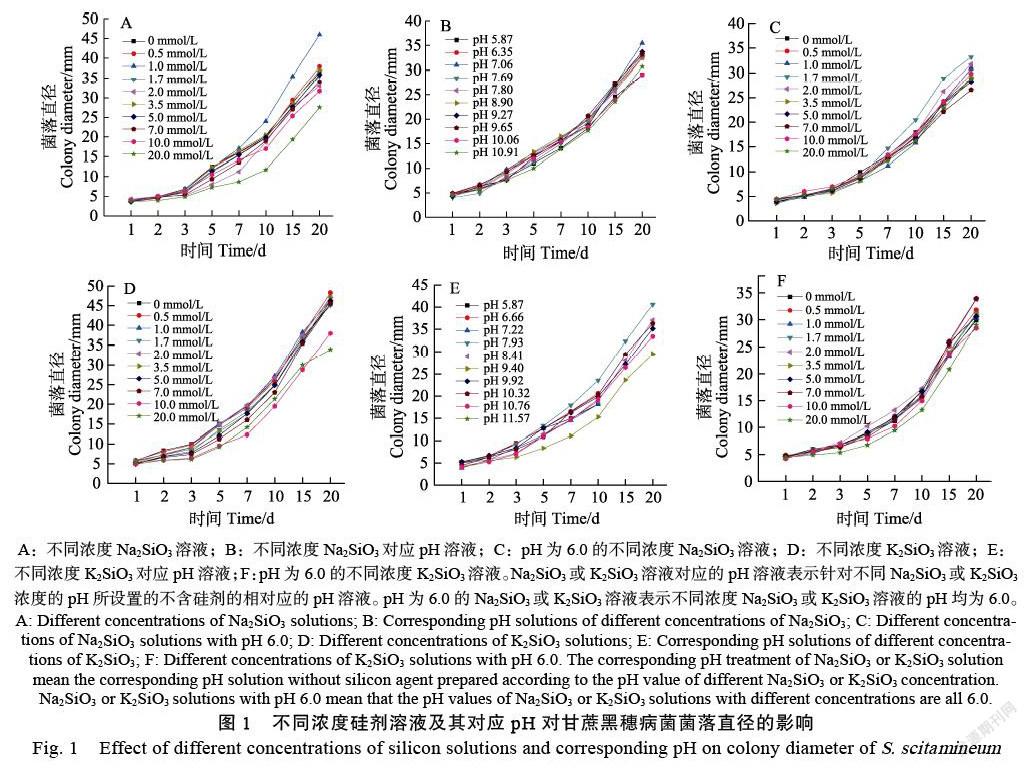
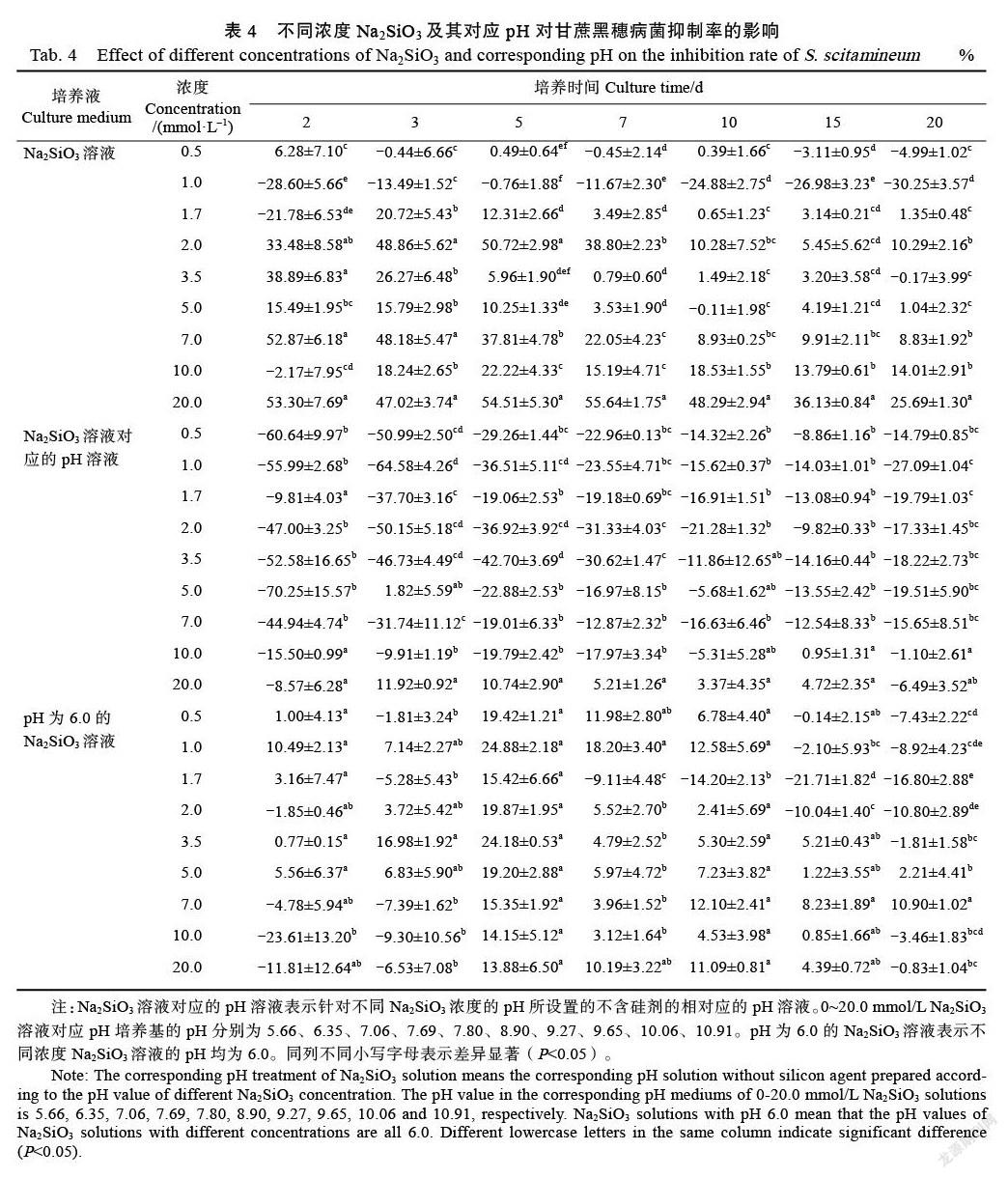
甘蔗黑穗病菌单孢在不同浓度Na2SiO3及其对应pH处理和pH为6.0的不同浓度Na2SiO3处理下的菌落长势存在差异(图1A~图1C)。用1.0 mmol/L Na2SiO3培养的菌落长势相对较好,其菌落直径整体较大,且在培养10~20 d时显著大于对照,而该培养时间段的0.5、1.7~5.0 mmol/L Na2SiO3处理组之间对单孢生长的抑制率整体差异不显著。用10.0、20.0 mmol/L Na2SiO3培养液处理的菌落直径普遍低于对照,抑制率介于(15.19±4.71)%~(55.64±1.75)%之间(表4)。不同浓度Na2SiO3溶液对应pH(5.66~10.91)处理对菌落生长影响较小。培养7 d后,pH为6.0的1.7 mmol/L Na2SiO3处理的菌落直径显著大于对照,抑制率均小于(–9.11±4.48)%(表4)。总的来说,不同浓度Na2SiO3溶液对应pH(5.66~10.91)处理对甘蔗黑穗病菌菌落生长影响较小,1.0 mmol/L Na2SiO3和pH为6.0的1.7 mmol/L Na2SiO3溶液促进甘蔗黑穗病菌菌落生长,而高浓度Na2SiO3(10.0~20.0 mmol/L)显著抑制菌落生长。
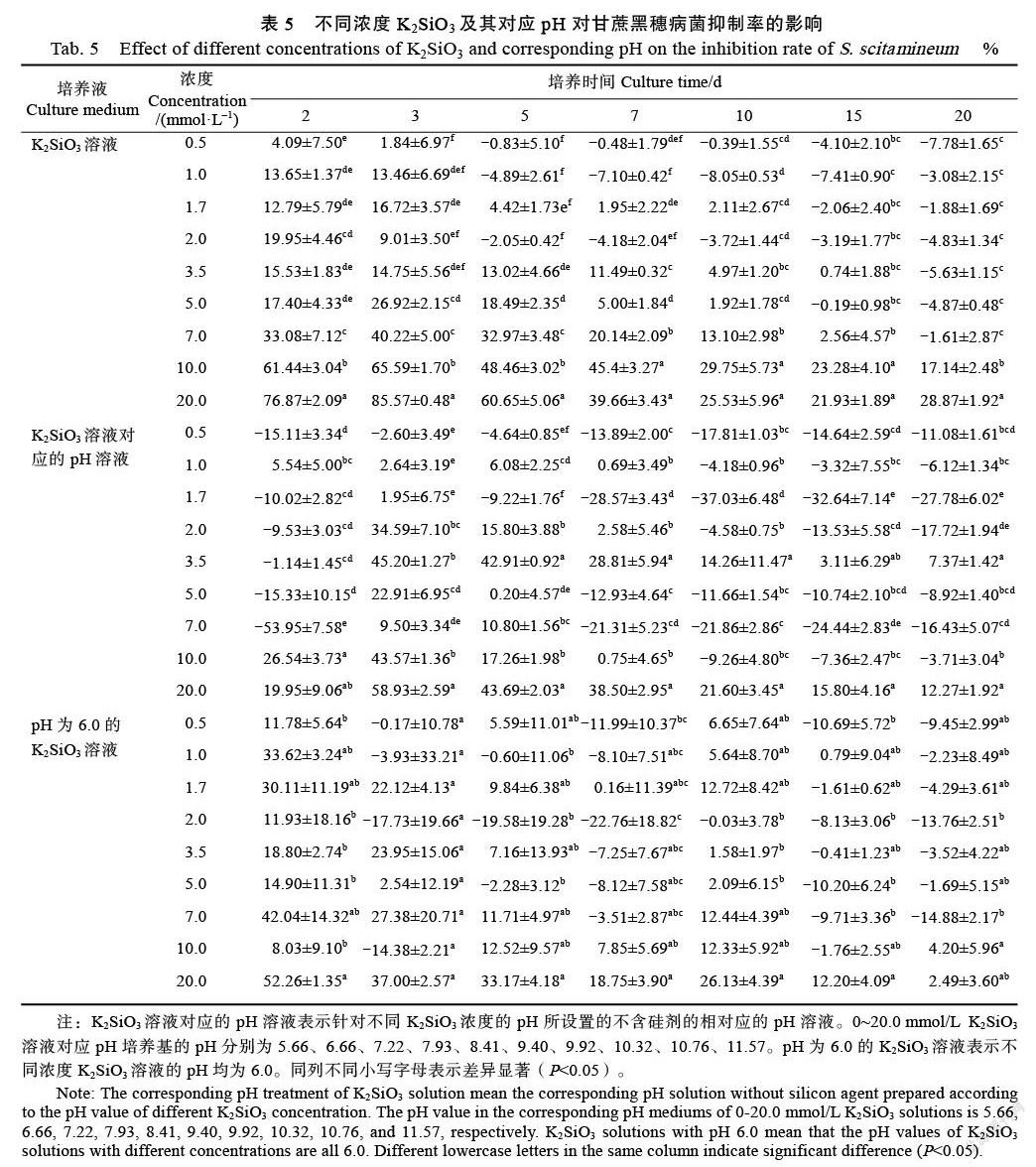
观察不同浓度K2SiO3溶液及其对应pH处理对甘蔗黑穗病菌菌落直径的影响(图1D~图1F,表5),结果显示,pH为6.0的不同浓度K2SiO3处理下的菌落直径之间的差异较小。在2~3 d时,除0.5 mmol/L K2SiO3培养的菌落直径与对照差异不显著外,其余K2SiO3浓度培养的菌落直径显著低于对照,随着培养时间的延长(5~20 d)和K2SiO3浓度的增加(0.5~7.0 mmol/L),菌落直径抑制率逐渐下降且处理间的差异趋于不显著,但高浓度K2SiO3(10.0、20.0 mmol/L)下的菌落生长抑制效果明显,其抑制率介于(17.14±2.48)%~ (85.57±0.48)%之间。在不同pH条件下,3.5、20.0 mmol/L K2SiO3对应pH处理,即pH为9.40和11.57培养基处理下的菌落直径显著小于对照。从整体上看,相较于对照,低浓度K2SiO3(<10.0 mmol/L)、pH为6.0的不同浓度K2SiO3和低pH对甘蔗黑穗病菌菌落生长的影响较小,而高浓度K2SiO3(10.0、20.0 mmol/L)和高pH(9.40、11.57)的抑菌效果明显。
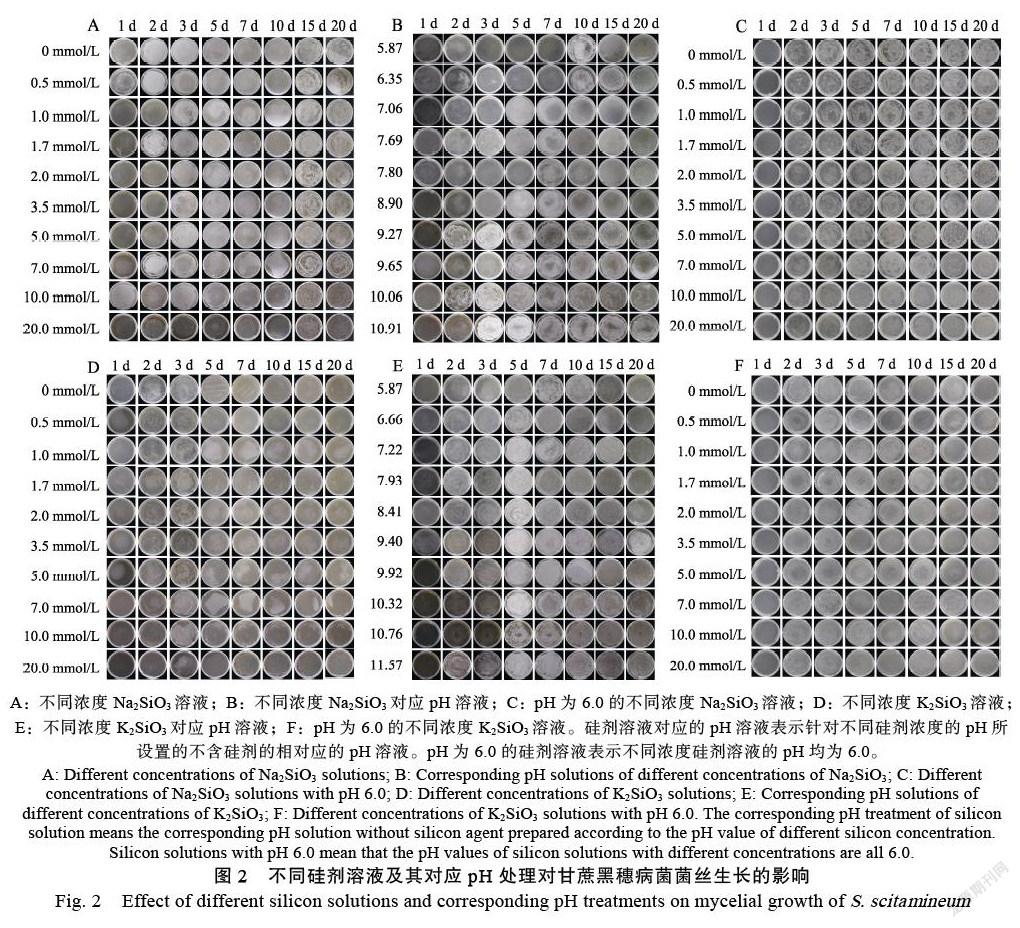
2.3 不同硅剂和pH对甘蔗黑穗病菌菌丝生长的影响
不同浓度Na2SiO3及其对应pH处理下的甘蔗黑穗病菌菌丝生长情况如图2A~图2C所示。相比对照组,0.5~1.0 mmol/L Na2SiO3处理的甘蔗黑穗病菌的菌丝浓密,长势较好,随着Na2SiO3浓度的增大和培养时间的延长,菌丝生长逐渐变慢,形态稀疏,长势减弱,当Na2SiO3浓度大于10.0 mmol/L时,菌丝生长明显被抑制(图2A)。不同浓度Na2SiO3对应pH处理(图2B)和pH为6.0的0~20.0 mmol/L Na2SiO3处理(图2C)的甘蔗黑穗病菌菌丝均能生长,且各处理之间的菌丝长势差别不明显。
图2D~图2F显示,0.5~1.7 mmol/L K2SiO3处理的甘蔗黑穗病菌的菌丝长势与对照组相比差异不明显,但当K2SiO3浓度在2.0~5.0 mmol/L时,菌丝生长随着K2SiO3浓度的增大逐渐减弱,K2SiO3浓度在7.0~20 mmol/L时对菌丝生长的抑制作用明显(图2D)。不同浓度K2SiO3对应pH处理(图2E)和pH为6.0的不同浓度K2SiO3处理(图2F)之间的甘蔗黑穗病菌菌丝长势差别不明显。
3 讨论
已有大量研究表明,外源硅对离体培养的病原菌的孢子萌发和菌丝生长具有抑制作用[16-17, 22],且硅可提高在生物和非生物胁迫下植物体内酶和激素含量以及抗性基因表达等,增强作物的产量和品质[17-23]。甘蔗黑穗病病原菌为黑粉菌,孢子大小5~6 μm,近圆形,棕色或黑色,单孢均有乳突[24],其菌丝呈黄、褐、白和黑色的有分隔的分枝。目前,甘蔗黑穗病已成为世界各植蔗区的流行病害,严重影响甘蔗产业的发展[25]。研究不同硅制剂对甘蔗黑穗病菌的体外抑菌效果,可为外源硅在甘蔗抗黑穗病中的应用奠定基础。
生产上人们施用硅肥来提高作物产量,改善土壤结构,增强植物抗病性,但关于硅酸盐对不同植物病原菌的抑制效果及处理浓度各不相同[26-27]。张志英等[28]研究表明,浓度为0.25、0.5、1.0、2.0 mmol/L Na2SiO3均会抑制番茄叶霉病菌丝的生长,且浓度越高,其抑制作用越强。Bi等[16]通过配置浓度为12.5、25、50、100、200 mmol/L Na2SiO3(27% SiO2)的PDA培养基处理链格孢菌、半裸镰刀菌和粉红单端孢,结果显示,100 mmol/L Na2SiO3能完全抑制3种病原菌的生长,在Na2SiO3浓度为12.550 mmol/L时处理5 d后也抑制3种病原菌的生长,而更高浓度的Na2SiO3(200 mmol/L)对植物具有毒性。徐红霞[29]研究发现,纳米硅、Na2SiO3和TEOS的硅源溶液对灰葡萄孢的孢子萌发率和菌落直径与对照相比差异不显著,且对灰葡萄孢生长还有促进作用。相类似,本研究发现0.5~20.0 mmol/L Na2SiO3和K2SiO3均完全抑制甘蔗黑穗病菌的孢子萌发(表2、表3),但1.0 mmol/L Na2SiO3促进甘蔗黑穗病菌菌落和菌丝的生长,而高浓度Na2SiO3和K2SiO3(10.0、20.0 mmol/L)则显著抑制菌落和菌丝的生长(图1、图2,表4、表5),表明Na2SiO3和K2SiO3会影响甘蔗黑穗病菌的生长,高浓度Na2SiO3和K2SiO3的抑菌效果明显。
关于硅酸盐对病原菌的抑制性已有大量报道,但是该抑制作用是由硅酸盐本身造成的还是解离时的pH造成的有待深入研究。王丽[30]研究表明,随着pH增加,灰霉菌(Botrytis cinerea)和黑腐菌(Xanthomonas campestris)的孢子萌發率降低、菌丝直径逐渐变小。Smilanick等[31]发现pH在4~7时对柑橘绿霉病菌(Penicillium digitatum)没有抑制作用,但高pH时抑制其萌发。采用20、40、60、80、100 mmol/L Na2SiO3及其对应pH处理均会抑制粉红单端孢的生长,但对应pH处理的抑制效果不如Na2SiO3[32]。本研究中,不同浓度Na2SiO3溶液对应低pH(5.87~10.86)处理下的甘蔗黑穗病菌孢子有萌发,但其萌发率随着pH的增大逐渐降低,高pH(≥10.96)完全抑制了孢子萌发,此外,pH为9.40、11.57对菌落生长的抑制效果明显。然而,甘蔗黑穗病菌孢子萌发率在浓度为0.5 mmol/L以上的Na2SiO3和K2SiO3溶液中均为0,调整pH为6.0后的低浓度Na2SiO3(0~5.0 mmol/L)和K2SiO3(0~3.5 mmol/L)对孢子萌发影响小,但pH为6.0的高浓度Na2SiO3(7.0~20.0 mmol/L)和K2SiO3(5.0~20.0 mmol/L)显著抑制孢子萌发(表2、表3),表明pH会影响甘蔗黑穗病菌的生长,但Na2SiO3和K2SiO3的抑菌作用比pH处理更为明显。Na2SiO3和K2SiO3均为强碱弱酸盐,Halasz等[33]研究发现,Na2SiO3中的钠离子和硅酸根离子会在溶液pH>11时解离,其中钠离子通过渗透作用所引起的对粉红单端孢的抑菌作用不大,反之,硅酸根离子起着主要作用。本研究显示,pH为6.0的不同浓度Na2SiO3和K2SiO3对甘蔗黑穗病菌的菌丝生长影响较小(图2C、图2F),空白PDA培养基pH为5.66,而含20 mmol/L Na2SiO3和10 mmol/L K2SiO3的PDA培养基pH(分别为10.91、10.76)接近11(表1),其对甘蔗黑穗病菌的菌丝和菌落生长具有明显抑制作用(图1、图2),推测此硅酸盐对甘蔗黑穗病菌的抑制效果除了与其对环境pH的改变有关外,更多涉及到硅酸根离子的影响,与前人研究结果[32]相符。
前人研究发现喷施300、400倍Na2SiO3稀释液对黄瓜白粉病的防治效果分别为89.3%和78.2%,喷施300、400倍K2SiO3稀释液对黄瓜白粉病的防治效果分别为87.3%和83.2%,而高浓度Na2SiO3和K2SiO3的200倍稀释液会对植株产生毒害作用[34]。吴寅等[35]研究显示,小麦生育后期喷施Na2SiO3和K2SiO3均能防治白粉病,其中K2SiO3防治效果较好。关于硅对病原菌直接产生毒害作用,还是硅通过物理防御机制、生物化学防御机制和分子水平防御机制作用于植物尚不明确[36-37]。在本研究中,同样发现K2SiO3的抑菌效果优于Na2SiO3,K2SiO3在更低浓度条件下即对甘蔗黑穗病菌的孢子萌发和菌丝生长表现出体外抑制作用(表2、表3,图2A、图2D)。Araujo等[38]发现与0 mmol/L K2SiO3及无接种稻瘟病菌(Magnaporthe oryzae)处理相比,2.0 mmol/L K2SiO3培养的水稻叶片接种稻瘟病菌后,叶片组织中的Si浓度、Si沉积量和酚类化合物的沉积量较高,此外,叶片表面的稻瘟病菌的真菌菌丝和附着胞结构较少。Rios等[39]研究表明,与对照组相比,经pH为5.6的2.0 mmol/L K2SiO3培养的水稻叶片接种稻瘟病菌后,水稻植株发病程度降低了67.66%,同时增加了净碳同化速率、气孔导度、蒸腾速率和色素浓度等气体交换参数。刘光玲等[40]研究表明,‘桂糖21号’(GT21)和‘ROC22’幼苗在pH为6.0的1/2 Hoagland营养液中的株高、叶绿素、可溶性蛋白和可溶性糖含量最高。因此,后续可采用pH为6.0的2.0 mmol/L K2SiO3喷施不同基因型甘蔗品种,对其抗黑穗病防治效果和作用机理进行综合评价分析,为采取经济、简便、生态安全的防控措施治理甘蔗黑穗病提供理论依据。
参考文献
[1] 陈如凯, 许莉萍, 林彦铨, 等. 现代甘蔗遗传育种[M]. 北京: 中国农业出版社, 2011: 85-160.
[2] Que Y X, Xu L P, Wu Q B, et al. Genome sequencing of Sporisorium scitamineum provides insights into the patho-genic mechanisms of sugarcane smut[J]. BMC Genomics, 2014, 15(1): 996.
[3] 沈万宽, 姜子德, 邓海华, 等. 甘蔗黑穗病及其病原菌研究進展[J]. 热带作物学报, 2013, 34(10): 2063-2068.
[4] Raboin L M, Selvi A, Oliveira K M, et al. Evidence for the dispersal of a unique lineage from Asia to America and Africa in the sugarcane fungal pathogen Ustilago scitaminea [J]. Fungal Genetics and Biology, 2007, 44(1): 64-76.
[5] Sundar A R, Barnabas E L, Malathi P, et al. A mini-review on smut disease of sugarcane caused by Sporisorium scita-mineum[M]. Botany, Croatia: InTech, 2012: 109-128.
[6] 许莉萍, 陈如凯. 甘蔗黑穗病及其抗病育种的现状与展望[J]. 福建农业学报, 2000, 15(2): 26-31.
[7] 苏亚春. 甘蔗应答黑穗病菌侵染的转录组与蛋白组研究及抗性相关基因挖掘[D]. 福州: 福建农林大学, 2014.
[8] 莫凤连. 甘蔗受黑穗病菌侵染后的形态结构及生理生化变化[D]. 南宁: 广西大学, 2012.
[9] 韦金菊, 宋修鹏, 魏春燕, 等. 甘蔗黑穗病及其防治研究进展[J]. 广东农业科学, 2019, 46(4): 81-88.
[10] Amin M, Ahmad R, Basra S, et al. Silicon induced im-provement in morpho-physiological traits of maize (Zea mays L.) under water deficit[J]. Pakistan Journal of Agricultural Sciences, 2014, 51(1): 187-196.
[11] 王 晨, 王海燕, 赵 琨, 等. 硅对镉、锌、铅复合污染土壤中黑麦草生理生化性质的影响[J]. 生态环境学报, 2008, 17(6): 2240-2245.
[12] Dorairaj D, Ismail M R, Sinniah U R, et al. Silicon mediated improvement in agronomic traits, physiological parameters and fiber content in Oryza sativa[J]. Acta Physiologiae Plantarum, 2020, 42(7): 371-375.
[13] Wang H, Li C, Liang Y. Agricultural utilization of silicon in China[M]. Studies in Plant Science, Elsevier, 2001: 343-358.
[14] 梁巧兰, 魏列新, 张 娜, 等. 三种化学物质诱导白三叶草叶斑病抗性的研究[J]. 草地学报, 2017, 25(3): 590-597.
[15] Paula T, Vieira R F, Teixeira H, et al. Calcium chloride and calcium silicate decrease white mold intensity on common beans[J]. Annual Report, 2009, 52: 90-91.
[16] Bi Y R, Tian S P, Guo Y R, et al. Sodium silicate reduces postharvest decay on Hami melons: induced resistance and fungistatic effects[J]. Plant Disease, 2006, 90(3): 279-283.
[17] Mostowfizadeh-Ghalamfarsa R, Hussaini K, Ghasemi-Fasaei R. Activity of two silicon salts in controlling the pistachio gummosis-inducing pathogen, Phytophthora pistaciae[J]. Australasian Plant Pathology, 2017, 46(4): 323-332.
[18] 郭玉蓉, 毕 阳, 曹孜义. 硅剂处理对‘玉金香’甜瓜红粉病的抑制[J]. 园艺学报, 2003, 30(5): 586-588.
[19] Rodrigues F A, Datnoff L E. Silicon and plant diseases[M]. Switzerland: Springer, 2015: 109-132.
[20] Johnson S N, Ryalls J M, Barton C V, et al. Climate warm-ing and plant biomechanical defences: Silicon addition con-tributes to herbivore suppression in a pasture grass[J]. Functional Ecology, 2019, 33(4): 587-596.
[21] Savant N K, Korndörfer G H, Datnoff L E, et al. Silicon nutrition and sugarcane production: a review[J]. Journal of Plant Nutrition, 1999, 22(12): 1853-1903.
[22] Kaiser C, Van Der Merwe R, Bekker T, et al. In-vitro inhi-bition of mycelial growth of several phytopathogenic fungi, including Phytophthora cinnamomi by soluble silicon [J]. South African Journal of Plant and Soil, 2005, 28(1): 70-74.
[23] Tripathi D K, Singh V P, Gangwar S, et al. Role of silicon in enrichment of plant nutrients and protection from biotic and abiotic stresses[M]. New York: Springer, 2014: 41-42.
[24] Albert H H. PCR amplification from a homolog of the bE mating-type gene as a sensitive assay for the presence of Ustilago scitaminea DNA[J]. Plant Disease, 1996, 80(10): 1189-1192.
[25] 雷敬超, 張保青, 高丽花, 等. 甘蔗常用亲本黑穗病抗性初步调查[J]. 中国糖料, 2018, 40(5): 30-33.
[26] Cai K Z, Gao D, Luo S M, et al. Physiological and cytologi-cal mechanisms of silicon-induced resistance in rice against blast disease[J]. Physiologia Plantarum, 2008, 134(2): 324- 333.
[27] 张亚建, 武阿锋, 刘存寿, 等. 不同硅肥处理对苹果树硅及其他中微量元素吸收的影响[J]. 西北农业学报, 2013, 22(10): 126-130.
[28] 张志英, 杜相革. 竹醋液复合硅对番茄叶霉病菌室内抑菌效果的研究[J]. 中国农学通报, 2012, 28(24): 231-235.
[29] 徐红霞. 不同硅源制剂对葡萄采后主要病害的作用效果及其机理的研究[D]. 兰州: 甘肃农业大学, 2004.
[30] 王 丽. 壳聚(寡)糖和硅酸钠的抑菌特性及抑菌机理的初步研究[D]. 青岛: 中国海洋大学, 2011.
[31] Smilanick J L, Mansour M F, Margosan D A, et al. Influence of pH and NaHCO3 on effectiveness of imazalil to inhibit germination of Penicillium digitatum and to control postha¬rvest green mold on citrus fruit[J]. Plant Disease, 2005, 89(6): 640-648.
[32] 牛黎莉, 毕 阳, 张盛贵, 等. 体内和体外条件下不同浓度硅酸钠和对应pH抑制粉红单端孢(Trichothecium roseum)效果比较[J]. 食品工业科技, 2015, 36(13): 157-161.
[33] Halasz I, Agarwal M, Li R, et al. What can vibrational spec-troscopy tell about the structure of dissolved sodium sili-cates?[J]. Microporous and Mesoporous Materials, 2010, 135(1-3): 74-81.
[34] 王军义, 王玉杰, 刘晨光, 等. 硅酸盐对黄瓜白粉病菌的毒力测定及田间药效[J]. 安徽农业科学, 2015, 43(25): 100-101, 105.
[35] 吴 寅, 周宏美, 贺德先, 等. 硅酸盐对小麦白粉病的防控效果及对子粒产量和品质的影响[J]. 华北农学报, 2012, 27(S1): 377-381.
[36] 宁东峰, 梁永超. 硅调节植物抗病性的机理: 进展与展望[J]. 植物营养与肥料学报, 2014, 20(5): 1280-1287.
[37] 高 丹, 陈基宁, 蔡昆争, 等. 硅在植物体内的分布和吸收及其在病害逆境胁迫中的抗性作用[J]. 生态学报, 2010, 30(10): 2745-2755.
[38] Araujo L, Paschoalino R S, Rodrigues F Á. Microscopic aspects of silicon-mediated rice resistance to leaf scald[J]. Phytopathology, 2015, 106(2): 132-141.
[39] Rios J A, Rodrigues F D Á, Debona D, et al. Photosynthetic gas exchange in leaves of wheat plants supplied with silicon and infected with Pyricularia oryzae[J]. Acta Physiologiae Plantarum, 2014, 36(2): 371-379.
[40] 刘光玲, 陈荣发, 田富桥, 等. 不同pH值对甘蔗幼苗生长和生理特性的影响[J]. 南方农业学报, 2011, 42(4): 380-383.
责任编辑:谢龙莲

