鼻咽癌组织中BMAL1和CerbB-2基因的表达及机制
王波涛,赵 琳,夏 翠,祝 康,高天喜,喻 超,孙 斌
(西安交通大学第二附属医院耳鼻喉科,陕西西安 710004)
鼻咽癌(nasopharyngeal carcinoma, NPC)起源于鼻咽的上皮,常见局部浸润和早期远处转移,其病因包括Epstein-Barr病毒(Epstein-Barr virus, EBV)感染、遗传易感性和环境因素[1]。由于NPC的位置较深且早期缺乏明显的临床症状,因此很难及早发现。同步化疗和放疗虽然是晚期鼻咽癌的标准治疗方法且存在有效性[2],但会在一些患者中发生持续性或复发性疾病形式的局部或区域性衰竭。因此,NPC患者迫切需要新的生物标志物和改善治疗结果的治疗策略。
BMAL1(brain and muscle arnt-like protein-1, BMAL1)和CLOCK(circadian locomotor output cycles kaput, CLOCK)是与Period(Per1和Per2)和Cryptochrome(Cry1和Cry2)基因启动子结合的两个主要元件[3]。BMAL1在维持生物体的正常生命活动中有重要作用[4]。除了控制生物节律的功能外,BMAL1还在衰老、心血管疾病、自身免疫性疾病和癌症中发挥重要作用[5]。BMAL1参与细胞周期和增殖的调节,其可能在肿瘤发生中起关键作用[6]。ELSHAZLEY等[7]发现,恶性胸膜间皮瘤中BMAL1表达增加,沉默BMAL1后细胞周期紊乱且细胞凋亡增加,表明BMAL1可能在癌症的调节中发挥作用。本研究通过探究NPC组织中BMAL1蛋白及CerB-2基因的表达,将为NPC的机制研究和分子诊断以及患者的预后和靶向治疗提供理论支持。
1 材料与方法
1.1 细胞株本研究中使用的细胞系为CNE1,即具有高分化的人NPC细胞,购于上海医学研究院。
1.2 细胞培养、分组和检测CNE1细胞在37 ℃、50 mL/L的CO2环境中培养,然后使用Lipofectamine 2000(Invitrogen,Auckland, New Zealand)通过对应的质粒转染细胞。本研究分为对照组(CK组)和BMAL1、CerB-2转染CNE1细胞系组(NPC组),每组实验均重复3~5次(符合统计检验标准)。兔抗BMAL1、抗CerB-2抗体购自Abcam(Abcam,Cambridge, MA, USA)。MTT用于测定评估细胞的增殖,用适当的质粒转染T47D或ZR-75-30细胞,转染24 h后,接种于96孔板中,每孔含1 000~2 000个细胞,用商业试剂盒(KeyGen)进行MTT测定,并在490 nm处读取样品的吸光值。
1.3 细胞总RNA提取和实时荧光定量PCR使用RNAiso Reagent(TaKaRa)从细胞中分离提取总RNA,用oligo(dT)引物和逆转录系统(TaKaRa)逆转录总RNA(3 μg)。使用特异性引物通过PCR扩增单链cDNA,具体序列如下。BMAL1:5′-CCACCGACTACCAGGAAAGT-3′(正向)和5′-CGCTAAAGTCACAGGGACCA-3′(反向);CerB-2:5′-TACTGTGCCTTTGAGTCCG-3′(正向)和5′-TTGTCGGCGATAAGGAAG-3′(反向);GAPDH:5′-GGGTTGAACCATGAGAAGT-3′(正向)和5′-GACTGTGGTCATGAGTCCT-3′(反向)。10 g/L琼脂糖凝胶电泳分析PCR产物。RT-PCR结果用ABI Prism 7500序列检测系统和SYBR Premix ExTaq(TaKaRa)测定相对mRNA水平,GAPDH作为内参基因,根据2-ΔΔCT方法测定靶基因的mRNA表达。
1.4 蛋白免疫印迹用环己酰亚胺(CHX,Biosharp, 10 μmol/L)、MG132(Sigma-Aldrich,10 μmol/L)和BafA1(Sigma-Aldrich, 10 μmol/L)预处理细胞,并采用RIPA裂解缓冲液裂解细胞。通过80 g/L或100 g/L SDS-PAGE分离细胞裂解物,转移至PVDF膜(Millipore),封闭,并在不同的一抗(包括特异性抗体)中孵育。将膜在辣根过氧化物酶(HRP)缀合的二抗(Santa Cruz Biotechnology)中孵育,使用ECL检测试剂盒(Perkin Elmer Life Science)将蛋白质条带可视化。
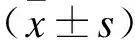
2 结 果
2.1 BMAL1和CerbB-2对鼻咽癌CEN1细胞增殖的影响在稳定转染BMAL1后(图1C),与未转染BMAL1的CNE1细胞系(图1A)相比,细胞增殖数目明显增加;稳定转染CerbB-2的细胞系(图1D)与未转染CerbB-2的CEN1细胞系(图1B)相比,细胞增殖数目有明显提高。提示BMAL1和CerbB-2可影响鼻咽癌细胞的增殖;BMAL1和CerbB-2可能通过调节某些癌细胞相关的信号通路以促进或抑制鼻咽癌细胞的增殖和迁移。

图1 BMAL1和CerbB-2对鼻咽癌CEN1细胞增殖的影响
2.2 BMAL1和CerbB-2基因在鼻咽癌细胞中的表达结果显示,BMAL1基因在NPC组中表达水平明显下调,而CerbB-2基因的表达水平明显上调(P<0.05),其中BMAL1基因的表达量在NPC组中比CK组下调了约71.88%(图2B),而CerbB-2在NPC组中的表达量相较CK组上调了约66.42%(图2C)。提示BMAL1基因和CerbB-2基因在CNE1细胞中共同调控鼻咽癌细胞的增殖(图2)。

图2 BMAL1和CerbB-2在鼻咽癌CEN1细胞中的表达
2.3 BMAL1和CerbB-2蛋白在鼻咽癌细胞中的表达为了验证BMAL1和CerbB-2基因表达的准确性,本研究检测了BMAL1和CerbB-2的蛋白表达情况。结果显示,BMAL1蛋白的表达在NPC中被明显抑制[CK(2.24±0.22),NPC(0.63±0.11),P<0.01],而CerbB-2蛋白的表达则被明显上调[CK(0.89±0.13),NPC(2.65±0.25),P<0.01,图3]。BMAL1和CerbB-2蛋白与基因表达趋势相同,提示BMAL1和CerbB-2可能参与鼻咽癌细胞的增殖调控作用。
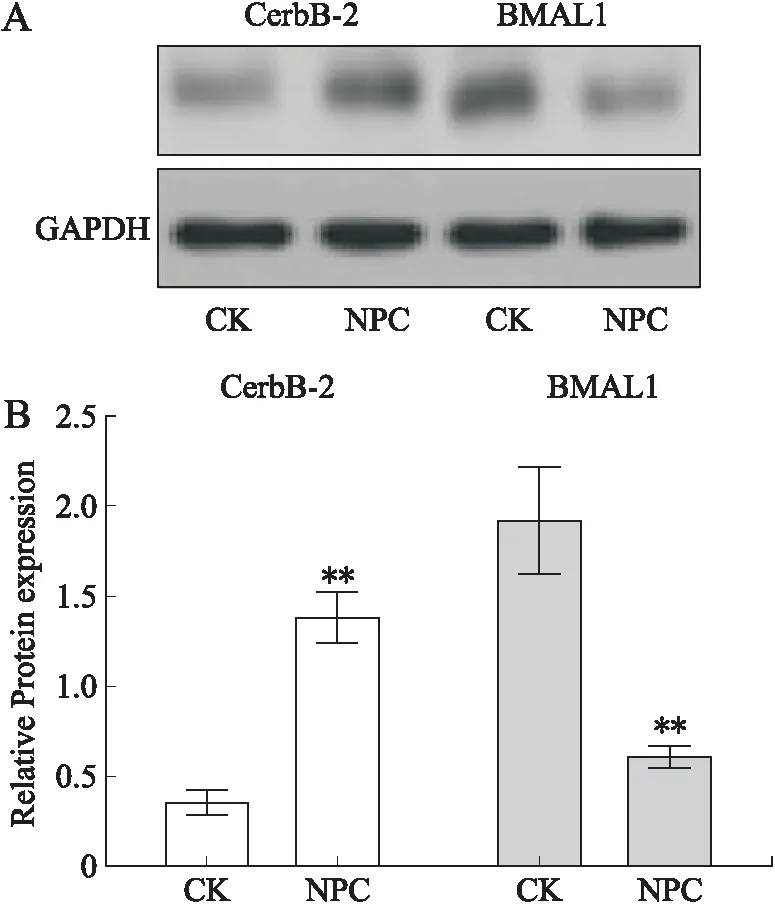
图3 BMAL1和CerbB-2蛋白在鼻咽癌CEN1细胞中的表达
2.4 p50和p65基因在鼻咽癌细胞中的表达与CK组相比,NPC组中p50和p65基因表达水平分别上调了66.90%和77.68%(P<0.01,图4)。提示NPC激活了NF-κB信号通路,使其产生一系列相关的反应。
2.5 p50和p65蛋白在鼻咽癌细胞中的表达本研究检验了p50和p65蛋白的表达情况。结果显示,与CK组比较,NPC组中p50和p65蛋白相对表达水平均明显上调(图5,P<0.01)。提示NF-κB信号通路参与鼻咽癌细胞的调控作用。
3 讨 论
NPC是中国华南地区以及东南亚常见的头颈癌[8-9]。随着放化疗的初步治疗,早期NPC的5年总生存期(overall survival, OS)大于90%[10]。然而,复发性或原发性转移性NPC仍然是肿瘤学研究中的重点和难点。尽管联合放疗/化疗对Ⅰ期和Ⅱ期NPC有疗效并能提高患者的生存率,但不幸的是,大多数NPC是由于非特异性表现症状(宫颈节育、头痛、鼻腔和听觉功能障碍)而被诊断为晚期,特别是治疗后症状的发作以及对鼻咽的彻底检查具有更大的难度[11-12]。因此,需要开发更精确的分子诊断和NPC的靶向治疗技术。为此,本研究探讨了NPC中可能的调控信号通路和基因表达情况,以期为其机制研究提供一定的理论支持。
人体在维持体内平衡和适应外部环境的过程中存在明显的昼夜节律变化[13]。昼夜节律紊乱可能会增加心血管疾病、免疫性疾病和癌症等疾病的风险[14]。昼夜节律蛋白BMAL1、CLOCK、PER1和PER2等的正反馈回路调节人体的各种生理过程,包括血压、激素分泌、睡眠和免疫活动[15]。研究表明,可能存在一个整合的信号网络调节昼夜节律变化,包括一般行为、激素合成、体温和新陈代谢[16-17]。本研究结果显示,BMAL1基因在NPC中被明显下调,而CerbB-2基因的表达则明显上调,说明BMAL1和CerbB-2可能参与鼻咽癌细胞的增殖调控作用。
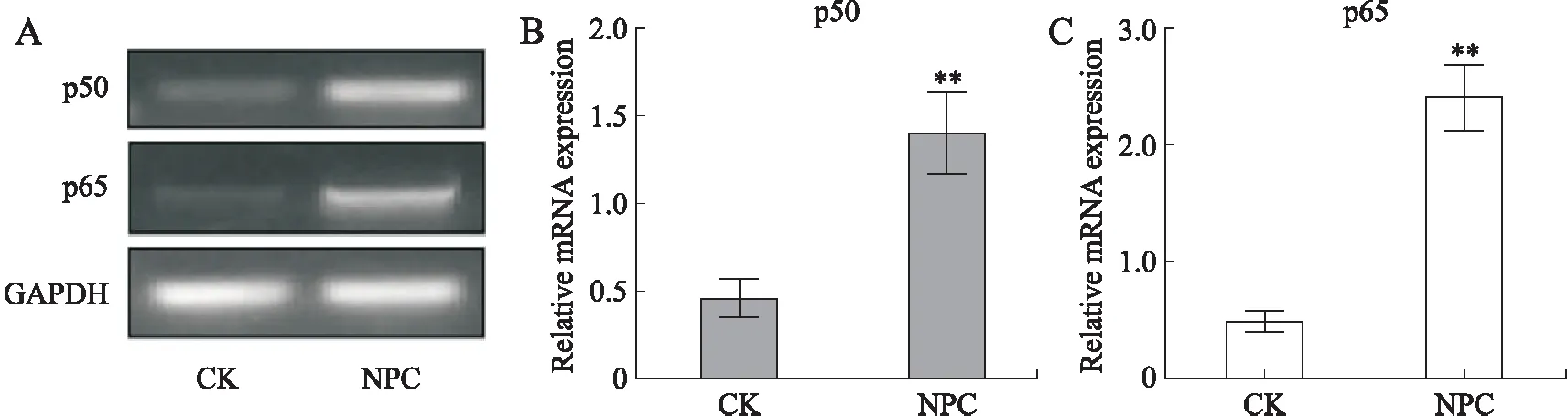
图4 p50和p65基因在鼻咽癌CEN1细胞中的表达
图5 p50和p65蛋白在鼻咽癌CEN1细胞中的表达
BMAL1可通过炎症通路NF-κB调节乳腺癌细胞的侵袭和转移,并建立生物钟与炎症反应之间的联系。为了探究NPC的分子机制,本研究检测了细胞核B因子(NF-κB)的成员p65和p50基因的表达量。结果显示,p50和p65基因在NPC细胞中均表现上调的趋势,这说明NPC激活了NF-κB信号通路,使其产生一系列相关的反应。静息时IκBα和p65/p50形成复合物,其在细胞质中无活性,当细胞被细胞外信号刺激时,IκBα同时被磷酸化和降解,并从p65和p50解离,使NF-κB(即p65和p50)暴露于核定位位点。游离的p65和p50迅速转移到细胞核并与特定序列结合,调节与免疫和炎症相关的多种基因的转录,从而调节细胞生长、自身免疫和炎症[18]。有研究发现,BMAL1可以募集CBP,促进p65的乙酰化水平,进一步激活p65的表达并促进NF-κB信号通路。与这些已报道的研究结果相似,本研究结果也表明,NPC中p50和p65基因以及蛋白质的表达均明显上调,这说明NF-κB信号通路被这一过程激活而起到调节作用。
研究发现,CLOCK-BMAL1复合物控制RHOA-ROCK-CFL途径组分的表达,促进癌细胞增殖、迁移和侵袭[19]。细胞核中过多时钟基因表达可能激活NF-κB的表达[20],导致过量的炎性细胞因子产生,而BMAL1下调可以抑制这种激活反应。本研究中,BMAL1在NPC患者中明显下调,而p50和p65基因以及蛋白质的表达均明显上调,证明BMAL1对NF-κB信号通路具有负调控作用,具体机制有待进一步研究。LOU等[21]的研究表明,BMAL1可能作为转录因子或转录辅因子起作用,或与其他转录因子相互作用。当NF-κB信号通路被激活时,p65和p50形成二聚体以结合靶基因的启动子区域,从而实现靶基因的调节[22]。以往的研究证明,BMAL1可以通过募集CBP乙酰化和NF-κB活化来增强p65[23]。此外,本研究表明,因BMAL1下调而提高NF-κB靶基因(p50、p65)的表达,这可能是由于CBP的积累促进了p65的乙酰化,BMAL1募集到NF-kB-p65。因此,本研究揭示了BMAL1和CerbB-2通过炎症通路NF-κB调节鼻咽癌细胞的侵袭和转移的分子机制,为鼻咽癌的治疗和预防提供了进一步的理论支持。

