蒙古黄芪苗期立枯病害及其病原菌鉴定
陈爱昌 王艳霞 漆永红 罗宁 李惠霞
摘要:为明确蒙古黄芪苗期立枯病害及其病原菌种类,采用组织分离法进行病原菌分离,并根据其培养性状、形态学和分子生物学rDNA-ITS特征进行鉴定。结果表明,该病害的病原菌为立枯丝核菌(Rhizotonia solani)。室内致病性测试结果表明,立枯丝核菌可引起蒙古黄芪苗期立枯病。本研究首次报道了蒙古黄芪苗期立枯病及其病原菌,可为生产上该病害的防治提供理论依据。
关键词:苗期;蒙古黄芪;立枯病;病原鉴定;致病性测定
中图分类号:S436.429文献标志码:A论文编号:cjas2020-0082
Identification of Rhizoctonia solani and Its Pathogen in Astragalus membranaceus var. mongholicus Seedling Stage
Chen Aichang1, Wang Yanxia2, Qi Yonghong3, Luo Ning4, Li Huixia4
(1Dingxi Station of Plant Protection and Quarantine, Dingxi 743000, Gansu, China;
2Dingxi Station of Rural Energy, Dingxi 743000, Gansu, China; 3Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China; 4College of Plant Protection, Gansu Agricultural University, Lanzhou 730070, Gansu, China)
Abstract: In order to clarify the pathogen and pathogenicity of Rhizoctonia solani in Astragalus membranaceus var. mongholicus seedling stage, the pathogen was isolated by tissue isolation method and identified according to its culture traits, morphology and molecular biological characteristics. The results showed that the disease pathogens were identified as Rhizotonia solani. This study first reported Rhizoctonia solani and its pathogen in Astragalus membranaceus var. mongholicus seedling stage, which could provide a theoretical basis for the control of the disease in production.
Keywords: Seedling Stage; Astragalus menbranaceus var. mongholicus; Rhizoctonia solani; Pathogen Identification; Pathogenic Testing
0引言
黄芪(Astragalus menbranaceus)是豆科黄芪属多年生草本植物,有蒙古黄芪(Astragalus menbranaceus var. mongholicus)和膜荚黄芪(Astragalus menbranaceus)[1],以干燥的根入药,具有补气固表、利尿托毒、排脓、敛疮生肌等功效[2]。蒙古黄芪原产于山西、内蒙、河北、陕西和甘肃等地。甘肃省陇西县是国内主要的道地黄芪产区之一,具有品质优和产量高等特点,被中国特产组委会命名为“中国黄芪之乡”。随着甘肃省黄芪人工栽培面积的逐年扩大、黄芪连作生长环境的改变和土壤病原菌数量的不断积累,黄芪病害已成为制约其产量增加和品质提升的重要因素之一。
关于黄芪的一些病害国内学者有研究。陈宏宇等[3]对黄芪根腐病的发病因素进行调查,结果发现,温湿度、土壤质地、茬口对黄芪根腐病的发生都有一定的影响,连作是黄芪根腐病发生的主要因素之一,轮作对根腐病的防治作用明显。据报道[4-9]黄芪根腐病的主要病原菌为尖孢镰孢菌(Fusarium oxysporium)、茄病镰孢菌(Fusariumsonali)、锐顶镰刀菌(Fusarium acuminatum)、芬芳镰刀菌(Fusarium redolens)、链格孢菌(Alternaria sp.)和Ilyonectria torresensis等。骆得功等[10]、陈泰祥等[11]和陈秀蓉等[12]对甘肃省陇西县几个重病区的黄芪霜霉病病原菌鉴定为黄芪霜霉菌(Peronospora astragalina)。任举[13]报道,黄芪叶部的锈病由单孢锈菌属(Uromyces)真菌引起。李绥峰[14]、孙树文等[15]、徐福祥[16]、邢占民[17]、周天旺等[18]和陈泰祥等[19]对黄芪白粉病的发生特点、发生规律、病原种类及防治进行了研究。马莹莹等[20]系统总结了黄芪主要病害的发生情况、致病菌种类的多样性、抗病品种选育、栽培管理模式、土壤營养、化学防治和生物防治等,为黄芪病害的综合防治提供了参考。关于立枯丝核菌引起的黄芪根病有报道,但由其引起的苗期黄芪立枯病未见报道。因此,笔者对定西市苗期发生的黄芪立枯病的发病症状进行研究,以确定其病原种类和致病性,为苗期黄芪立枯病的田间防治提供理论依据。
1材料与方法
1.1病样采集及田间病害分级
在定西市农业科学研究院黄芪种植基地,采集苗期黄芪立枯病发病植株,记录采集信息后装入自封袋。采用5点取样法进行田间调查,每点30株。病害分级标准为:0级—根部无病斑,1级—根部病斑面积占总根部面积的1/4以下,3级—根部病斑面积占总根部面积的1/4~1/2,5级—根部病斑面积占总根部面积的1/2~3/4,7级—根部病斑面积占总根部面积的3/4以上。
1.2病原菌分离
采用常规组织分离法[21],无菌条件下剪取病健交界处组织块5 mm×5 mm置于75%酒精中浸泡5 s,然后转移至1.5%次氯酸钠溶液中消毒1 min,无菌水漂洗3次晾干,置于PDA培养基平板内于25℃培养5~7天。将分离纯化的菌株转接至PDA斜面,4℃保存备用。
1.3病原菌形态学鉴定
将病原菌接种在PDA培养基上,25℃下培养7天后,观察并拍照记录菌落形态、颜色、产孢结构及孢子大小。根据魏景超[22]的分类方法和标准进行病原菌种类鉴定。
1.4病原菌分子生物学鉴定
1.4.1真菌基因组DNA提取刮取PDA培养基上的病原菌菌丝,按照真菌基因组DNA快速抽提试剂盒E.Z. N.A HP Fungal DNA Kit(OMEGA)的步骤提取DNA,保存于-20℃备用。
1.4.2分子鉴定的引物试验采用真菌核糖体基因ITS区域引物D1和D2,引物序列分别为ITS1(TCCGTAGGTGAACCTGCGG)和ITS4-R(TCCTCCG CTTATTGATATGC)。
1.4.3 PCR扩增、凝胶电泳、测序及序列分析PCR扩增体系(20μL):2×Taq PCR SuperMix 10μL,10μmol/L正反向引物各1μL,DNA模板1μL,用ddH2O补足至20μL。PCR反应条件:94℃预变性2 min;94℃变性20 s,50℃退火10 s,72℃延伸30 s,35个循环;72℃延伸2 min,4℃保存备用。PCR产物经1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。
1.4.4 rDNA序列比较分析与系统发育树使用BioEdit校对测序结果并拼接序列。测序后的序列经校正后,在核酸序列数据库GenBank(http://blast.ncbi.nlm.nih. gov/)中进行同源序列搜索,比较测试菌株与数据库中相应序列的相似程度,获得同源性较高的立枯丝核菌ITS序列,应用DNAMAN进行序列比对分析,并用Mega 6.0 Neighbor-joining法构建系统发育树。
1.5病原菌致病性测定
采用柯赫氏法则进行致病性测定,将灭菌土装入高和直径都为15 cm的花盆中,挑选大小一致且无病斑的黄芪苗3株移栽,共移栽6盆。待黄芪茎秆长至6 cm时拨开花盆上部8 cm土壤,将分离纯化的病原物打成10 mm菌饼,分别做针刺和无刺伤接菌,以未接菌PDA培养基为对照,每株接1个菌饼,回填土壤浇水。50天后调查发病情况,同时将发病部位再次分离培养,通过形态学和分子生物学鉴定确定分离得到的病原菌与初接病原菌是否为同一病原菌。
2结果与分析
2.1发病症状
田间调查发现,苗期黄芪立枯病在6月上旬发病,8月进入发病盛期。地上部发病植株长势衰弱,叶色灰绿,失水状,少数叶片枯萎,提前脱落(图1a)。根茎部产生不规则形黑褐色网状病斑,围绕整个根茎,病斑不凹陷(图1b)。
2.2形态学鉴定特征
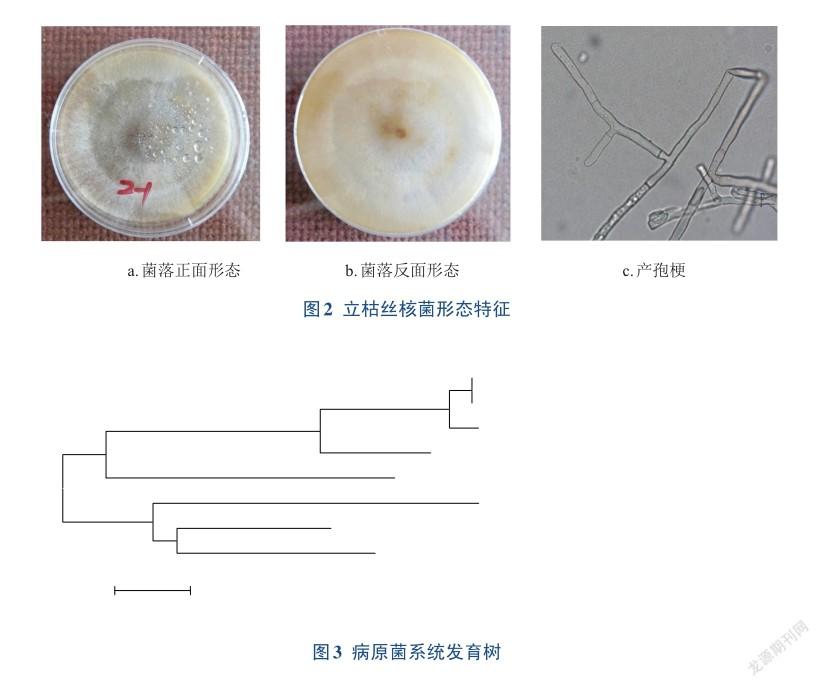
在PDA培养基上(图2a~b),菌落初为白色,逐渐变为淡褐色至深褐色,菌落中间较密,边缘稀疏。3~4天形成“菌核”,菌核初为白色,后变紫褐色至深褐色。初生菌丝无色,粗细较均匀,直径4.98~8.79μm,分枝呈直角或近直角,分枝处大多有缢缩(图2c),附近生有一隔膜。
2.3核糖体rDNA-ITS序列分析
测序结果与GenBenk数据库中进行Nucleotide Blast比对,与立枯丝核菌的ITS片段同源性达100%。用Mega 7.0软件,采用邻接法构建系统发育树,黄芪立枯病与Rhizoctonia solani亲缘关系最近(图3)。结合形态学和分子生物学特征,将引起黄芪立枯病的病原菌鉴定为立枯丝核菌(R. solani)。
2.4致病性测定
室内致病性测试结果(图4)表明,接菌植株表现出与自然病株相同的症状,未接菌植株表现正常,从接种发病黄芪植株上全部分离到病原菌,形态学和分子生物学鉴定为立枯丝核菌。
3讨论
植物病害病原种类的确定是防治的前提和基础,明确病原种类对制定合理的防治策略和提高防治效果有重要的指导作用。本试验首次报道了苗期黄芪立枯病的发病症状,同时明确了该病害的病原菌为立枯丝核菌。

苗床立枯病是黄芪生产上的一种毁灭性病害,引起育苗阶段黄芪早死,同时带病植株移栽到大田将造成产量损失大,降低黄芪等级和影响品质。该病由立枯丝核菌引起,菌核在土壤中的存活时期长,防治很困难。该病原菌寄生范围广,包括水稻、大麦、棉花、茼麻、黄麻、洋麻、甜菜、大豆、烟草、洋葱、黄瓜、莴苣、丝瓜、十字花科蔬菜、番茄、马铃薯、茄子、豌豆、蚕豆、豇豆等,同时可引起苗前死亡、立枯、基腐和根腐等病害,由此可以發现该病原菌为害的普遍性和发病的严重性,本试验首次报道了立枯丝核菌可以引起苗期黄芪的立枯病。中药材种植所需的种苗一部分自给自足,大部分通过购买种苗,苗床带病种苗是立枯病远距离传播的主要途径,一旦病菌在土壤中定殖将造成严重的为害,这进一步说明在生产上确保苗期健康种苗的重要性。
立枯病可以通过多种综合措施进行防治[23-25]。陈秀蓉等[12]提出通过剔除病苗、与禾本科植物实行2年以上轮作,收获后彻底清除田间病残体,这些物理防治可以减少初侵染源。此外,化学防治是有效的防治措施之一,据报道一些药剂30%苯噻氰乳油1000倍液、95%噁霉灵水剂3000倍液蘸根10 min,晾干后移栽,或用40%拌种双可湿性粉剂67.5 kg/hm2拌30 kg细土混匀,撒施于地面,耙入土中可以防治立枯病。关于由立枯丝核菌引起的苗床黄芪立枯病的化学防治技术和方法未见报道,有待于进一步研究。同时,为更好地防治该病害,掌握苗期立枯病发生的流行规律和侵染循环也是很有必要的。

参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:283-284.
[2]潘燕,张硕,张岫美.黄芪的药理作用与临床应用研究进展[J].食品与药品,2006(9):5-7.
[3]陈宏宇,毛正云.黄芪根腐病发病因素调查初报[J].农业科技与信息,2014(21):13-14.
[4]陈垣,朱蕾.郭凤霞,等.甘肃渭源蒙古黄芪根腐病病原菌的分离与鉴定[J].植物病理学报,2011,41(4):428-431.
[5]王鋒军.渭源县黄芪根腐病发病特征及防治技术[J].农业科技与信息,2018(19):24-25.
[6]邓成贵.黄芪根腐病病原鉴定研究初报[J].中药材,2005(2):85.
[7]王立新,孙先荣,白全江.黄芪根腐病病原菌鉴定[J].华北农学报, 1994,9(2):107-109.
[8]高芬,赵晓霞,秦雪梅,等.山西省蒙古黄芪根腐病优势致病菌群分析[J].植物保护学报,2018,45(4):878-885.
[9]牛世全,耿晖,韩彩虹,等.甘肃陇西黄芪根腐病病原菌的分离与鉴定[J].西北师范大学学报:自然科学版,2016,52(2):75-78.
[10]骆得功,韩相鹏.黄芪霜霉病发生与药剂防治[J].植物保护,2006, 32(3):104-105.
[11]陈泰祥,王艳,陈秀蓉,等.甘肃省黄芪霜霉病病原鉴定及田间药效试验[J].中药材,2013,36(10):1560-1563.
[12]陈秀蓉.甘肃省药用植物真菌病害及其防治[M].兰州:甘肃科学技术出版社,2011:26-28.
[13]任举.黄芪病虫害的发生特点与防治措施[J].农业科技与信息, 2012(13):61-63.
[14]李绥峰.黄芪白粉病发生特点及防治方法[J].现代园艺,2010(5): 57.
[15]孙树文,马伟,谢家全,等.一年生膜荚黄芪白粉病发病情况[J].中医药信息,2009,26(6):19-20.
[16]徐福祥.黄芪白粉病无公害防治技术[J].甘肃农业科技,2005(1): 46-47.
[17]邢占民,石爱丽,马常语,等.黄芪白粉病发生规律及绿色防治措施[J].农业科技与信息,2015(7):13-14.
[18]周天旺,李建军,张新瑞,等.黄芪白粉病发生动态调查及药剂防治试验[J].中国植保导刊,2012,32(12):48-49.
[19]陈泰祥,陈秀蓉,王艳,等.甘肃省黄芪白粉病病原鉴定及田间药效试验[J].农药,2013,52(8):599-601.
[20]马莹莹,关一鸣,王秋霞,等.黄芪主要病害及防治措施研究进展[J].特产研究,2019,22(4):101-107.
[21]方中达.植病研究方法[M].北京:中国农业出版社,2001:6-13.
[22]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:349-350.
[23]陈虹娇,李怡心,陈文静,等.2株芽孢杆菌在棉花根部定殖动态[J].石河子大学学报:自然科学版,2018,36(1):75-80.
[24]景芳,张树武,刘佳,等.长枝木霉T6生防菌剂发酵条件优化及其对辣椒立枯病的防治效果[J].中国生物防治学报,2020,36(1):113-124.
[25]宋顺华,徐秀兰,吴萍,等.种子处理对西瓜苗期3种病害的防治效果[J].植物保护,2017,43(3):207-212.

