农杆菌介导遗传转化云蔗05-51*
段智睿 ,吴转娣,姚 丽,覃 伟,吴才文,曾千春
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.云南省农业科学院 甘蔗研究所,云南 开远 661600)
甘蔗是主要的糖料和能源作物,蔗糖产量占世界食糖总产量的76%、占中国食糖总产量的90%以上。然而,多年来甘蔗单一品种种植引发了病虫害加剧、品种退化、抗逆性差和产量下降等问题,给蔗糖生产带来巨大的经济损失[1]。云蔗05-51 以创新种质崖城90-56 为母本,新台糖23 号为父本,于2013 年通过国家鉴定;该品种综合性状优异,具有良好的适应性、丰产稳产性,早熟高糖、抗寒抗旱性强,田间表现出苗快且整齐、分蘖力强、中大茎、有效茎多和宿根性强等特点[2]。20 世纪70 年代中期,中国开始甘蔗离体快繁工厂化生产,相关技术已经相当成熟[3]。吴转娣等[4]以云蔗05-51 茎芽为起始材料,采用MS 基本培养基添加(0.5 mg/L 6-BA+0.1 mg/L KT)与增殖培养基添加(6-BA 1.0 mg/L+0.5 mg/L KT)等建立了离体快繁系统。但是以云蔗05-51 心叶作为外植体的组培再生体系及其遗传转化系统尚未见报道。
G418 是一种氨基糖苷类抗生素,通过抑制转座子Tn601 和Tn5 的基因干扰核糖体功能,从而阻断蛋白质合成,对原核和真核等细胞产生毒素[5-7]。新霉素磷酸转移酶基因(nptⅡ)是在植物转基因工程中被广泛应用的标记基因,该基因来自大肠杆菌(Escherichia coli)的aphA2基因,编码的产物氨基糖苷磷酸转移酶 [APH (3′) Ⅱ-酶]对氨基糖苷类抗生素具有抗性,将nptⅡ基因作为选择标记基因与目标基因一同导入受体植物,可赋予转基因植株对氨基糖苷类抗生素的抗性,用于植物转基因筛选[8-10]。国内有报道甘蔗G418 耐受性的筛选[10-12],但并没有开展nptⅡ标记基因的遗传转化。为此,本研究以新台糖22(ROC22)为对照,先建立云蔗05-51 组培再生体系,明确G418 的筛选质量浓度,进一步开展农杆菌介导遗传转化其胚性愈伤组织系统,为有益基因导入甘蔗品种提供参考。
1 材料与方法
1.1 试验材料
云蔗05-51 (YZ05-51)和新台糖22 (ROC22)均来自云南省农业科学院甘蔗研究所,G418 由德国生物科技(BioFroxx)公司生产,农杆菌EHA 105 以及质粒pRPBSCK-35SBt 由中国科学院遗传与发育生物学研究所朱祯研究员提供,试验在云南开远云南省甘蔗遗传改良重点实验室完成。
1.2 愈伤组织诱导与继代培养
选择田间生长4~6 个月、健壮状态一致的甘蔗主分蘖,砍取蔗茎顶端50 cm 长(保留4~5 节),装入塑料袋带回实验室备用。剥去外层成熟叶片,用75%酒精喷洒表面,超净工作台中剥去外层叶鞘,在无菌滤纸上将生长点以上约5~7 cm心叶卷横切成厚度为1 mm 的切段,接种于愈伤诱导培养基上,每皿接种20 个切段,每处理接种15 皿,重复3 次,(25±1) ℃暗培养。云蔗05-51愈伤诱导培养基配方为:MS+2,4-D (0.5、1.0、1.5、2.0、2.5、3.0 和3.5 mg/L)+蔗糖(30.0 g/L)+卡拉胶(8.0 g/L)+活性炭(0.2 g/L),pH 为5.8。每14 d 继代培养1 次,第56 天统计愈伤组织情况,以分析2,4-D 诱导云蔗05-51 愈伤组织的最佳质量浓度。
愈伤诱导率=产生愈伤组织的外植体数/外植体总数×100%。
1.3 不定芽分化
挑选干燥、结构松散、颜色淡黄和生长旺盛的直径约0.5 cm 的愈伤组织块接种到分化培养基上,每瓶接种10 块,每处理15 瓶,重复3 次,光照培养12 h/d,光强2 300 lx,温度(27±1) ℃。云蔗05-51 分化培养基配方为:MS+6-BA (0.5 和1.0 mg/L)+KT (0.1、0.3 和0.5 mg/L)+蔗糖(30.0 g/L)+卡拉胶(8.0 g/L),pH 为5.8。每14 d 继代1 次,第56 天统计愈伤组织分化情况,以分析6-BA和KT 分化云蔗05-51 愈伤组织块不定芽的最佳配比。
分化率=分化出不定芽愈伤组织块数/愈伤组织总块数×100%;
死亡率=愈伤组织死亡块数/愈伤组织总块数×100%。
1.4 愈伤组织增殖阶段G418 耐受性筛选
方法参考文献[10]并略有改动。挑选干燥、结构松散和颜色淡黄的直径约0.5 cm 的愈伤组织块接种到含抗生素G418 (0、20、30 和40 mg/L)的愈伤组织增殖培养基中,每皿接种20 块,每个处理15 皿,重复3 次,暗培养,温度(25±1) ℃。以ROC22 为对照,每15 d 继代1 次,第60 天统计愈伤组织成活与抑制情况,以筛选确定云蔗05-51 胚性愈伤组织增殖阶段合适的G418 质量浓度。
成活率=愈伤组织成活块数/愈伤组织总块数×100%;
抑制率=愈伤受抑制块数/愈伤组织总块数×100%。
1.5 不定芽分化阶段G418 耐受性筛选
方法参考文献[10]并略有改动。挑选干燥、结构松散和颜色淡黄的直径约0.5 cm 的愈伤组织块接种到含抗生素G418 (0、10、20、30、40 和50 mg/L) 的分化培养基中,每瓶接种10 块,每个处理接种15 瓶,重复3 次,光照培养12 h/d,光强2 300 lx,温度(27±1) ℃。以ROC22 为对照。每15 d 继代1 次,第60 天统计分化情况,以筛选确定云蔗05-51 胚性愈伤组织不定芽分化阶段合适的G418 质量浓度。
分化率=分化出不定芽的愈伤组织块数/愈伤组织总块数×100%;
抑制率=愈伤受抑制块数/愈伤组织总块数×100%。
1.6 农杆菌转化与抗性植株分化
方法参考文献[13]并略有改动。将含nptⅡ基因的工程菌EHA105 (农杆菌)培养至对数生长期后,加入100 μmol/L 乙酰丁香酮激活Vir基因,并调节工程菌OD660值到约0.6 用于浸染。与此同时,选取生长旺盛的胚性愈伤组织,于超净工作台无菌滤纸上风干至表面呈收缩状,浸入到前述工程菌液中。在低压环境下保持2~4 min,静置5 min,重复2~3 次[14]。滤去菌液,在无菌滤纸上吸干残液并吹干至表面无水膜。转移到MR[13]固体培养基上,(25±1) ℃暗培养2~4 d 后,转移到含G418 愈伤筛选培养基上,(25±1) ℃暗培养。每15 d 继代1 次,直至筛选出G418 抗性愈伤组织。将抗性愈组织转移到含G418 分化筛选培养基上,12 h/d 光照培养,光强2 300 lx,温度(27±1) ℃。每15 d 继代1 次,直至获得抗性芽。将抗性芽转移到无激素的1/2MS 固体培养基上,生根,炼苗移栽。以ROC22 为对照,处理方法相同。
1.7 抗性苗分子检测
选择生长旺盛、浓绿、高4~7 cm 的抗性植株,编号,剪取叶片组织约20 mg,试剂盒提取DNA,PCR 检测nptⅡ基因,目标片段约700 bp。引物序列F1:5′-GAGGCTATCGGCTATGACTG-3′;R1:5′-ATCGGGAGCGGCGATACCGTA-3′。PCR 反应体系10.0 μL (模板2.0 μL,F1 和R1 各1.0 μL,EasyTaq酶5.0 μL,ddH2O 1.0 μL)。扩增程序为:94 ℃预变性4 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸 1 min,38 个循环,72 ℃延伸10 min。1.5% 琼脂糖85 V 电泳检测PCR 产物,溴化乙啶染色后用凝胶成像系统扫描。
NPTII ImmunoStrip®Test (Agdia,CatSTX 73000)在蛋白水平的检测方法参照试剂条使用说明但有改动。称取待检测甘蔗植株心叶20 mg,横剪成1~2 cm 长,置于1.5 mL Eppendorf 管中,加400 µL PEB 缓冲液,用塑料棒挤压捣碎叶片直至溶液呈浅绿色。台式离心机10 000 r/min 离心2 min,取上清液300 µL 至1.5 mL 管中,将检测试剂条标有“sample”的一端插入上清液中,静置15 min 并保持下端接触上清液,阳性植株会出现2 条带。
1.8 数据统计分析
数据采用SPSS 20.0 统计软件进行方差分析(ANOVA),采用Duncan’s 法检验处理间平均值的显著差异(P<0.05),数据表示为“mean±SE”。
2 结果与分析
2.1 愈伤组织诱导
由表1 可知:2,4-D 质量浓度为3.0 mg/L 时愈伤组织的诱导率最高,为97.61%,愈伤组织块直径在1.5 cm 以上,生长状态最佳,结构松散。因此,云蔗05-51 愈伤组织诱导的2,4-D 最佳质量浓度为3.0 mg/L。

表1 2,4-D 对云蔗05-51 愈伤组织诱导的作用Tab.1 Effect of 2,4-D on the callus induction of YZ05-51
2.2 不定芽分化培养
由表2 可知:6-BA 和KT 质量浓度分别为1.0和0.1 mg/L 时愈伤组织块上的不定芽分化率最高,为98.30%,死亡率为0.03%,组织块上有大量不定芽,不定芽高度超过1.5 cm,且愈伤组织结构仍较松散。因此,云蔗05-51 愈伤分化不定芽的6-BA 和KT 最佳用量分别为1.0 和0.1 mg/L。
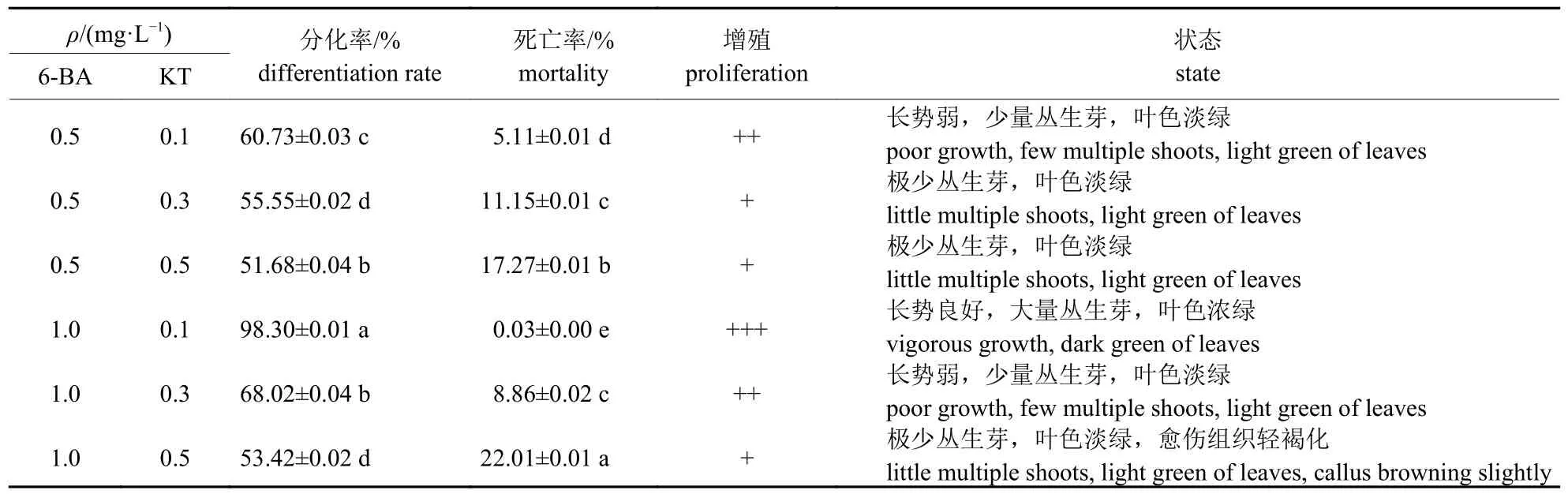
表2 6-BA 和KT 不同质量浓度配比对云蔗05-51 愈伤组织块分化不定芽的作用Tab.2 Effect of 6-BA and KT combination on the buds generation of YZ05-51 from callus
2.3 G418 对甘蔗愈伤组织生长的影响
由图1 可知:当G418 质量浓度为30 mg/L 时,ROC22 愈伤组织的生长完全受到抑制;当G418质量浓度为40 mg/L 时,YZ05-51 愈伤组织生长的成活率接近0。相同培养环境下,云蔗05-51愈伤成活率要高于ROC22,抑制率低于ROC22,说明在愈伤组织阶段ROC22 对G418 较YZ05-51 更敏感。

图1 不同G418 质量浓度下云蔗05-51 和ROC22 愈伤组织诱导的成活率和抑制率Fig.1 The survival rates and inhibition rates of callus induction of YZ05-51 and ROC22 at different mass concentrations of G418
2.4 G418 对甘蔗愈伤组织块不定芽分化的影响
由图2 可知:当G418 质量浓度为20 mg/L 时,ROC22 愈伤组织块上不定芽的分化率接近0;当G418 质量浓度为30 mg/L 时,YZ05-51 愈伤组织块上不定芽的分化率接近0。相同培养环境下,云蔗05-51 不定芽分化率要高于ROC22,抑制率低于ROC22,说明在不定芽分化阶段ROC22 对G418 较YZ05-51 更敏感。

图2 不同G418 质量浓度下云蔗05-51 和ROC22 愈伤组织块不定芽分化的分化率和抑制率Fig.2 The differentiation rates and inhibition rates of YZ05-51 and ROC22 buds generation from callus at different mass concentrations of G418
2.5 抗性苗分子检测
由图3 可知:PCR 检测的15 株抗性植株(9 株为YZ05-51,6 株为ROC22) 中,11 株扩增出与预期大小700 bp 相符的片段,阳性植株率达73.3%,说明G418 筛选效果较好,且nptⅡ基因已整合到抗性植株基因组中。NPTⅡ蛋白检测结果(图4) 显示:受检测的4 株抗性植株中的3 株出现2 条带,表明nptⅡ基因蛋白水平正常表达。
3 讨论
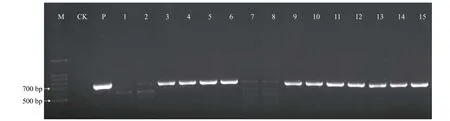
图3 筛选标记基因nptII 的PCR 检测Fig.3 PCR detection of marker gene nptII

图4 抗性植株NPTII 蛋白检测Fig.4 NPTII ImmunoStrip® test of the G418 resistant plants
本试验中G418 达到抑制YZ05-51 愈伤组织增殖和不定芽分化的质量浓度分别为40 和30 mg/L,完全抑制ROC22 愈伤组织增殖和不定芽分化的质量浓度分别为30 和20 mg/L,与林美娟等[12]研究得出的同品种甘蔗在不同组培阶段对G418 的耐受性不同以及不同品种在相同组培阶段对G418 耐受性存在明显差异的结论相符。在G418对ROC22 影响的试验中,刘家仪等[11]研究表明:ROC22 愈伤组织增殖和分化阶段完全受到抑制的G418 用量分别为20 和30 mg/L,与本研究结果相反,也与林美娟等[12]的总体趋势结论相反。
农杆菌介导已成功转化水稻[15]、玉米[16]和甘蔗[17]等禾本科植物,采用的筛选标记基因分别为bar(水稻和玉米)和pmi基因,其相应的筛选试剂分别为除草剂和甘露糖。nptⅡ标记基因被广泛应用于植物转基因研究,氨基糖苷类抗生素作为其常用的筛选剂,在番茄[18]和梨[19]的应用中已有成功报道。本研究采用农杆菌介导法结合G418筛选,成功地将nptⅡ基因导入云蔗05-51,抗性植株nptⅡ基因PCR 检测阳性率为73.3%;NPTⅡImmunoStrip 检测表明:nptⅡ在蛋白水平正常表达,为有益基因导入云蔗05-51 和其他甘蔗品种奠定了基础。

