DNA甲基转移酶3b对乳腺癌细胞微小RNA表达的影响
(北华大学医学技术学院实验中心,吉林 吉林 132013)
乳腺癌是女性最常见的恶性肿瘤之一,死亡率高,严重危害女性健康。乳腺癌的发生发展常受到多种基因的调控(原癌基因的激活和抑癌基因的失活),同时也受到一些表观遗传学因素[DNA甲基化和微小RNA(microRNA,miRNA)等]影响[1-3]。其中DNA甲基化的发生不仅可以影响肿瘤相关基因的表达变化,而且对位于CpG岛附近或位于CpG岛中的miRNA表达产生影响[4-6]。本研究探讨抑制DNA甲基化和siRNA干扰DNA甲基转移酶3b(DNA methyltransferase 3b,Dnmt3b)后乳腺癌细胞MCF-7中miRNA和肿瘤相关基因的表达情况,旨在为乳腺癌的诊断和治疗提供依据。
1 材料与方法
1.1 材料
人乳腺癌细胞株MCF-7购自中国科学院上海细胞生物学研究所,DMEM培养液、胎牛血清和胰蛋白酶购于美国HyClone公司,转染试剂购于美国QIAGEN公司,RNA提取、反转录试剂盒和荧光定量PCR试剂盒购于日本TaKaRa BIOINC公司,GAPDH抗体、DNA甲基化抗体购于英国Abcam公司,二抗购于中国博士德公司,抗荧光淬灭剂、Hoechst33258购于德国Sigma公司。siRNA由上海吉玛公司合成,引物由上海生工生物有限公司合成。
1.2 方法
1.2.1 免疫荧光染色检测MCF-7细胞甲基化水平:将盖玻片过酸处理高压灭菌后,放入24孔板中,接种MCF-7细胞,24 h后实验组分别加入5-氮杂-2’-脱氧胞苷(5-Aza-2’-deoxycytidine,5-Aza-CdR),终浓度分别为5-Aza-CdR 10、5、1 μmol/mL;对照组加入等体积PBS,每24 h加入1次5-Aza-CdR,同时更换培养液,连续处理4 d。4 d后取出盖玻片,PBS清洗3次,用5%多聚甲醛固定30 min,PBS清洗3次。用TritonX-100(0.2%)透化40 min,盐酸(4N)酸化30 min,弃去液体后,用Tris盐酸(pH8.0)中和20 min,PBS清洗3次。BSA(1%)4 ℃封闭过夜后,加入适量5-甲基胞嘧啶直接荧光抗体(1%BSA 1∶50稀释),避光放置4 ℃过夜,PBS清洗3次,每次30 min。在适量Hoechst33258染色液(5 mg/L)中避光染色10 min,PBS避光清洗3次,每次5 min。将含抗荧光淬灭剂的封片剂DABCO滴于载玻片上封片,30 min内荧光倒置显微镜下观察,拍照并记录。
1.2.2 siRNA转染及细胞生长曲线绘制:MCF-7细胞用含有10%胎牛血清和90%DMEM培养液,置于37 ℃、5%CO2中培养。实验分为空白对照组(Mock组)、阴性对照组(NC组)和干扰组(siRNA组)。针对Dnmt3b的siRNA-1511及其阴性对照序列如下:5’-CGCCUC AAGACAAAUUGCUTT-3 ’;5’-AGCAAUUUGUCUU GAGGCGTT-3’。转染前1 d将细胞按照1×105/mL接种于24孔板中,每孔加入1 mL培养液。过夜贴壁后,每孔更换为400 μL无血清培养液待用。用100 μL无血清培养液稀释80 ng siRNA,与3 μL转染试剂混匀,室温静止5~10 min,轻轻将转染复合物滴加至24孔板中,轻轻摇匀,转染6 h后荧光显微镜下观察转染情况,计算转染效率。48 h后提取RNA检测目的基因表达情况,96 h后检测miRNA与相关基因表达情况。转染前后连续5 d显微镜下计数细胞,绘制细胞生长曲线。
1.2.3 qRT-PCR检测siRNA干扰后细胞Dnmt3bmRNA的表达:转染48 h后提取NC组、Mock组、siRNA组细胞RNA逆转录,获得的cDNA进行qRT-PCR扩增Dnmt3bmRNA,β-actin作为内参,采用2-ΔΔCt法进行数据分析,引物序列见表1。
1.2.4 Western blotting检测siRNA干扰后细胞Dnmt3b蛋白的表达:收集Mock组、NC组、siRNA组细胞,加入RAPI细胞裂解液,4℃裂解10 min,其间涡旋振荡2次,30 s/次,4℃离心15 min,取上清,BCA法测定蛋白浓度。调蛋白浓度一致,进行SDS聚丙烯酰胺凝胶电泳,半干法转膜。封闭后加入Dnmt3b单克隆抗体(1∶100稀释),内参加入兔抗-GAPDH抗体(1∶200稀释),慢摇1 h,用PBS-T洗膜3次,每次20 min。加入二抗(Dnmt3b 1∶3 000稀释;GAPDH 1∶2 000稀释),室温孵育40 min,PBS-T洗膜1次,PBS洗膜2次,每次10 min。在显影仪中滴加显影液显影,用Image J软件对蛋白表达条带进行光密度值的定量分析。
1.2.5 高通量测序检测miRNA的表达情况:将细胞按1×105/mL接种于6孔板,每孔加入含10%胎牛血清的DMEM,3孔/组,分为实验组和对照组,实验组每孔加入终浓度5 μmol/mL的5-Aza-CdR,换液1次/24 h,并重新加入5-Aza-CdR。72 h后每孔加入1 mL Trizol将细胞完全裂解,miRNA高通量测序委托上海吉玛公司进行。
1.2.6 qRT-PCR检测mRNA和miRNA的表达:采用Trizol法提取RNA,检测浓度与质量,进行逆转录,qRT-PCR扩增,退火温度及引物序列见表1、表2。以β-actin为内参,采用2-△△Ct法计算各基因相对表达量。
1.3 统计学分析
采用SPSS 16.0统计学软件进行统计处理。计量资料用表示,组间比较采用t检验,P< 0.05为差异有统计学意义。

表1 引物序列Tab.1 Sequences of the primers used in the study

表2 miRNA引物序列Tab.2 Sequences of the primers targeting miRNA sequences used in the study
2 结果
2.1 5-Aza-CdR对细胞DNA甲基化水平的影响
荧光显微镜观察MCF-7甲基化程度,结果可见,随着5-Aza-CdR浓度的升高,5-甲基胞嘧啶甲基化抗体染色逐渐减弱,表示其整体甲基化水平逐渐降低。与对照组(59.37±8.45)比较,1、5、10 μmol/mL组(分别为34.30±9.47、5.11±2.78、4.99±2.64)甲基化水平均有统计学差异(均P< 0.05),但5 μmol/mL组与10 μmol/mL组比较差异无统计学意义(P> 0.05),因此后续实验选用5 μmol/mL浓度5-Aza-CdR,见图1。
2.2 siRNA转染后细胞生长及Dnmt3b的表达
Western blotting结果显示,siRNA干扰组中Dnmt3b的表达低于Mock组和NC组(P< 0.05),见图2A、2B。qRT-PCR结果显示,与对照组比较,siRNA干扰组Dnmt3b的表达显著下降(P< 0.05),抑制达75%以上,见图2C;细胞计数可见Mock组和NC组细胞生长速度相近,而与Mock组和NC组比较,siRNA干扰组细胞生长受到抑制(P< 0.05),见图2D。说明siRNA转染后显著下调Dnmt3b的表达。
2.3 5-Aza-CdR处理、Dnmt3b siRNA干扰后癌基因和抑癌基因mRNA的表达
与对照组比较,经5 μmol/mL 5-Aza-CdR处理后WWOX、MMP7表达显著下调,TCF21、TIMP1表达显著上调,差异均有统计学意义(P< 0.05),见表3。与NC组比较,siRNA干扰组抑癌基因BRCA1、BRCA2及癌基因MMP7、survivin的表达均显著下调(均P<0.05),见表3。
2.4 高通量测序检测5-Aza-CdR处理后miRNA的表达情况
高通量测序结果显示,1 319个miRNA表达存在差异,其中,67个miRNA表达有统计学差异(均P<0.05),见图3。20个miRNA实验组与对照组均有表达,见表4;47个miRNA对照组中无表达,见表5。
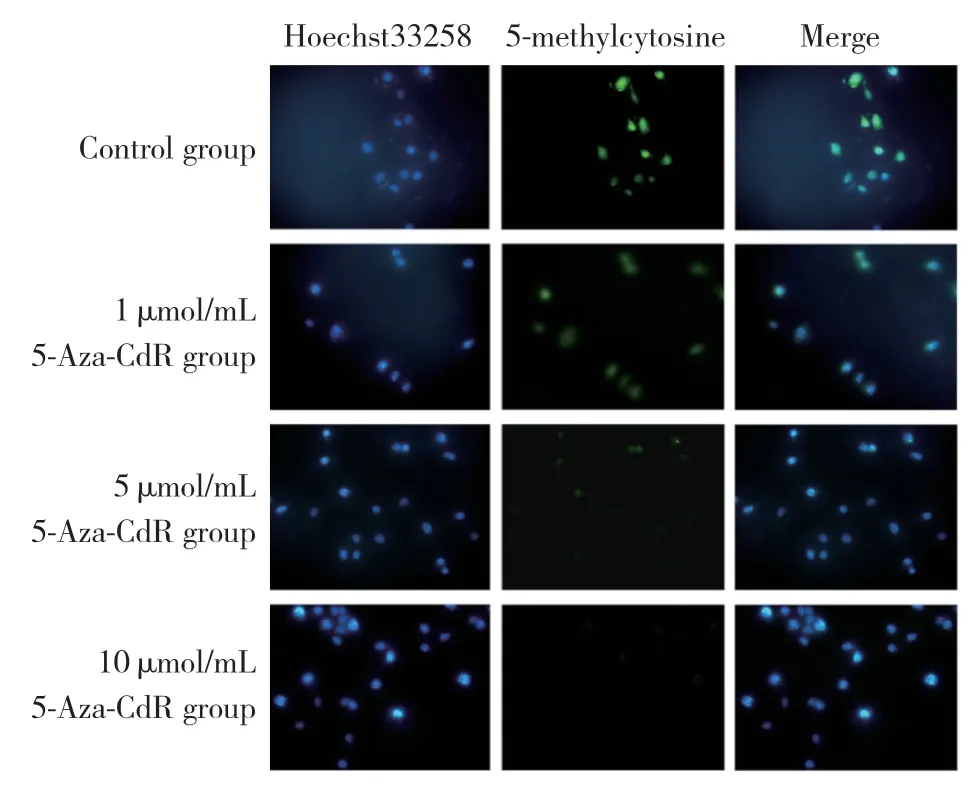
图1 5-Aza-CdR处理后细胞DNA甲基化水平的改变×400Fig.1 Changes in DNA methylation levels in cells after 5-Aza-2’-deoxycytidine(5-Aza-CdR)treatment×400

图2 siRNA干扰后细胞生长及Dnmt3b的表达Fig.2 Cell growth and DNMT3b expression after siRNA interference
2.5 qRT-PCR检测5-Aza-CdR处理、Dnmt3b siRNA干扰后miRNA的表达情况
与对照组比较,经5 μmol/mL 5-Aza-Cdr处理后miR-200a、miR-411、miR-382、miR-409、miR-493、miR-127、miR-520a、miR-654表达量显著上调(P<0.05),并且此8个miRNA的差异性表达与高通量测序结果一致。与NC组比较,siRNA干扰组中miR-29b、miR-506、miR-200a、miR-203b、miR-409、miR-520a、miR-654的表达显著上调,而miR-200b、miR-127的表达显著下调(均P< 0.05),见表6。
3 讨论
miRNA来源于细胞核内基因组的miRNA基因,部分miRNA位于CpG岛附近或位于CpG岛中,这些miRNA表达极易受到DNA异常甲基化的调控[7-9]。miRNA的异常表达与肿瘤的发生发展密切相关,尽管完整的miRNA表达调控机制目前尚不清楚,但已有研究提示肿瘤细胞中DNA甲基化异常会引起miRNA表达改变。HASHIMOTO等[10]研究显示胃癌组织和细胞中miR-181c基因CpG岛高甲基化,而miR-181c低表达,经5-Aza-CdR处理后miR-181c表达恢复,同时抑制了胃癌细胞增殖。在DNA甲基化过程中,DNA甲基转移酶(DNA methyltransferase,Dnmt)参与催化,其包含Dnmt1、Dnmt3a和Dnmt3b等,其中Dnmt3b参与CpG从头甲基化[11]。有研究[7]表明乳腺癌组织中Dnmt3b表达增加,并且与肿瘤分期及预后相关。本研究通过5-Aza-CdR抑制乳腺癌细胞整体甲基化水平,结果显示,miR-200a、miR-411、miR-382、miR-409、miR-493、miR-127、miR-520、miR-654的表达显著上调,而仅干扰Dnmt3b表达时,miR-29b、miR-506、miR-200a、miR-203b、miR-409、miR-502a、miR-654表达显著上调,miR-127、miR-200b表达显著下调,此结果与高通量测序结果基本一致。有研究[13-14]表明miR-29家族可调控Dnmt3a和Dnmt3b的表达。由此可见,Dnmt3b会受到miRNA的调控,也可以改变部分miRNA基因甲基化状态,从而影响它们的转录表达。
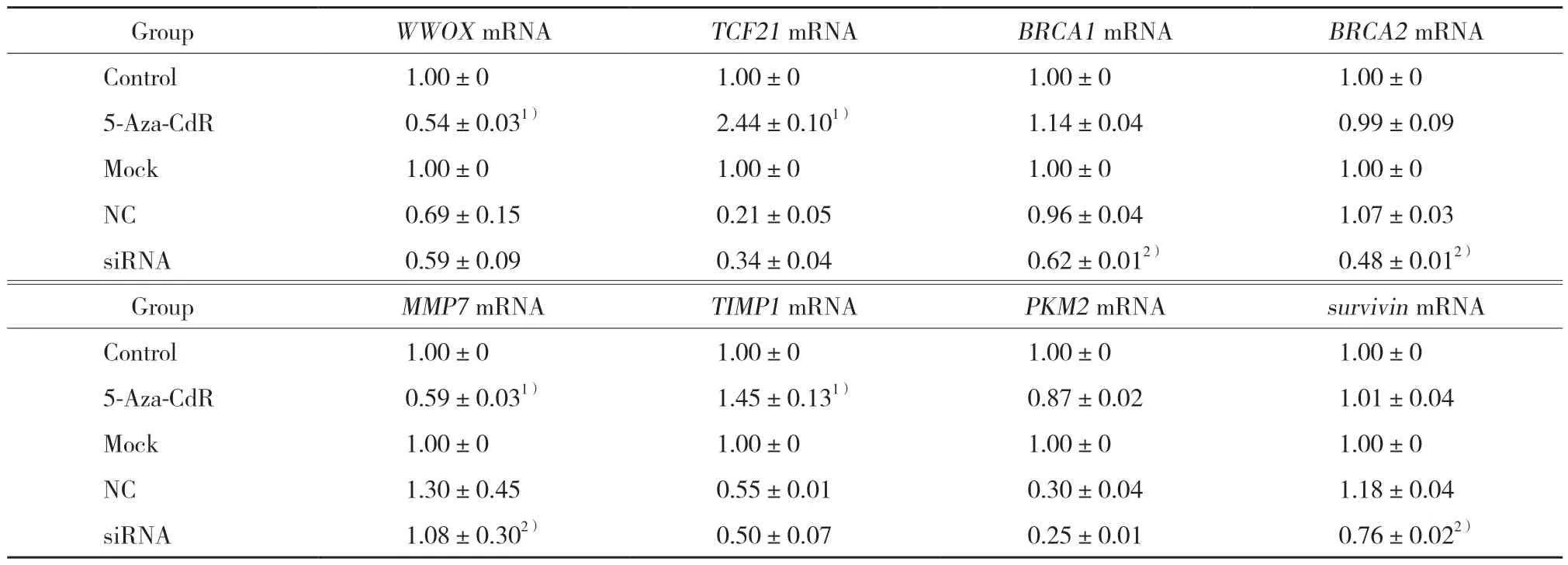
表3 5-Aza-CdR处理及Dnmt3b siRNA干扰后癌基因和抑癌基因mRNA的表达Tab.3 Relative mRNA expression of oncogenes and tumor suppressors after 5-Aza-2’-deoxycytidine(5-Aza-CdR)treatment and DNMT3b siRNA interference
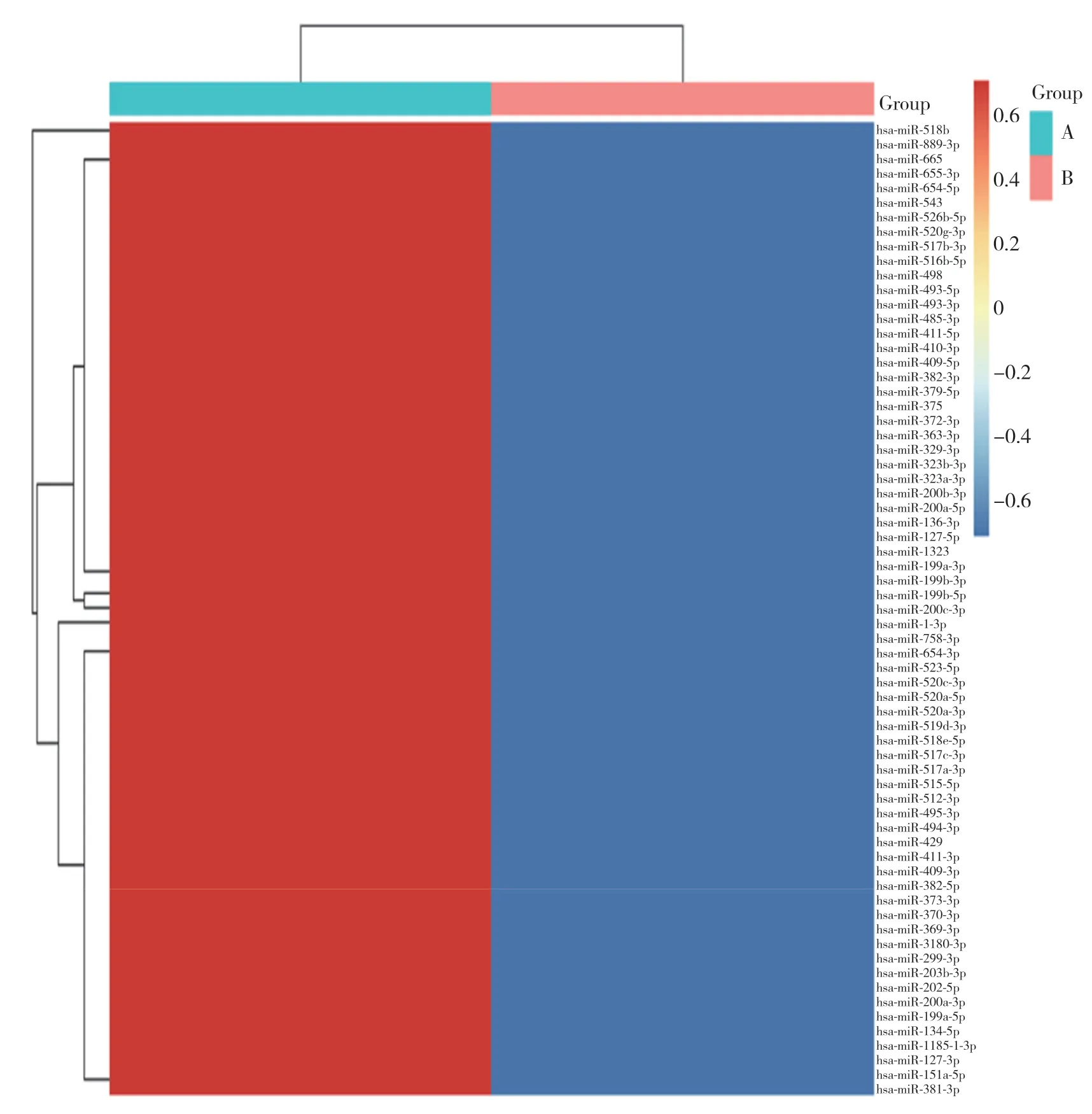
图3 5-Aza-CdR处理后MCF-7 miRNA高通量测序差异表达Fig.3 Identification of differentially expressed miRNAs after 5-Aza-2’-deoxycytidine(5-Aza-cdR)treatment

表4 高通量测序中miRNA差异表达Tab.4 Differential expression of miRNAs determined via high-throughput sequencing
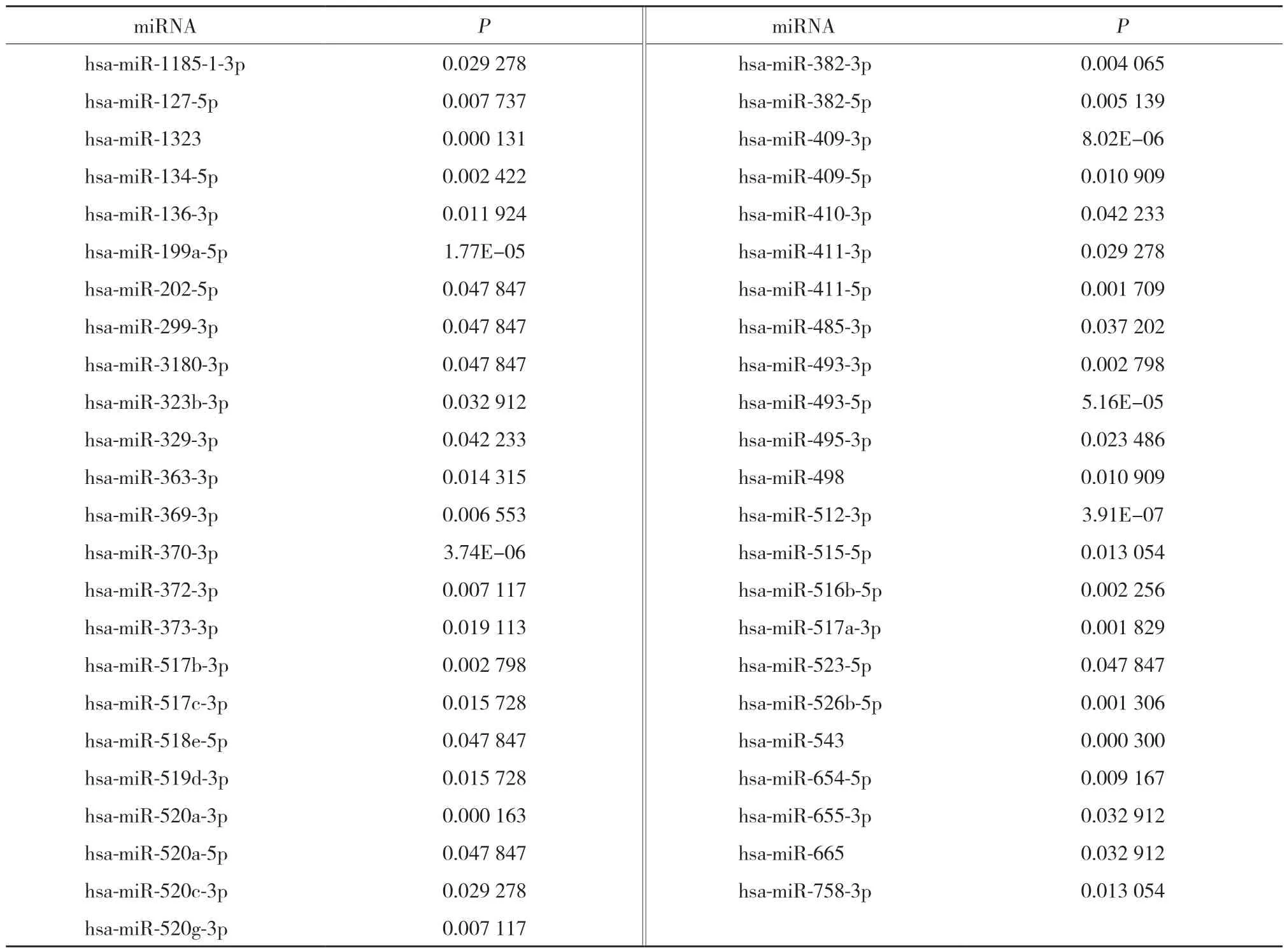
表5 高通量测序中对照组不表达的miRNATab.5 List of miRNAs not expressed in the control group as determined via high-throughput sequencing
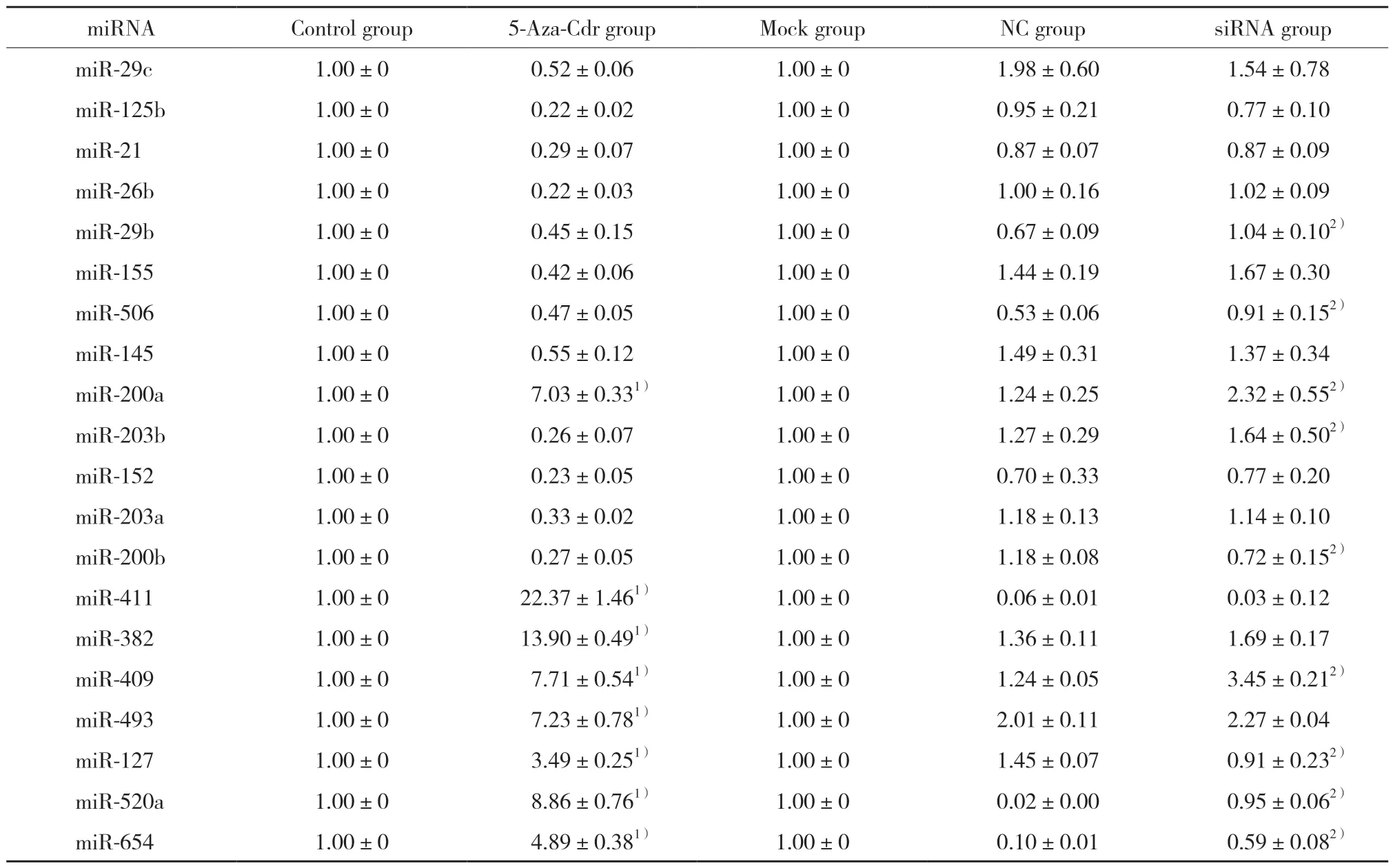
表6 5-Aza-CdR处理及Dnmt3b siRNA干扰后miRNA的表达Tab.6 Relative expression levels of miRNA after 5-Aza-2’-deoxycytidine(5-Aza-CdR)treatment and DNMT3b siRNA interference
乳腺癌的发生发展与癌基因的表达增高和抑癌基因的沉默密切相关,Dnmt3b作为甲基化的催化剂可以影响部分基因表达的功能。已有研究表明,在癌组织中抑癌基因WWOX、TCF21、BRCA1、BRCA2[15-20]表达下降,而癌基因MMP7[21]、TIMP1[22]、PKM2[23]、survivin[24]表达增高。本研究中5-Aza-CdR可以使乳腺癌细胞中抑癌基因WWOX和癌基因MMP7表达降低,而上调抑癌基因TCF21和癌基因TIMP1,其中TCF21和MMP7的表达符合预期结果,而WWOX和TIMP1的结果分析原因可能是由于转录后调控影响这些基因的表达。对于siRNA干扰抑制Dnmt3b的表达中可见癌基因TIMP1、PKM2、survivin的表达显著降低,而抑癌基因WWOX、TCF21、BRCA1、BRCA2的表达也降低,分析原因可能是由于甲基化程度与组织特异性的关系存在多样化,虽然这些基因在前列腺癌、肺癌、大肠癌甚至乳腺癌中甲基化程度较高,但实验中所培养的细胞种类不同、肿瘤的分期进展不同、肿瘤的组织种类不同,其甲基化水平也不相同。另外本研究仅对Dnmt3b进行干扰抑制Dnmt3b的表达,推测Dnmt3b对WWOX、TCF21、BRCA1、BRCA2的表达影响较小,并不占主要调控位置,其他甲基转移酶是这些基因发生甲基化的主要因素,目前研究者对乳腺癌易感基因的甲基化研究还不够成熟,往往出现矛盾的结果,具体原因还有待进一步探讨。
综上所述,Dnmt3b可影响乳腺癌细胞相关基因WWOX、TCF21、BRCA1、BRCA2、MMP7、TIMP1、PKM2、survivin及miR-29b、miR-506、miR-200a、miR-200b、miR-203b、miR-409、miR-127、miR-520a的表达。DNA甲基化是一种可逆的表观遗传学修饰方式,逆转与肿瘤发生发展相关的miRNA基因甲基化水平将改变肿瘤细胞的生物学特性,为肿瘤的精准治疗提供新的方向[25]。本实验从Dnmt3b对miRNA及mRNA的影响作用出发,应用siRNA干扰的方法改变Dnmt3b的表达,检测乳腺癌相关miRNA及mRNA的表达情况,明确了Dnmt3b对miRNA及靶基因mRNA的相互调控机制,为乳腺癌的临床精确诊治提供了依据。

