膀胱癌细胞TFAM下调介导mtDNA应激抑制NK细胞杀伤的作用机制
杨 帆,尚炳亮,刘 静,姚田军,周幸春,王 禾,张 波
(1.空军军医大学第二附属医院唐都医院泌尿外科,西安 710038;2.空军军医大学基础医学院,西安 710069)
自然杀伤(natural killer,NK)细胞是机体防御肿瘤的第一道防线,因其不需要致敏可直接杀伤肿瘤细胞同时分泌干扰素γ(interferonγ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)及白细胞介素8(Interleukin 8,IL-8)等细胞因子而成为继T细胞之后最有潜力的肿瘤免疫治疗新星[2]。然而,研究发现肿瘤局部浸润的NK细胞功能存在显著异常并成为促进肿瘤恶性进展的重要因素之一[3]。因此,探索肿瘤逃避NK细胞杀伤的机制成为肿瘤免疫治疗领域研究的热点。
人类白细胞抗原-G(human leukocyte antigen G,HLA-G)属于非经典HLA Ⅰ类抗原,其分子能够与β2微球蛋白结合形成类似经典HLA Ⅰ类分子的结构。HLA-G能够与免疫细胞表面的抑制性受体即免疫球蛋白样转录子(immunoglobulin-like transcript,ILT)2、ILT4以及杀伤细胞免疫球蛋白样受体(Killer cell immunoglobulin-like receptor,KIR)2DL4等结合而有效抑制CD4+T细胞增殖、NK细胞及CD8+T细胞的杀伤。正常组织中HLA-G仅表达于母胎界面的绒毛外滋养层细胞和胸腺上皮发挥局部免疫抑制作用。在肿瘤组织中,HLA-G表达显著升高。在肾癌、肝癌、卵巢癌以及胶质瘤细胞中过表达HLA-G可抑制NK细胞的杀伤,HLA-G中和性抗体可恢复NK细胞对肿瘤细胞的杀伤[10]。研究显示肿瘤微环境中的缺氧和白细胞介素1β(Inter-leukin 1β,IL-1β)、干扰素α(interferon α,IFNα)、IFN-γ、白细胞介素6(inter-leukin 6,IL-6)等细胞因子水平增高是导致肿瘤细胞HLA-G表达上调主要主要因素[10]。
线粒体转录因子A(mitochondrial transcription factor A,TFAM)是一种由核基因编码的线粒体转录因子,其在线粒体DNA(mitochondrial DNA,mtDNA)的复制、转录及拟核结构的维持方面发挥着重要的作用[11-12]。TFAM表达减少会导致mtDNA应激的发生,主要表现为:线粒体功能异常,mtDNA拟核结构松散同时mtDNA从线粒体内溢出至细胞质被胞质模式识别受体TOLL样受体9(Toll-like receptor 9,TLR9),环GMP-AMP合酶(cyclic GMP-AMP synthase,cGAS)及炎症小体NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)等所识别激活免疫相关信号通路导致肿瘤细胞分泌IL-10、IL-1β以及干扰素等细胞因子[13-14]。近年来,越来越多的研究发现肿瘤组织中TFAM的表达水平存在显著异常且与肿瘤的恶性进展密切相关,然而其在膀胱癌组织的表达及其是否参与膀胱癌的恶性进展尚不清楚。
本研究首次在膀胱癌组织及癌旁组织中分析了TFAM的表达及其与膀胱癌预后的关系,并进一步分析了TFAM降低通过促进HLA-G分子的表达促进膀胱癌细胞逃避NK细胞攻击的作用及机制,阐明了膀胱癌细胞免疫逃逸的新机制,有望为膀胱癌免疫治疗提供新的靶点。
1 材料与方法
1.1 材料膀胱癌组织芯片(KX-BL192a)购自北京龙迈达斯科技开发有限公司;即用型免疫组化EliVisionTMplus检测试剂盒购自福州迈新生物技术开发有限公司;Gibco胎牛血清购自生工生物工程有限公司;UM-UC-3、T24膀胱癌细胞系及NK细胞系购自赛百慷(上海)生物技术股份有限公司;实时荧光定量PCR试剂和试剂盒购自赛默飞世尔科技公司;兔抗人TFAM单克隆抗体(ab176558)、鼠抗人HLA-G单克隆抗体(ab7759)及鼠抗人单克隆抗体(ab8226)均购Abcamb公司;Alexa Fluor®488 Mouse IgG2a抗人HLA-G(400237)及鼠抗人HLA-G中和抗体(335902)均购自Biolegend公司,LDH试剂盒购自江莱生物科技有限公司;荧光共聚焦显微镜FV1000和倒置显微镜YM310购自Olympus公司;NovoCyte流式细胞仪购自艾森生物有限公司。
1.2 免疫组织化学法检测膀胱癌组织TFAM蛋白的表达及免疫组化结果评分膀胱癌石蜡组织芯片经二甲苯及由高至低浓度梯度乙醇脱腊;PBS清洗3 min×3次;柠檬酸钠高压修复90 s冷却至室温;PBS清洗3 min×3次;30 g/L双氧水室温孵育15 min祛除内源性过氧化物酶;PBS清洗3 min×3次;山羊血清室温封闭30 min;一抗(1∶1 000)4 ℃孵育过夜;甩去一抗PBS清洗5 min×3次;加即用型生物素标记的二抗室温孵育20 min; PBS清洗5 min×3次;加辣根光氧化物酶标记标记的二抗室温孵育2 h,DAB显色;自来水冲洗后加苏木素孵育5 min,自来水冲洗;5 g/L的盐酸乙醇分化;淡氨水反蓝;由低至高梯度乙醇二甲苯脱水;中性树胶封片。免疫组化结果由2名病理学专家进行判读:高倍镜下(×200)阳性细胞数除以视野面积为每个视野的平均染色强度,取3个视野的细胞染色强度平均值为每个样本的平均染色染色强度。
1.3 构建TFAM稳定干涉或过表达的膀胱癌细胞系6孔板以5×105个/孔的密度接种膀胱癌细胞;24 h后,将由上海吉玛公司订购的TFAM稳定干涉及过表达的慢病毒载体按照说明书上的MOI值加入细胞上清中感染膀胱癌细胞;6 h后弃去上清换液成含嘌呤霉素的培养上清,以含嘌呤霉素的培养上清持续培养1周直至未感染细胞完全死去,继续用含嘌呤霉素的培养基扩大培养并收集蛋白做Western-blot检测干涉及过表达的效果。
1.4 qPCR检测膀胱癌细胞TFAM及HLA-G基因的表达按照商品化试剂盒提取TFAM稳定干涉及过表达细胞的总mRNA并按照逆转录试剂盒操作逆转录生成cDNA;以逆转录cDNA为模板以上海吉玛公司合成的TFAM引物:F-5’-GGCAAGUUGUC CAAAGAAACC-3’R-5’UUUCUUUGGACAACUU GCCAA-3’;HLA-G引物:F-5’CCATGTGGTATTT CAGCGCC-3及R-5’TGTTCCGTGTCTCCTCTTCC-3’。人β肌动蛋白(β-actin)为内参其引物:5’-GGAGCGAGATCCCTCCAAAAT-3’及5’-GGCT GTTGTCATACTTCTCATGG-3’。按照qPCR商品化试剂盒SYBR Green PCR Kit的说明书操作步骤进行操作。β-actin作为内参基因,采用2-△△Ct法计算目的基因mRNA的含量,每个样品重复3个孔,实验重复3次。
1.5 Western-blot检测膀胱癌细胞TFAM及HLA-G表达取对数生长期的TFAM稳定干涉或过表达的膀胱癌细胞,弃上清PBS洗3遍;滤纸吸干PBS后用RIPA裂解液裂解细胞提取细胞总蛋白;BSA蛋白定量试剂盒测定蛋白浓度;加上样缓冲液煮沸;经SDS凝胶电泳分离蛋白条带;将蛋白转移至PDVC膜上;TBST清洗3遍;加封闭液室温封闭1 h;加一抗(TFAM 1∶1 000,HLA-G 1∶500)4 ℃过夜;TBST清洗5 min×3次;加辣根过氧化物酶标记羊抗鼠兔的二抗(1∶10 000)室温孵育1 h;TBST洗5 min×3次;加化学发光液发光并使用Image J软件分析蛋白条带灰度值。每组实验重复3次以减少实验误差。
1.6 流式细胞术检测膀胱癌细胞膜型HLA-G的表达收集对数生长期的TFAM稳定干涉及过表达的膀胱癌细胞,调整细胞数为2×106;加PBS洗涤5 min×3次;加多聚甲醛固定;加PBS洗涤5 min×3次;按照空白对照组(不加抗体),同型对照组(加同型无关抗体)及待测抗体组(抗HLA-G)分别加相关抗体室温孵育40 min;加PBS洗涤5 min×3次;加荧光标记的二抗室温孵育30 min;加PBS洗涤5 min×3次;流式检测。每个样本3个重复,平均值为其最终检测值。
1.7 ELISA检测NK细胞活化相关细胞因子IFN-γ、TNF-α及IL-8的表达TFAM稳定干涉及过表达的膀胱癌细胞与NK细胞共培养48 h后收集培养上清,或者在TFAM稳定干涉的膀胱癌细胞与在共培养体系中加入IgG及抗HLA-G中和抗体与NK细胞共培养48 h后收集上清,T24 EV及T24 TFAM细胞分别加入PBS及重组HLA-G后与NK细胞共培养48 h后收集细胞培养上清。将以上细胞培养上清加入到包被抗HLA-G的商品化ELISA试剂盒中,按照试剂盒说明书完成ELISA检测,每个样本3个复孔其A值的平均值为样本最终检测值。
1.8 LDH释放实验检测NK细胞的杀伤将TFAM稳定干涉或者过表达的膀胱癌细胞以1×105的密度种至圆底96孔板中;24 h后加入NK细胞,按照效靶比1∶1、5∶1、10∶1以及20∶1的比例共培养,同时设置靶细胞自然释放组和最大释放组,每个样本3个复孔;37 ℃孵育;2 h后取出培养物,吸取各孔上清0.1 mL加于另一培养板孔中,每孔加入新鲜配制的LDH底物溶液0.1 mL,室温避光反应10~15 min;每孔加入1 mol/L柠檬酸终止液30 μL,以终止酶促反应;用酶联检测仪在570 nm波长下读取各孔A值,并计算NK细胞活性。
1.9 Picogreen及Mitotracker检测膀胱癌细胞双链DNA及线粒体的定位将TFAM稳定干涉及过表达的膀胱癌细胞接种至6孔板;24 h后弃去培养上清用无血清培养基洗3遍;加1∶1 000稀释的Picogreen及Mitotracker Red CMXRos 37 ℃孵箱共培养30 min;无血清培养基洗3遍;在激光共聚焦显微镜下观察mtDNA及线粒体的共定位。

2 结 果
2.1 线粒体转录因子A在膀胱癌组织中的表达较癌旁组织显著降低且与膀胱癌患者的预后显著相关免疫组化检测膀胱癌及癌旁组织中TFAM的表达,结果显示:与癌旁组织相比,膀胱癌组织中TFAM表达显著降低(图1A)。免疫组化评分结果显示:膀胱癌组织中TFAM免疫组化评分值为5.589±2.346,显著低于癌旁组织中TFAM的免疫组化评分值7.321±1.453(图1B)。根据膀胱癌组织中TFAM表达水平(免疫组化评分中位数)将膀胱癌患者分为TFAM高表达组和TFAM低表达组。Kaplan-Meier生存曲线分析结果显示:TFAM低表达越低的膀胱癌患者其总生存期越短,复发率越高,TFAM表达越高的膀胱癌患者其预后越好,复发率越低(图1C、D)。

A:膀胱癌及癌旁组织中TFAM蛋白的表达;B:TFAM表达的免疫组化评分;C:总生存率;D复发率。图1 免疫组化检测TFAM在膀胱癌及癌旁组织的表达水平及其对膀胱癌患者预后的影响
2.2 TFAM下调促进膀胱癌细胞抑制NK细胞的杀伤利用腺病毒载体感染TFAM高表达的膀胱癌细胞株UM-UC-3和TFAM低表达的膀胱癌细胞株T24,成功构建了TFAM稳定干涉的膀胱癌细胞株UM-UC-3 shCtrl、UM-UC-3 shTFAM-1、UM-UC-3 shTFAM-2及TFAM稳定过表达的膀胱癌细胞株T24 EV及T24 TFAM(图2A、B)。将TFAM稳定干涉及过表达的膀胱癌细胞株与NK细胞共培养48 h后,ELISA检测培养上清中NK细胞活化相关细胞因子IFN-γ、TNF-α及IL-8的表达,LDH释放实验检测NK细胞对肿瘤细胞的杀伤。结果显示与UM-UC-3 shCtrl细胞相比,UM-UC-3 shTFAM-1及UM-UC-3 shTFAM-2细胞与NK细胞共培养后其培养上清中IFN-γ、TNF-α及IL-8的分泌显著减少同时NK细胞的杀伤能力显著降低(图2C,D左侧)。反之,T24 TFAM细胞与NK共培养后,培养上清中IFN-γ、TNF-α及IL-8等NK细胞因子的分泌水平及NK细胞的杀伤能力较T24 EV组均显著升高,提示膀胱癌细胞TFAM表达降低能够抑制NK细胞对其杀伤(图2C、D右侧)。

A:TFAM mRNA的表达;B:TFAM蛋白的表达;C:NK细胞活化相关细胞因子的表达;D:NK细胞杀伤能力。图2 TFAM表达水平对膀胱癌细胞逃避NK细胞杀伤的影响
2.3 下调TFAM可诱导膀胱癌细胞表达HLA-GqPCR检测TFAM对HLA-G基因表达的影响,结果显示:与UM-UC-3 shCtrl相比,UM-UC-3 shTFAM-1及UM-UC-3 shTFAM-2细胞中HLA-G mRNA的表达水平显著升高;反之,在T24 TFAM细胞中HLA-G mRNA表达水平较对照组T24 EV细胞显著降低(图3A)。Western-blot结果在蛋白水平确认:UM-UC-3 shTFAM-1及UM-UC-3 shTFAM-2细胞中HLA-G蛋白的表达较对照组UM-UC-3 shCtrl显著增高,T24 TFAM细胞中TFAM蛋白表达较T24 EV组显著减少(图3B)。流式细胞术进一步检测模型HLA-G的表达,结果确认:在UM-UC-3 shTFAM-1及UM-UC-3 shTFAM-2细胞中,膜HLA-G表达随着TFAM表达的敲低而升高,在T24细胞中随着TFAM的过表达,膜HLA-G的表达减少(图3C、D)。以上实验结果提示TFAM表达下调能够促进HLA-G的表达。

A:HLA-G mRNA的表达;B:HLA-G蛋白的表达;C:细胞膜HLA-G的表达。图3 TFAM表达水平对HLA-G表达的影响
2.4 TFAM下调通过诱导HLA-G表达促进膀胱癌细胞逃避NK细胞的杀伤肿瘤细胞膜HLA-G表达升高能够抑制NK细胞的杀伤[10],因此我们进一步检测膀胱癌细胞TFAM敲低能否通过促进HLA-G表达抑制NK细胞的杀伤。为验证此假说我们将TFAM稳定干涉的膀胱癌细胞系UM-UC-3 shTFAM-1或UM-UC-3 shTFAM-2与NK细胞共培养,同时在共培养细胞培养上清中加入HLA-G的中和抗体87G以阻断HLA-G的功能,结果显示:87G可显著恢复TFAM干涉导致的NK细胞活化相关细胞因子IFN-γ、TNF-α及IL-8等分泌减少及NK细胞杀伤抑制(图4A、C)。相反,在TFAM过表达的T24 TFAM细胞与NK细胞共培养基中加入重组可溶性HLA-G(rHLA-G)蛋白后,可显著抑制TFAM过表达介导的NK细胞杀伤及IFN-γ、TNF-α和IL-8等细胞因子的释放(图4B、D)。这些结果均提示TFAM下调可通过上调HLA-G表达介导的膀胱癌细胞逃避NK细胞的杀伤。
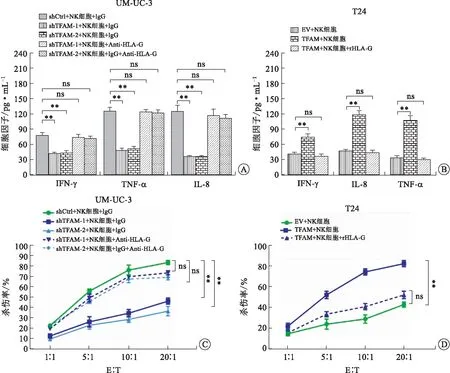
A、B:NK细胞活化相关细胞因子的分泌;C、D:NK细胞的杀伤能力检测。图4 TFAM通过促进HLA-G表达抑制NK细胞的活化与杀伤
2.5 TFAM表达下调通过诱导线粒体DNA应激促进HLA-G的表达TFAM是维护mtDNA稳态的重要分子,TFAM表达降低能够诱导mtDNA应激发生[13]。我们采用双链DNA染料Picogreen和线粒体特异性染料Mitotracker共染膀胱癌细胞中的mtDNA及线粒体结果发现与UM-UC-3 shCtrl细胞相比,UM-UC-3 shTFAM-1和UM-UC-3 shTFAM-2细胞内线粒体DNA拟核结构显著变大且松散,同时发现mtDNA由线粒体外溢至胞质(图5A)。相反,在T24细胞中过表达TFAM可导致线粒体拟核结构变得紧致,线粒体外溢至胞质减少(图5B)。分离胞质mtDNA并利用qPCR检测其拷贝数结果进一步证实,UM-UC-3 shTFAM-1和UM-UC-3 shTFAM-2细胞胞质mtDNA拷贝数较UM-UC-3 shCtrl显著升高;T24 TFAM较T24 EV胞质mtDNA拷贝数显著降低(图5C)。这些结果表明在膀胱癌细胞内干涉TFAM表达可导致mtDNA应激的发生。将脂质体包裹DNA酶Ⅰ转染至TFAM 稳定干涉的UM-UC-3细胞中以降解TFAM干涉导致的mtDNA应激导致的外溢至胞质中的线粒体DNA(图5C),qPCR结果显示:DNA酶Ⅰ能够显著抑制TFAM干涉所诱导HLA-G mRNA表达,Western-blot及流式细胞术进一步在蛋白水平证实,DNA酶Ⅰ可显著抑制TFAM干涉所导致的HLA-G蛋白的表达增高(图5D、E)。反之,在TFAM过表达的T24细胞中加入阻断线粒体呼吸功能的鱼藤酮可显著回复TFAM过表达所导致的细胞质mtDNA拷贝数减少(图5C)以及HLA-G mRNA及蛋白的表达减少(图5D、F)。这些结果均显示TFAM表达降低是通过诱导线粒体DNA应激来促进HLA-G的表达的。

A、B:线粒体DNA拟核结构以及细胞质线粒DNA;C:细胞胞质线粒体DNA的数目;D:HLA-G蛋白的表达。E、F:细胞膜HLA-G的表达。图5 TFAM表达通过诱导线粒体DNA应激促进HLA-G的表达
3 讨 论
逃避NK细胞免疫监视是肿瘤恶性进展的重要因素之一,但其机制尚不完全清楚。本研究首次发现膀胱癌组织中线粒体重要转录因子TFAM表达较癌旁组织显著降低且TFAM表达水平与膀胱癌患者的预后显著相关。干涉膀胱癌细胞中TFAM表达通过上调HLA-G抑制NK细胞杀伤,进一步揭示了TFAM下调通过介导mtDNA应激促进HLA-G表达的机制。
TFAM在肿瘤组织中的表达存在显著异常且与肿瘤细胞的恶性进展密切相关[15-18]。例如:在微卫星不稳定的结直肠组织中TFAM基因发生截断体突变导致TFAM蛋白水平显著减少,使得直肠癌细胞变得的凋亡抵抗[19]。在肾癌细胞中干涉TFAM表达可促进肾癌细胞对阿霉素的耐药[20]。口腔鳞状细胞癌组织中TFAM表达减少导致可导致mtDNA拷贝数减少引起癌细胞对顺铂耐药[21]。我们的研究首次利用免疫组化的方法在40对膀胱癌及癌旁组织中检测了TFAM的表达并进行了统计学分析,结果显示:膀胱癌组织中TFAM的表达较癌旁组织显著降低,且TFAM表达越低的膀胱癌患者其预后越差,提示膀胱癌组织中TFAM表达降低参与了膀胱癌的恶性进展。
TFAM是调控mtDNA转录复制维护mtDNA拷贝数及稳定的重要调蛋白,干涉TFAM表达可导线粒体功能异常肿瘤细胞发生免疫逃逸。研究发现,口腔癌细胞lon蛋白酶通过降解TFAM诱导mtDNA外溢至细胞质促进PD-L1及吲哚胺2,3-双加氧酶-1(IDO-1)的表达[22-25]。我们发现在膀胱癌细胞中干涉TFAM表达能够促进HLA-G的表达,HLA-G能够与NK细胞膜的抑制性受体LIR-2、ILT-4及KIR2DL4结合抑制NK细胞的杀伤功能。此外HLA-G还能够通过促进HLA-E表达的方式抑制NK细胞的活化。我们首次在膀胱癌细胞中揭示了TFAM表达降低通过促进HLA-G的表达促进膀胱癌细胞抑制NK细胞的杀伤。
HLA-G属于重要的免疫抑制分子,目前已在黑色素瘤、乳腺癌、非小细胞肺癌、结直肠癌、胃癌、膀胱癌以及膀胱癌等多种肿瘤组织中检测到HLA-G高表达[9]。肿瘤组织中HLA-G的表达受到表观遗传学、缺氧、应激、以及IL-10、干扰素以及IL-1β等细胞因子的调控[10]。TFAM表达下调介导mtDNA应激的发生其最主要特征为可激活免疫相关信号通路促进INFα及INFβ等Ⅰ型干扰素及IL-1β等细胞因子的分泌[26]。有研究发现膀胱癌组织mtDNA显著减少,且伴随IL-1β的显著升高[25]。我们发现在膀胱癌细胞内干涉TFAM表达能够通过诱导mtDNA应激促进HLA-G的表达。然而本研究中我们仅证实了TFAM诱导线粒体DNA应激通过促进胞质mtDNA来诱导了HLA-G的释放,具体是通过哪一种炎症信号通路来激活的需要做进一步的验证。
综上,TFAM在前膀胱癌组织中的表达显著减少,且TFAM表达越低的膀胱癌患者其预后越差,提示TFAM可以作为判断膀胱癌预后的重要标记物。在膀胱癌细胞中敲低TFAM表达可诱导mtDNA应激上调HLA-G表达来逃避NK细胞的杀伤。本研究以线粒体为视角,揭示了膀胱癌细胞免疫逃逸的新机制为膀胱癌的免疫治疗提供了新的潜在靶点。

