柏子仁抗焦虑作用评价及机制探究
蒋征奎,宁二娟,王学方,李晓(. 郑州大学附属肿瘤医院(河南省肿瘤医院),郑州 450003;. 河南省植物天然产物开发工程技术研究中心,郑州 45000)
随着现代生活节奏的加快和各方面压力的增大,人群中的焦虑现象日益显著并影响深远。焦虑症是一种以持续和广泛焦虑情绪或反复发作的惊恐不安为主要特征的神经症[1],常伴有心率加快、肌肉紧张、运动性不安、自主神经紊乱和睡眠障碍等表现[2-3]。世界卫生组织对包括我国在内的28 个国家的14 项流行病学研究结果表明,西方国家人群的焦虑症终身发病率为13.6%~28.8%,其中美国高达28.7%,而我国为2%~4.7%[4],女性的发病率高于男性。焦虑症已对人们的正常生活造成严重影响[5-6],探寻和使用合理有效的治疗药物和手段已成为全球范围内的焦点。目前临床常用的抗焦虑药物主要为苯二氮䓬类药物,鉴于其药物依赖性及较大的不良反应,不建议长期使用;还有抗抑郁药物,如5-羟色胺再摄取抑制剂类和去甲肾上腺素再摄取的抑制剂类药物,也具有抗焦虑作用,但其胃肠道不良反应较大,临床使用受到很大的限制。
近年来,越来越多的抗焦虑研究聚焦于传统中医药,以期找到有效的抗焦虑症药物[7]。柏子仁为柏科植物侧柏Platycladus orientalis(L.)Franco 的干燥成熟种仁,性平味甘,入心、肝、肾、大肠经,具有养肝宁心、益智安神、敛汗润燥的功效,广泛应用于治疗焦虑证的名方中[8-9],现代药理研究表明柏子仁具有改善睡眠、镇静益智和神经保护等作用[10-12]。目前,关于柏子仁的研究多集中在化学成分与临床应用方面[13],而对于其在抗焦虑方面的药效学机制研究较少。为此,本研究考察了柏子仁醇提物的抗焦虑作用并进行相关的作用机制探讨,以期为临床应用提供依据。
1 材料
1.1 仪器
BS-223S 电子天平(北京赛多利斯仪器系统有限公司);XR-XG201 高架十字迷宫、XRXZ301 旷场箱和XR-XB120 明暗箱实验系统(上海欣软信息科技有限公司);超声波清洗器(上海科导超声仪器有限公司);酶联免疫检测仪(美国伯乐公司)。
1.2 试药
柏子仁[河南张仲景大药房股份有限公司,经河南大学药学院张保国教授鉴定为柏科植物侧柏Platycladus orientalis(L.)Franco 的干燥成熟种仁]。地西泮(北京益民药业有限公司,批号:20170906, 规格:2.5 mg/片);γ-氨基丁酸(GABA)试剂盒(批号:20180803)、谷氨酸(Glu)ELISA 试剂盒(上海西塘生物科技有限公司,批号:20180902);其余试剂均为分析纯。
1.3 实验动物
SPF 级昆明种小鼠,雄性,体质量18 ~22 g [河南省实验动物中心,许可证号SCXK(豫)2016-0002]。
2 方法
2.1 柏子仁醇提物的制备
采用溶剂超声提取法提取柏子仁油:取柏子仁100 g 粉碎后,加4500 mL 95%乙醇,80 ℃提取55 min,浓缩,得残留物31.4 g,4 ℃冰箱保存备用。
2.2 造模及给药
选取72 只小鼠,随机分为6 组,分别为柏子仁高、中、低剂量(400、200 和100 mg·kg-1)组,阳性药物组,模型组和空白对照组,每组12 只。
行为学实验前,将小鼠饲养于昼夜循环正常的鼠笼中,控制室温为(20±2)℃。待小鼠自由摄食饮水7 d 后,每日安抚3 min,持续3 d,以排除或减少无关刺激对实验过程和结果的影响。实验开始后,除空白对照组外,其余5 组小鼠均以单只单笼的形式饲养,并于每日随机给予以下刺激中的1 种:断食24 h、断水24 h、昼夜循环颠倒24 h、夹尾3 min、束缚3 h、10 ℃冷水游泳5 min、30 V 电压电击足底,电击5 s 间歇5 s,共进行300 s,持续21 d 的处理后建立焦虑模型[14]。
造模第2 周开始,每日进行应激刺激前1 h,柏子仁高、中、低剂量组分别灌胃给药柏子仁醇提物400、200 和100 mg·kg-1,阳性药物组灌胃给予地西泮1 mg·kg-1,模型组和空白对照组每日灌胃给予等剂量的生理盐水,连续14 d,末次给药30 min后进行行为学实验(包括高架十字迷宫实验、旷场实验、孔板实验和明暗箱实验等),实验时间段固定为每日08:00 ~15:00,在每个实验之前使用5%乙醇清洁设备以排除可能的提示效应。在行为学实验结束后,将动物断头取脑,测定海马GABA 及Glu 的水平。受试药物用0.5%的羧甲基纤维素钠溶液一起研磨混匀后给药,每日临用新配。
2.3 高架十字迷宫实验
高架十字迷宫由两个开臂(300 mm×50 mm)和两个闭臂(300 mm×50 mm)组成,实验测试前[15]将每只小鼠放入塑料盒中,自由行走5 min后,将其放置于十字迷宫中,闭臂的周围和尾端被150 mm 高的围栏包围,开臂和闭臂通过中心区域(50 mm×50 mm)连接,使用时升高至离地高度50 cm 中央平台的中心区域,使其面向开臂并自由活动。然后,采用计算机实时跟踪小鼠在高架上的活动范围和轨迹,记录其于5 min 内进入开臂(open arm entry,OE)和闭臂的次数(close arm entry,CE)及在开臂与闭臂内的运动时间。以小鼠开臂进入次数与总入臂次数的百分率(percentage of entries to the open arms,OE%)及在开臂内运动时间与入臂的总时间百分率(percentage of entries to the close arms,OT%)作为抗焦虑作用评价的指标。
2.4 旷场实验
旷场实验考察动物总体的活动性和探究行为,在进行此项实验之前至少 12 h,小鼠不能接受任何应激[15]。旷场区域是由一个 250 mm×250 mm 的底面、四面300 mm 的高壁构成。底部用标记笔分割成16 个(40 mm×40 mm)相同大小的区域。测试开始时,将小鼠置于中央四格区域中,然后通过设备上方预先固定的摄像机监测5 min 内小鼠在开场中的活动情况,并通过与摄像机连接的监视器记录小鼠的活动轨迹,进而分析小鼠直立次数、进入旷场中央区域的次数、停留时间及总路程等指标。
2.5 孔板实验
孔板实验于一个体积参数为440 mm(长)×400 mm(宽)×270 mm(高)的木箱中进行,其底部4 个孔的孔径均为30 mm,厚18 mm,每孔中心离最近壁的距离为100 mm,孔板箱壁及每一孔周边都装有红外光电管,并与计算机相联,自动记录动物的钻头次数和钻头时间[16]。实验时,将小鼠放置于孔板中央,背对实验员进行考察。以动物两眼消失在洞中为一次钻头动作,记录5 ~10 min 内小鼠的钻头次数及持续时间。
2.6 明暗箱实验
明暗箱实验于一个400 mm(长)×400 mm(宽)×120 mm(高)的有机玻璃敞箱中进行。于其中央安装一个100 mm(长)×100 mm(宽)×120 mm(高)的暗箱,构成另两对角的L 形跑道(明箱),每个暗箱各有一个35 mm×35 mm 的洞口与两侧的跑道相连[17]。装置上方装有电视扫描和摄像系统,由此观察小鼠的穿箱次数、在明箱滞留时间及运动活性。实验时,将小鼠一起置于明箱中央,背朝通道。然后,观察5 min 内小鼠的活动情况并记录其于明箱中的停留时间和穿箱次数。每只小鼠考察完成后,用湿海绵将明暗箱彻底清洗并擦拭晾干,以排除残留气味对后期测试小鼠行为的影响。
2.7 小鼠海马组织内 GABA 和Glu 水平测定[18]
在行为学实验结束后第2日,立即将实验动物断头处死,打开颅盖和脑膜,冰台上迅速分离海马组织,称重并置液氮中冷冻保存。实验时,切取约100 mg 海马组织并放入盛有磷酸盐缓冲液的烧杯中,在冰浴条件下将其制成10%的匀浆液。将匀浆液转入离心管内,低温条件下3000 r·min-1离心15 min。弃去沉淀,取上清液,按照ELISA 试剂盒的操作步骤于450 nm 波长处检测各孔中GABA 和Glu 的吸光度(OD)值(实际样品OD值=测得样品OD值-空白OD值),经绘制的标准曲线计算出相应的浓度,再根据稀释倍数,计算小鼠海马组织中GABA 和Glu 的含量。
2.8 统计学处理
所有实验数据以“均数±标准差”的形式表示,采用SPSS 22.0 统计软件进行组间的单因素方差分析(One-way ANOVA),P<0.05 表明差异具有统计学意义。
3 结果
3.1 柏子仁对焦虑症小鼠的高架十字迷宫实验结果
与空白对照组相比较,模型组小鼠进入开臂的停留时间和开臂进入次数百分率均显著降低(P<0.05),表明造模成功。与模型组比较,不同给药剂量的柏子仁组小鼠进入开臂停留时间和开臂进入次数百分率均有所增加,且呈现一定的剂量相关性,表现出抗焦虑作用。结果见表1。
表1 小鼠高架十字迷宫实验结果( ±s,n =12)Tab 1 Elevated plus maze test for mice ( ±s,n =12)

表1 小鼠高架十字迷宫实验结果( ±s,n =12)Tab 1 Elevated plus maze test for mice ( ±s,n =12)
注:与空白对照组比较,#P <0.05;与模型组比较,*P <0.05。Note:vs the blank control group,#P <0.05;vs the model group,*P <0.05.
开臂进入次数百分率(OT)/%柏子仁高剂量组40037.35±2.37*39.62±3.77*柏子仁中剂量组20031.25±1.38*32.34±3.20*柏子仁低剂量组10027.35±2.4227.54±2.12阳性药物组 141.03±2.42*44.20±2.89*模型组-25.32±1.98#26.22±2.98#空白对照组-53.46±2.9056.78±1.98组别剂量/(mg·kg-1)开臂停留时间百分率(OE)/%
3.2 柏子仁对焦虑小鼠的旷场实验结果
与空白对照组比较,模型组小鼠主要在旷场的四周活动,而在中心区域几乎没有活动,表明小鼠的焦虑非常明显(P<0.05)。与模型组比较,小鼠在旷场中心区域的活动各给药组均有所增加,其中柏子仁高剂量组和阳性药物组有统计学意义(P<0.05),提示柏子仁在小鼠旷场实验中表现出抗焦虑作用(见表2)。
表2 小鼠旷场实验结果( ±s,n =12)Tab 2 Open field test for mice ( ±s,n =12)

表2 小鼠旷场实验结果( ±s,n =12)Tab 2 Open field test for mice ( ±s,n =12)
注:与模型组比较,*P <0.05。Note:vs the model group,*P <0.05.
组别剂量/(mg·kg-1)总路径/cm中心区域停留时间/s中心区域进入次数/次直立次数/次柏子仁高剂量组400 25 175.41±392.43* 24.82±1.31* 4.95±0.83* 25.45±2.12*柏子仁中剂量组20021 742.55±338.7520.78±1.153.27±1.1421.08±1.93柏子仁低剂量组10018 978.45±253.2418.42±1.452.98±1.2920.89±2.18阳性药物组 1 26 458.52±269.45* 26.17±2.43* 5.92±1.17* 28.79±2.04*模型组-19 042.78±289.7817.37±1.892.15±0.7217.52±1.98空白对照组-32 789.42±276.5829.79±1.677.18±1.1732.48±1.45
3.3 柏子仁对焦虑小鼠的孔板实验结果
与空白对照组比较,模型组小鼠的钻头次数及钻头持续时间明显减少(P<0.05)。与模型组比较,小鼠钻头次数和钻头持续时间各给药组均增加,其中柏子仁高剂量组及阳性药物组有统计学意义(P<0.05),提示柏子仁在小鼠孔板实验中表现出抗焦虑作用(见表3)。
表3 小鼠孔板实验结果( ±s,n =12)Tab 3 Hole board test for mice ( ±s,n =12)

表3 小鼠孔板实验结果( ±s,n =12)Tab 3 Hole board test for mice ( ±s,n =12)
注:与空白对照组比较,#P <0.05;与模型组比较,*P <0.05。Note:vs the blank control group,#P <0.05;vs the model group,*P <0.05.
组别剂量/(mg·kg-1)钻头次数/次钻头持续时间/s柏子仁高剂量组400 43.25±1.77* 43.70±3.52*柏子仁中剂量组20037.22±1.9839.20±2.20柏子仁低剂量组10033.45±2.1736.35±3.05阳性药物组 1 48.57±2.24* 50.74±2.85*模型组- 31.58±2.04# 35.54±2.54#空白对照组-60.78±1.7864.28±2.95
3.4 柏子仁对焦虑小鼠的明暗箱实验结果
与空白对照组比较,模型组小鼠在明箱中的停留时间及穿箱次数明显减少(P<0.05),表明造模成功;与模型组比较,各给药组小鼠在明暗箱中的停留时间和穿行次数均有明显增加,其中柏子仁高剂量组和阳性药物组差异有统计学意义(P<0.05)(见表4)。
表4 小鼠高明暗箱实验结果( ±s,n =12)Tab 4 Light/dark box test for mice ( ±s,n =12)
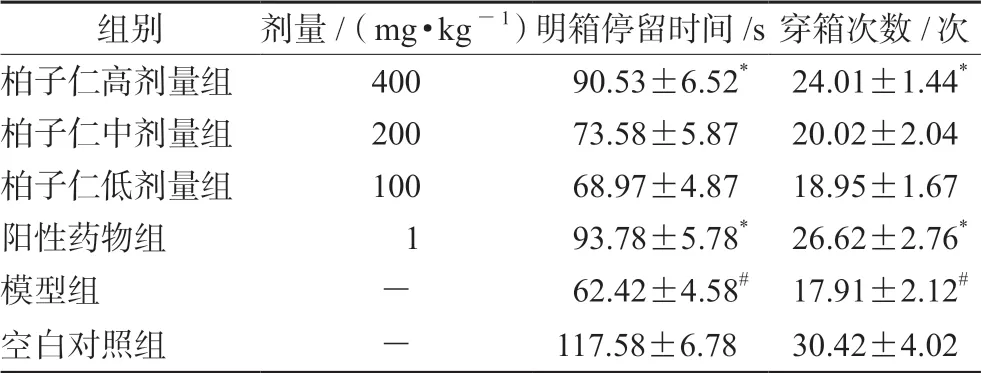
表4 小鼠高明暗箱实验结果( ±s,n =12)Tab 4 Light/dark box test for mice ( ±s,n =12)
注:与空白对照组比较,#P <0.05;与模型组比较,*P <0.05。Note:vs the blank control group,#P <0.05;vs the model group,*P <0.05.
组别剂量/(mg·kg-1)明箱停留时间/s 穿箱次数/次柏子仁高剂量组400 90.53±6.52* 24.01±1.44*柏子仁中剂量组200 73.58±5.8720.02±2.04柏子仁低剂量组100 68.97±4.8718.95±1.67阳性药物组 1 93.78±5.78* 26.62±2.76*模型组- 62.42±4.58# 17.91±2.12#空白对照组-117.58±6.7830.42±4.02
3.5 焦虑小鼠海马内GABA 和Glu 水平测定
与模型组比较,柏子仁高剂量组小鼠海马GABA 水平显著增加、Glu 水平显著降低。提示柏子仁可能通过增加海马GABA 的水平和降低海马Glu 的水平来发挥抗焦虑作用(见表5)。
表5 小鼠海马组织中GABA 和Glu 的测定结果( ±s,n =12)Tab 5 Content of GABA and Glu in the hippocampal tissue in the mice ( ±s,n =12)

表5 小鼠海马组织中GABA 和Glu 的测定结果( ±s,n =12)Tab 5 Content of GABA and Glu in the hippocampal tissue in the mice ( ±s,n =12)
注:与空白对照组比较,#P <0.05;与模型组比较,*P <0.05。Note:vs the blank control group,#P <0.05;vs the model group,*P <0.05.
Glu/(μg·g-1)柏子仁高剂量组4004.028±0.782*3.125±0.245*柏子仁中剂量组2003.357±0.6553.320±0.135柏子仁低剂量组1003.022±0.4813.502±0.256阳性药物组 14.283±0.988*3.029±0.348*模型组-2.742±0.7983.452±0.256空白对照组-4.662±0.5872.994±0.184组别剂量/(mg·kg-1)GABA/(μmol·L-1)
4 讨论
从医学角度上讲,焦虑症是因为神经元之间兴奋和抑制传递不平衡,导致神经回路信息传导不畅引发的。GABA 与Glu 作为重要的神经递质,在焦虑症中发挥重要的作用。当人体内GABA 缺乏时,会产生焦虑、疲倦、忧虑等情绪。Glu 是一种重要的中枢神经系统兴奋性递质,与人体焦虑情绪密切相关。因此,测定海马GABA 和Glu的水平可以间接反映焦虑症患者的病程,选择合适的可以增加海马GABA 水平和降低海马Glu 水平的药物,可达到治疗焦虑症的目的。越来越多的研究表明,中药在抗焦虑方面具有很大的研究价值和开发潜力[19-20]。
本实验采用乙醇超声法可以提取出柏子仁的主要药效成分, 如挥发油及脂肪油等,有利于研究柏子仁的药效学及相关机制[21-22]。进而采用经典、公认的动物模型评价柏子仁的抗焦虑作用。其中,高架十字迷宫和旷场实验利用动物对新环境的探究和恐惧之间的矛盾冲突行为来考察动物的焦虑状态,既可以建立模型也可测量焦虑反应,更能反映药物的抗焦虑作用。孔板实验可用于考察动物在特定环境下的情绪和焦虑状态及对应激的反映。明暗箱实验中的明箱停留时间是最有效的药物抗焦虑作用评价指标。
结果表明本次实验模型成功构建,柏子仁醇提物给药组在各模型上均表现出抗焦虑的行为学特征,其中柏子仁高剂量组与模型组比较可以显著改善小鼠的行为表现,具有明显的抗焦虑作用。柏子仁提取物高剂量组可以显著提高焦虑小鼠海马GABA 的水平和显著降低Glu 的水平,表明柏子仁抗焦虑作用机制可能与调节海马的GABA 及Glu 的水平有关。本研究为柏子仁的临床合理应用提供可靠依据,也为进一步研究柏子仁的药效和作用机制提供参考。
焦虑症的发生机制复杂,虽然在本次实验选择的动物模型当中,柏子仁提取物表现出较理想的抗焦虑作用,且可以改变脑内神经递质GABA和Glu 的水平。但是,由于实验条件的限制,对其机制的探讨尚需加强。后续研究需结合病理改变及神经递质的信号传导通路,以进一步深入阐明柏子仁的抗焦虑作用机制,为其临床应用和产品开发提供理论依据。

