补肾法对恶性肿瘤骨转移模型小鼠的作用价值
张士强 吴婷婷 李芸 周张杰 杨蕴 蒋海燕 夏晓婷 钟薏
骨骼是各种恶性肿瘤发生转移后较常累及的器官,其中肺癌患者中约有一半以上会发生骨转移,且骨转移多发生在肺癌晚期,严重影响患者的生存质量[1-2]。肺癌发生骨转移可引起骨痛、病理性骨折、神经压迫及高血钙等表现,严重者可危及生命[3]。目前临床上针对肺癌骨转移的治疗手段主要是化疗、放疗、手术治疗及药物治疗[4]。近年来中药治疗逐渐用于肿瘤治疗方面,且在抗肿瘤转移的研究上取得了一定进展,国内研究者采用补肾方治疗肿瘤骨转移发现补肾法可以明显延长出现新的转移灶的时间[5]。相关文献报道骨保护蛋白、核因子-κB受体活化因子和核因子-κB受体活化因子配体三种因子可通过参与破骨细胞的活化及发育过程参与肺癌骨转移的过程[6]。本研究从RANKL/RANK/OPG系统进一步探讨补肾法对肺癌骨转移抑制的作用机制,现报告如下。
1 材料与方法
1.1 实验材料、试剂、药物及仪器
C57BL/6雄性小鼠,由上海中医药大学动物实验中心提供,并在无特殊病原体(SPF级)环境下饲养。Lewis肺癌细胞株;甲醇(上海振兴化工厂);唑来磷酸(上海药物食品检验所批号为100778-200501);补肾方由本院药剂科提供,其主要成分有淫羊藿30 g,山茱萸30 g,骨碎补30 g,山慈菇30 g,壁虎9 g,制附子12 g,女贞子30 g,干蟾皮9 g,鳖甲9 g,蜂房9 g,自然铜30 g,黄精15 g,延胡索30 g。
1.2 左后肢股骨注射Lewis肺癌细胞株制备肺癌骨转移动物模型
取对数生长期体外培养的Lewis肺癌细胞株,造模前一天将其换上新鲜培养液,造模当天用平衡盐溶液PBS制成含0.5×108个/mL细胞悬液浓度(含细胞1×106个)的单细胞悬液。小鼠腹腔注射戊巴比妥钠(40 mg/kg)进行麻醉,用1 mL注射器针头在麻醉后的小鼠左侧股骨处穿刺钻孔,进针深约3~4 mm,感到有阻力时停止进针,此时慢慢推注肿瘤细胞悬液。注射完毕后消毒伤口,将鼠放回笼中,饲养3周并严密观察。
1.3 分组与用药
将18只造模小鼠随机分为6组,每组3只,并于造模后第3天起给予药物干预,共用药5周,第6周全部处死。
模型对照组:生理盐水0.5 mL,2次/周×5周皮下注射;同时1 mL,1次/d×5周,灌胃。补肾方低剂量组:补肾方浸膏剂混悬液3 g/kg,1次/d×5周,灌胃。补肾方中剂量组:补肾方浸膏剂混悬液12 g/kg,1次/d×5周,灌胃。补肾方高剂量组:补肾方浸膏剂混悬液24 g/kg,1次/d×5周,灌胃。唑来膦酸盐组:唑来膦酸盐100 μg/kg,2次/周×5周皮下注射给药。补肾方(低)+唑来膦酸盐组:补肾方浸膏剂混悬液3 g/kg,1次/d×5周,灌胃。同时唑来膦酸盐100 μg/kg,2次/周×5周皮下注射给药。
1.4 观察指标及方法
1)组织病理切片:将固定好的股骨组织取出,经5%硝酸脱钙3 d,并冲水4 h后用苏木素染色15 min,淡氨水反蓝10 min,伊红染色1 min;再经过乙醇冲洗、脱水,二甲苯透明,中性树胶封片、烘干后显微镜下观察。
2)Western-Blot法检测OPG,RANKL,IL-6蛋白的表达:提取组织总蛋白,加入电泳裂解缓冲液,取20 g变性裂解蛋白进行聚丙烯酰胺凝胶电泳,然后电转移至硝酸纤维素膜,经封闭后,加入OPG,RANKL,IL-6相应一抗,后经室温下孵育、摇洗、AP标记的二抗孵育,显色观察。
1.5 统计学方法
采用 SPSS19.0 统计学软件进行数据收集及分析处理,计量资料以t检验比较,计数资料采用χ2检验,P<0.05差异有统计学意义。
2 结果
2.1 各组组织病理切片比较
正常组小鼠骨髓腔内为正常的骨髓细胞,骨小梁和骨皮质是完好的,骨及骨髓造血组织未见明显病理性改变,见图1。模型组小鼠病理图片显示骨皮质表面大部分被肿瘤细胞侵蚀破坏,骨髓腔内骨小梁被严重破坏,骨髓腔内造血细胞部分坏死,结构模糊不清(+++),见图2。唑来膦酸组及补肾方中剂量、补肾方(低)+唑来膦酸盐组小鼠病理:骨皮质完整结构清晰,骨髓腔内骨小梁与造血细胞少量破坏(+),见图3。

图1 正常组小鼠骨组织肿瘤细胞密度(HE染色,×200)

图2 模型组小鼠骨组织肿瘤细胞密度(HE染色,×200)

图3 补肾方中剂量组小鼠骨组织肿瘤细胞密度(HE染色,×200)
2.2 各组骨转移部位OPG蛋白的表达比较
结果表明模型组转移癌OPG的表达较低,补肾方中剂量及补肾方(低)+唑来膦酸盐的OPG蛋白的表达增高,与模型组相比差异有统计学意义(P<0.05);补肾方低剂量组、补肾方高剂量组、唑来膦酸盐组OPG蛋白的表达与模型组相比差异无统计学意义(P>0.05)。上述结果表明补肾方中剂量、补肾方(低)+唑来膦酸盐上调OPG蛋白的表达,其他组无明显作用,见表1。
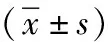
表1 各组骨转移部位OPG蛋白的表达
2.3 各组骨转移部位RANKL蛋白的表达比较
结果表明模型组转移癌RANKL的表达较高,补肾方高剂量组RANKL蛋白的表达降低,与模型组差异有统计学意义(P<0.01);补肾方中剂量组、唑来膦酸盐组及补肾方(低)+唑来膦酸盐组RANKL蛋白的表达降低,与模型组差异有统计学意义(P<0.05);补肾方低剂量组RANKL蛋白的表达与模型组差异无统计学意义(P>0.05)。上述结果表明补肾方高剂量、补肾方中剂量、唑来膦酸盐及补肾方(低)+唑来膦酸盐下调RANKLE蛋白的表达,补肾方低剂量无明显作用,见表2。
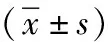
表2 各组骨转移部位RANKL蛋白的表达
2.4 各组骨转移部位IL-6蛋白的表达比较
结果表明模型组转移癌IL-6的表达较高,补肾方中剂量组及补肾方高剂量组IL-6蛋白的表达降低,与模型组差异有统计学意义(P<0.01);唑来膦酸盐组及补肾方(低)+唑来膦酸盐组IL-6蛋白的表达降低,与模型组差异有统计学意义(P<0.05);补肾方低剂量组IL-6蛋白的表达与模型组差异无统计学意义(P>0.05)。上述结果表明补肾方中剂量组、补肾方高剂量组、唑来膦酸盐组及补肾方(低)+唑来膦酸盐组下调IL-6蛋白的表达,补肾方低剂量无明显作用,见表3。
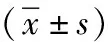
表3 各组骨转移部位IL-6蛋白的表达
3 讨论
中医学上“骨疽”“骨蚀”“骨瘤”等词多用来描述恶性肿瘤骨转移[7]。肺癌骨转移多发生在疾病的晚期,主要表现在溶骨性骨破坏方面[8]。肺癌骨转移患者体质差,病程绵长,多伤及肾脏,导致肾中精气耗损,《外科枢要》记载:“若劳伤肾水,不能荣骨而为肿瘤……名为骨瘤,随气凝滞,皆因脏腑受伤,气血和违。”[9-10]中医学认为肾藏精,主骨生髓。肾精亏虚,筋骨失养,肿瘤骨转移的根本原因在于肾精亏虚、痰瘀阻络,故而治疗常以补肾养精、散结通络解毒为主[11-12]。
正常生理情况下,成骨细胞引起的骨形成和破骨细胞引起的骨吸收,两者共同维持骨的代谢平衡[13]。当发生肿瘤骨转移时,骨骼细胞损伤、骨质被破坏,不仅导致大量钙释放至血,还会引起磷酸盐沉积,血清碱性磷酸酶增高,最终形成高钙血症、高磷酸血症[14-15]。有研究发现,采用补肾方治疗骨转移可以延缓骨转移进展,缓解症状,与中医之“肾生髓”的理论相贴切[16]。补肾方中重用骨碎补、淫羊藿、女贞子、黄精等填精生髓,鳖甲、蜂房软坚散结,干蟾皮、山慈菇解毒散结,自然铜、延胡索散结止痛,诸药合用,补肾精,壮骨髓,散瘀结[17]。
RANKL/RANK/OPG系统被认为是调节破骨细胞和骨吸收的重要因子[18]。OPG可抑制破骨细胞分化、抑制成熟破骨细胞活性、诱导成熟破骨细胞凋亡,RANKL能直接启动破骨细胞前体细胞或破骨细胞细胞内信号传导过程,维持破骨细胞活性;破骨细胞表面的RANK是RANKL刺激破骨细胞分化、成熟的唯一靶受体;IL-6可诱导破骨细胞分化,从而促进肿瘤细胞的生长和溶骨性骨破坏[19-20]。本研究发现:补肾方中剂量、补肾方(低)+唑来膦酸盐上调OPG蛋白的表达,其他组无明显作用;补肾方高剂量、补肾方中剂量、唑来膦酸盐及补肾方(低)+唑来膦酸盐下调RANKLE蛋白的表达,补肾方低剂量无明显作用;补肾方中剂量、补肾方高剂量、唑来膦酸盐及补肾方(低)+唑来膦酸盐下调IL-6蛋白的表达,补肾方低剂量无明显作用。上述结果提示:补肾方可能通过增加OPG蛋白的表达,从而抑制破骨细胞活性,抑制肺腺癌细胞的骨转移;同时,还可能通过抑制RANKL和IL-6的表达从而抑制肿瘤组织对骨质的溶骨性破坏。
综上所述,中医补肾法通过增加OPG蛋白的表达、抑制RANKL和IL-6的表达,最终达到抗肿瘤骨转移的作用,值得临床上进一步研究。

