集胞藻PCC6803中基因slr0681功能初步研究
崔晓艳 钟轲 耿耘 宣宁 孙秀芹 牛旭东 康佳 陈高

摘要:类胡萝卜素是人体内维生素A的主要来源,具有抗氧化、免疫调节、抗癌等作用。前期初步推测集胞藻PCC6803中slr0681基因在类胡萝卜素代谢中有重要作用。本研究利用同源重组方法构建了slr0681基因敲除突变株Δslr0681,研究了突变株与野生型在高盐胁迫条件下叶绿素a和类胡萝卜素含量变化以及光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)相关基因表达情况。结果表明,高盐胁迫下,突变株比野生型更具生命活力;高盐胁迫下Δslr0681中类胡萝卜素和叶绿素a含量高于野生型;PSⅠ中psaA、psaB、psaL和PSⅡ中psbB、psbD基因的相对表达量较野生型分别增加3.4、1.9、1.5倍和2.1、1.6倍。以上结果表明,slr0681基因对于集胞藻类胡萝卜素代谢有重要作用,并且在高盐胁迫条件下影响更为突出。本研究为后续利用合成生物学策略提高微藻类胡萝卜素代谢奠定了基础。
关键词:集胞藻PCC6803;slr0681基因;类胡萝卜素;高盐胁迫;光系统
中图分类号:Q949.22:Q78 文献标识号:A 文章编号:1001-4942(2021)12-0001-07
集胞藻PCC6803(以下简称集胞藻)是一种单细胞蓝藻,有天然的外源DNA转化系统,具有遗传背景清晰、表达外源产物不形成包含体等优点[1],是理想的蓝藻基因工程受体。
类胡萝卜素在动物和人体中发挥着重要的作用,如预防疾病、提高机体免疫力、维持动物正常生长与繁殖等。类胡萝卜素是一类脂溶性的类异戊二烯化合物,也是进行光合作用、由生物产生的亲脂性色素[2],其可通过猝灭活性氧防止氧化,并且可在光合生物中收集光能[2,3],在许多生物中起着核心作用。
近年来,类胡萝卜素在医药、食品、保健品、化妆品以及饲料行业中得到了广泛应用[4]。随着人们健康意识的不断加强,从天然原料中获得的类胡萝卜素受到越来越多消费者的欢迎。目前,类胡萝卜素的生产方式主要有化学合成、天然提取与生物合成3种。相对于前两种方式,微生物合成的方式安全、天然,是健康可行的生产类胡萝卜素方式。
蓝藻中色素的积累受外界环境的影响,如光照、营养盐、温度以及酸度[5-8]等。集胞藻是一种中等耐盐的淡水蓝细菌,可在短时间内耐受高达1.2mol/L的氯化钠。培养基中加入高盐后可导致集胞藻细胞内自由水减少,且浓度增加的无机离子对细胞的新陈代谢产生毒性作用。蓝藻细胞可使用“盐外排策略”适应高盐环境。首先蓝藻细胞迅速失水和收缩;之后,Na+和Cl-进入细胞降低水势,水回流到细胞中;细胞中高Na+含量会抑制细胞中的各种生理反应,特别是光合作用和翻译,将有毒的Na+交換为毒性较小的K+可以重新激活光合作用,并开始合成兼容的溶质;蓝藻的主要相容溶质是葡萄糖基甘油,积累葡萄糖基甘油允许多余的离子流出,然后基因表达再次被激活,最后基因表达的变化导致完全适应高盐环境[9]。
地球上淡水资源有限,所以未来生物技术改造的蓝藻大规模培养必须依赖海水,因而理想的菌株至少能在海水中生长,且有更高的耐盐性。集胞藻PCC6803在高盐条件下有较大比例的转运与结合相关的基因上调[10],slr0681基因编码钠钙转运蛋白,因此研究在高盐胁迫条件下敲除该基因的突变株Δslr0681的生化指标尤为重要。
本试验利用同源重组方法构建了slr0681基因敲除突变株Δslr0681,研究了突变株在高盐胁迫下叶绿素和类胡萝卜素的变化及光系统相关基因的表达情况,以期为促进微藻在生物能源上的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 集胞藻PCC6803、质粒pBluescriptsk(-)为本实验室保存,大肠杆菌DH5α购自北京全式金生物技术有限公司。
1.1.2 主要试剂 DNA凝胶回收试剂盒、质粒提取试剂盒、EvoM-MLV反转录试剂盒购自AG公司;限制性内切酶、T4DNA连接酶购自TaKaRa公司;ChamQUniversalSYBRMasterMixes购自Vazyme公司。
1.2 培养条件
集胞藻使用BG-11培养基培养,培养条件为30℃、光照强度40μmol/(m2·s),连续光照静置培养[11],采用SP-723型可见分光光度计在730nm处测定OD值(OD730),确定细胞密度。DH5α使用LB培养基于37℃进行培养。
1.3 Δslr0681突变株的获得
1.3.1 失活质粒构建 通过PCR方法用slr0681-1-F(5′GCTTTGCTGGATGTGCCCT3′)/slr0681-1-BamHⅠ-R(5′GGTGGAAAATAGGATCCGTTTGCTCTCAATAAGC3′)、slr0681-2-BamH Ⅰ -F(5′AACGGATCCTATTTTCCACCAAAGCCCATT3′)/slr0681-2-R(5′TTCGGCATGGGCTAACAA3′)引物从集胞藻基因组DNA中分别扩增得到slr0681基因的上下游片段。将两基因片段连接到T3克隆载体后转化至大肠杆菌DH5α,筛选阳性克隆并测序,制得slr0681-T3质粒。将slr0681-T3质粒用BamHⅠ酶切,回收载体片段;用BamHⅠ酶切pBluescriptsk(-)载体,回收卡那霉素抗性片段。用T4连接酶连接载体片段和卡那霉素抗性片段后转化至大肠杆菌DH5α。通过筛选阳性克隆,获得集胞藻slr0681基因敲除载体,命名为pΔslr0681。
1.3.2 集胞藻转化及突变株筛选和鉴定 用质粒pΔslr0681转化集胞藻,具体步骤参考Liu等[12]的方法。集胞藻转化子在含有50μg/mL卡那霉素的BG-11固体培养基中长出后,转到含有50μg/mL卡那霉素的液体培养基中传代培养,并逐步提高卡那霉素浓度至200μg/mL。PCR鉴定卡那霉素抗性基因的插入,直至所有野生型拷贝完全消失,分别以集胞藻和突变株DNA为模板,以slr0681-F(5′ATGATGACTTGGTTGACC3′)和slr0681 -R(5′TTAGATTCCGGTATCGTT3′)为引物进行扩增,检测条带大小,获得突变株Δslr0681。
1.4 高盐胁迫处理
将野生型集胞藻(WT)和突变株Δslr0681在含0.51mol/LNaCl(3%,W/V)的BG-11液体培养基中培养,OD730值为0.2时,取100mL分装到250mL三角瓶中。每隔24h观察不同处理间的表型变化。
1.5 集胞藻生长曲线及叶绿素a和類胡萝卜素含量测定
将WT和Δslr0681分别接种于正常和高盐BG-11液体培养基中,调节OD730值至0.2,于30℃、光照强度40μmol(m2·s)条件下培养,分别于0、1、2、3、4、5、6、7、8d取样,通过每天测定OD730值监测其生长情况。
每个样品另取2mL,于13000r/min离心10min,沉淀用1mLN,N-二甲基甲酰胺溶液重悬,吸打混匀,于13000r/min离心10min,取上清液用分光光度计分别测定OD461、OD625、OD664值,并根据公式计算类胡萝卜素和叶绿素a含量。
类胡萝卜素(μg/mL) =(OD461 -0.046×OD664)×4 ;
叶绿素a(μg/mL)=12.1×OD664 -0.17×OD625 。
1.6 类胡萝卜素的提取及HPLC分析
取各时期WT和Δslr0681样品各2mL,于13000r/min离心10min,藻沉淀用1mL甲醇溶液悬浮,吸打混匀以萃取细胞色素,然后13000r/min离心10min,取上清液用高效液相色谱法(HPLC)检测分析类胡萝卜素组分。所用色谱柱型号为AcclaimC-18反相柱120A(5μm,4.6mm×250mm),具体步骤参考Liu等[12]的方法。
1.7 qRT-PCR分析
取对数生长期(OD730值为0.6)集胞藻50mL,7000r/min离心10min,收集沉淀,液氮中研磨,用Trizol法提取RNA[12]。电泳检测RNA片段完整性,用核酸蛋白测定仪检测RNA浓度及纯度。用EvoM-MLV反转录试剂盒合成cDNA。以cDNA为模板,以集胞藻rnpB为内参基因,对光系统PSⅠ中psaA、psaB、psaL基因以及光系统PSⅡ 中psbA2、psbD、psbB基因进行表达量分析[13]。所用荧光染料为ChamQUniversalSYBRMasterMixes,系统为ABI7500实时PCR,使用2-△△Ct方法分析实时定量PCR数据。
1.8 数据处理
采用MicrosoftExcel2010软件进行数据整理,所有数据均为3次试验平均值,使用Origin软件作图。
2 结果与分析
2.1 slr0681基因的敲除
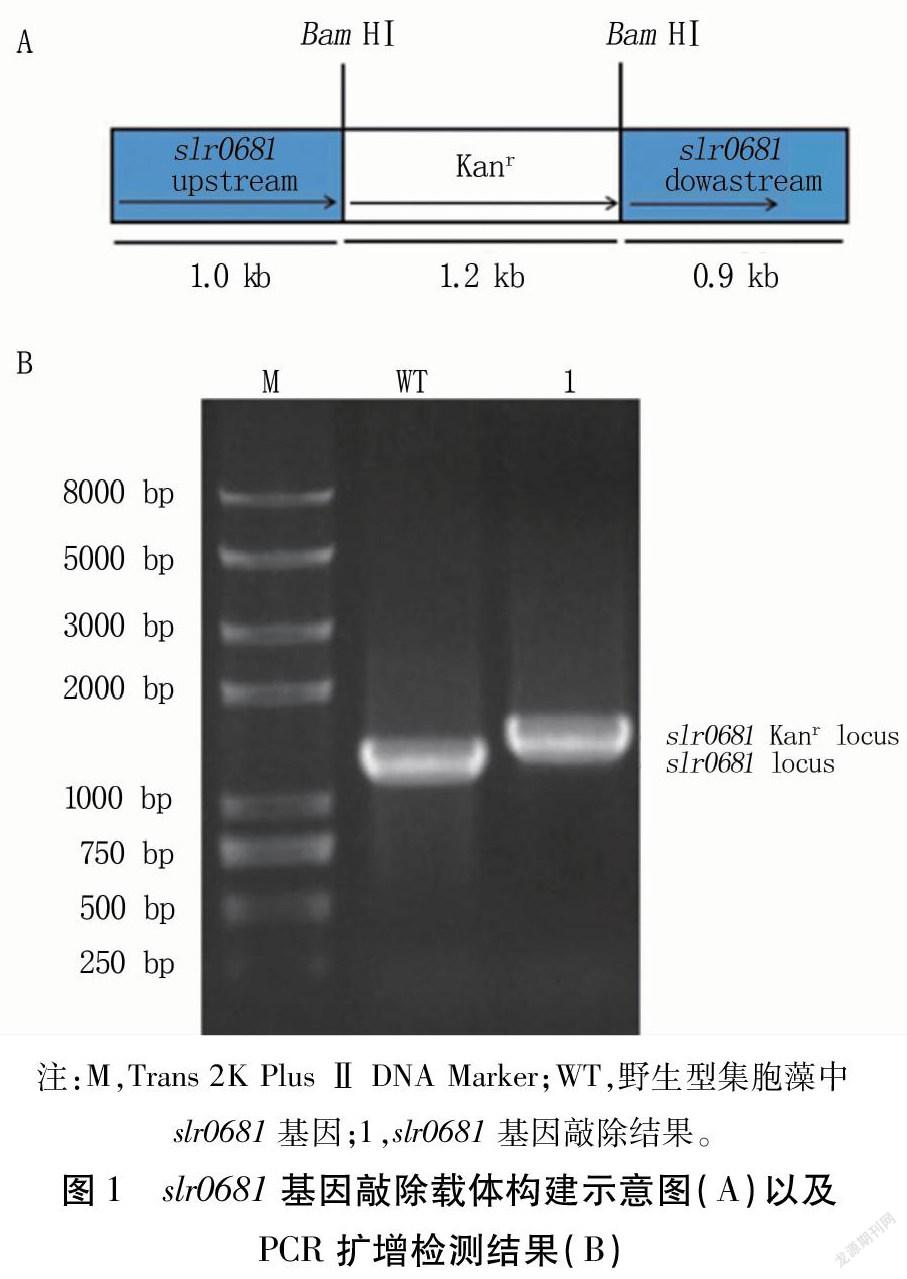
在slr0681基因中加入BamHⅠ酶切位点,与卡那霉素抗性片段连接,构建slr0681基因定向敲除载体(图1A)。
以集胞藻为模板,以slr0681-F和slr0681-R为引物扩增得到slr0681基因片段(1.2kb)。以Δslr0681DNA为模板,以相同引物对扩增,得到约1.4kb左右的片段,并且在1.2kb处没有片段(图1B)。表明卡纳霉素抗性片段已经以双交换方式整合到集胞藻染色体上,突变株Δslr0681构建成功。
2.2 WT和Δslr0681在高盐胁迫条件下的生长情况
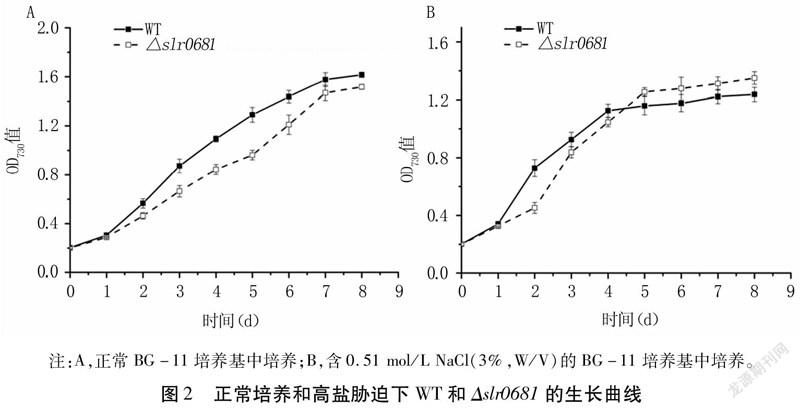
正常培养条件下,Δslr0681生长速率均低于WT,在第5d二者浓度差达到最大,但第6d后两者浓度差逐渐变小(图2A)。高盐胁迫条件下,从第5d开始突变株的浓度均高于WT(图2B),说明敲除slr0681基因在一定程度上影响了藻株的生长。WT在高盐胁迫初期适应能力更强,Δslr0681生长有较长的迟缓期,但5d后生命活力高于WT,这可能是由于slr0681基因的缺失导致更多的有毒Na+排出,增强了集胞藻的耐盐性,从而促进了高盐胁迫下Δslr0681的生长。
2.3 WT和Δslr0681在高盐胁迫条件下的表型变化
高盐胁迫下WT和Δslr0681相较于正常培养条件下的生长处于弱势状态。正常条件下培养的WT和Δslr0681颜色无明显差异,而在高盐胁迫下培养到第6d时,WT和Δslr0681颜色差异最为明显,Δslr0681比WT更具生命活力(图3)。表明slr0681基因敲除对于藻株的生长产生了影响。
2.4 WT和Δslr0681在高盐胁迫条件下的类胡萝卜素和叶绿素a含量变化
由图4可知,在正常培养和高盐胁迫培养的前7d,WT和Δslr0681中类胡萝卜素含量随着藻株的生长不断增加,第8d则降低。正常培养条件下,WT的类胡萝卜素含量均高于Δslr0681,第5d时差异明显,差值达1.23μg/mL;第6~8d差异逐渐减小(图4A)。高盐胁迫条件下,Δslr0681从第5d开始类胡萝卜素含量明显高于WT,第7d差值最大,为0.356μg/mL(图4B)。
正常培养条件下,WT和Δslr0681的叶绿素a含量随培养时间延长逐渐增加,且二者差异不明显(图5A)。高盐胁迫条件下,WT和Δslr0681的叶绿素a含量呈先升高后降低趋势,在第4d差值最大,为1.40μg/mL(图5B)。
利用HPLC法检测WT和Δslr0681中类胡萝卜素各组分相对含量,发现在高盐胁迫条件下,与WT相比,Δslr0681中海胆酮含量积累最为突出。这可能是因为slr0681基因的敲除增强了藻株的耐盐性,促进了高盐胁迫下Δslr0681的生长,从而增加了类胡萝卜素和叶绿素a的含量;slr0681基因的敲除可能会间接影响类胡萝卜素代谢途径中某些基因的表达,促进海胆酮积累。
2.5 WT和Δslr0681光系统相关基因表达量
类胡萝卜素中β-胡萝卜素是光系统组分的核心,本试验对光系统相关基因的表达量进行qRT-PCR分析,结果表明,正常培养条件下,Δslr0681PSⅠ中psaA、psaB、psaL基因表达量比WT低,PSⅡ中psbA2、psbD、psbB基因表达量与WT差异不大(图6A)。高盐胁迫条件下,Δslr0681中psaA、psaB、psaL、psbB、psbD基因的表达量分别是WT的3.4、1.9、1.5、2.1、1.6倍(图6B)。这可能是因为slr0681基因影响藻株中某个或某些基因的表达,使PSⅠ和PSⅡ中相关基因的表达发生变化。
3 讨论与结论
蓝藻是藻类中最早能稳定表达外源基因的种类[14,15]。集胞藻是研究代谢调控的模式生物,也是用合成生物学改造构建细胞工厂的优良底盘[16,17]。Koch等[18]对集胞藻Slr0058蛋白的研究结果表明,Slr0058是一种参与PHB(聚-β-羟丁酸)形成的新型调节蛋白,在氮胁迫下Slr0058在PHB形成中起促进作用,该研究有助于更好地了解集胞藻的PHB代谢以及PHB的可持续工业生产;Mohamed等[19]研究了集胞藻中Sll0254编码产蓝藻叶黄素的双功能番茄红素环化酶/双加氧酶,结果表明Sll0254基因不仅影响藻株生长,还具有番茄红素环化酶和双加氧酶活性,为微藻类胡萝卜素代谢研究提供了理论基础。本研究前期初步推测集胞藻中slr0681基因在类胡萝卜素代谢中有重要作用。本试验利用同源重组方法构建了slr0681基因敲除突变株Δslr0681,结果表明slr0681基因的敲除影响了藻株的生长、类胡萝卜素的合成以及光系统相关基因的表达。由于藻类生长和类胡萝卜素代谢基因调控的错综复杂性,本研究还无法判断slr0681基因的具体作用位置。
集胞藻中色素的积累受光照、氮浓度以及盐浓度等外界环境的影响[1,20,21]。Li等[22]研究了一种镁转运体slr1216参与集胞藻的钠耐受性,表明转运体slr1216可能通过影响细胞内糖基甘油的表达参与耐盐调节,这为集胞藻在高盐胁迫条件下生长提供了理论指导。利用蓝藻抗盐机制可构建对盐耐受能力更高的菌株从而进行生物燃料的大规模生产。然而,目前的研究结果并不能全面阐述蓝藻对盐胁迫的反应机理,因此要想最大限度提高蓝藻对盐的耐受性,从而实现高浓度盐下的大规模工业化培养,还需要进行深入的研究[22]。
slr0681是一种钠钙转运蛋白,但作用位置尚不清楚。本研究利用同源重组技术构建了slr0681基因敲除突变藻株,得出slr0681基因为抗盐调节因子,与类胡萝卜素代谢相关,能够影响光系统中相关基因的表达,为我们进一步研究该基因的具体性质和逆境条件下的具体功能奠定了基础。

