microRNA在脊髓损伤修复机制中的研究进展
杜文君 张弢
1天津市人民医院脊柱中心 300121;2天津医院骨科 300211
0 引 言
脊髓损伤(spinal cord injury,SCI)在临床上十分常见,每年大约导致180 000 例患者发生永久性躯体功能障碍[1-3]。最初的损伤往往可引发一系列复杂的继发级联病理生理反应包括神经系统本身、血管和免疫系统,这些继发的病理生理改变在很大程度上决定了脊髓损伤患者的预后[4]。目前,对于SCI 治疗的重点是控制继发损伤并促进神经再生[5]。然而,当前SCI 的治疗效果并不理想,其主要原因为对SCI 损伤的病生理分子机制并未完全清楚[6-8]。因此,SCI 相关分子机制理论研究进展是提高SCI 患者治疗效果的重要基础[9-11]。
近年来,有研究者提出,继发损伤和级联反应过程在很大程度上受微小RNA(microRNA,miRNA)的调控。miRNA 是一类大小约为22 nt 的非编码RNA,被认为参与包括生长发育、肿瘤、损伤修复等多种人体病理生理过程。近年来,关于miRNA 与SCI 的研究较多,并证实miRNA 在多方面影响SCI 的病理生理过程及预后,包括细胞凋亡、炎症反应、胶质瘢痕形成及神经再生等(图1)。本文对microRNA在脊髓损伤修复机制中的研究进展进行简要综述。
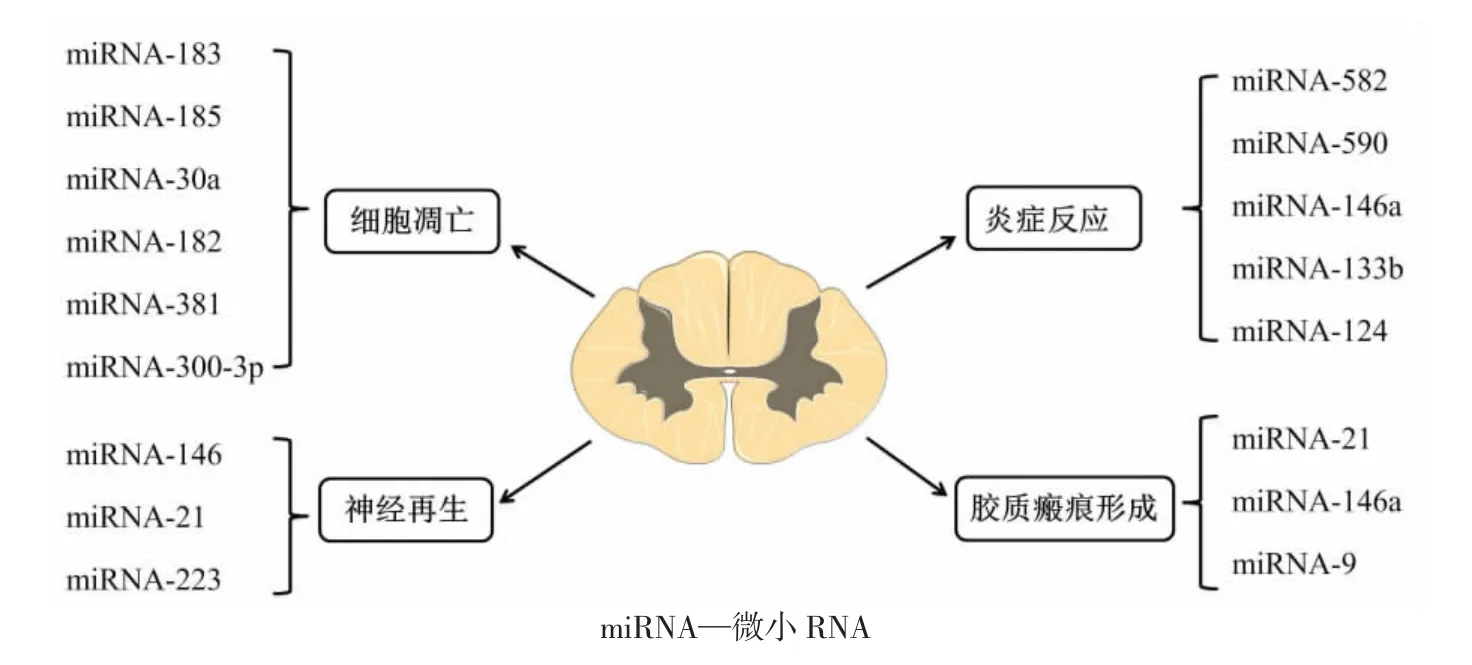
图1 脊髓损伤修复机制及其涉及的microRNA
1 microRNA 的产生及生物学功能
近年来研究发现,miRNA 具有参与人体中代谢、凋亡及损伤修复等多种分子功能[12-13]。miRNA 始于pri-microRNA(PrimarymicroRNA)转录本(step 1);这个70-100 nt 的发卡RNAs(pri-microRNA)经Drosha加工为pre-microRNA(Precursor microRNA)(step 2);pre-microRNA 被送出细胞核(step 3),进而被Dicer酶消化为21-25 nt 的microRNA(step 4)[14];这个阶段的miRNA 可结合RNA 诱导沉默复合体(RISC)并与靶标mRNA 互补并列(step5-6)[15];miRNA 和靶序列的互补程度决定了靶基因mRNA 或在翻译水平被部分抑制或者完全断裂(step 7)。近有报道表明,miRNA 也作用于5′-UTR 区, 需要指出的是miRNA与3′-UTR 和5′-UTR 的结合是不完全互补的,但具体的机制仍不明确。
2 脊髓损伤后差异表达基因及潜在功能
越来越多的证据表明,miRNA 在脊髓中表达水平普遍较高,脊髓损伤(SCI)大鼠模型中,miRNA 表达谱系发生明显改变,其中约有60 个以上的miRNA呈现上调或下调表达[16]。在另一项研究中,包括miRNA-124、miRNA-129 和miRNA-1 在内的32 种miRNA 显著下调,但miRNA-21 在挫伤大鼠脊髓的损伤部位显著上调[17]。有趣的是,在小鼠SCI 模型中,miRNA-223 的表达一直维持上调至SCI 后3 d。然而,从损伤后第1 天到第7 天,miRNA-124a 的表达明显下降[18]。因此认为,miRNA 表达谱系改变(包括上调或下调表达)在SCI 的大鼠或小鼠模型中是普遍存储。生物信息学分析表明,SCI 后差异表达的miRNA 的潜在靶点包括参与SCI 发病机制的基因,如炎症、氧化应激、细胞凋亡和神经再生等。因此,这些脊髓损伤后差异表达的基因,可能是作为SCI 损伤诊断、预后、分子机制及治疗的潜在重要靶点。SCI后差异表达的miRNA 中,miRNA-21 和miRNA-146a已被证明可通过减少细胞凋亡和星形胶质细胞对损伤的反应来促进神经功能修复,是SCI 后的保护因子[19-21]。然而miRNA-181a、miRNA-411、miRNA-99a、miRNA-133b 和miRNA-15b 可增强损伤的炎症反应,是SCI 后的损伤因子[22]。此外,其他一些研究表明,miRNA 还可调节SCI 后的内源性抗氧化系统,并通过靶向抗氧化酶防御系统超氧化物歧化酶(SOD)来调节再髓鞘化。因此,miRNA 已被认为是SCI 病理过程的生物标志物以及治疗靶点。脊髓损伤后差异表达miRNA 及功能见表1。

表1 脊髓损伤后差异表达miRNA 靶基因及功能
3 MicroRNA 与脊髓损伤后胶质瘢痕形成
星形胶质细胞是中枢神经系统中最丰富的细胞类型,占胶质细胞总数的50%以上[23]。脊髓损伤后,星形胶质细胞可通过增殖(星形细胞增多)和肥大(星形胶质细胞增生)而被激活。大量研究表明,星形胶质增生可通过调节炎症反应和星形胶质细胞增生影响瘢痕组织形成[24-25]。星形胶质增生、髓鞘碎片和瘢痕组织在中枢神经系统损伤后轴突再生失败的过程中起着重要作用,这可能是创伤修复所必需的,但也能抑制轴突再生[25-26]。因此,通过调节损伤部位周围星形胶质细胞的增殖和肥大程度来控制胶质瘢痕的形成是一种潜在的治疗方法。
靶向星形胶质细胞增生也有可能促进脊髓损伤后轴突再生,这一点已被一些研究结果所证实。例如,阻断脊髓损伤后的反应性胶质增生,可在一定程度上促进功能恢复,促进轴突再生。星形胶质增生抑制也可导致病变部位轴突密度增加。最近的一项研究结果表明,星形胶质细胞瘢痕的形成有助于而不是阻止中枢神经系统轴突的再生[27]。
星形胶质细胞增生是由一些众所周知的途径调节的,如cAMP、STAT3、NF-κB、Rho 激酶、JNK 和mTOR[28]。如星形胶质细胞的反应性依赖于RhoA 信号通路的活性,并且可通过靶向RhoA 来降低星形细胞的反应性[29]。据报道,由于胶质瘢痕的形成,可致星形胶质细胞活性增强[30]。另外,PTEN 基因可能通过P13K/Akt/mTOR 信号通路在体内反应性星形胶质增生的早期起作用[31]。同时,JAGG-1 可通过调节NF-κB 和JAK/STAT/SOCS3 信号通路来调节星形胶质细胞的激活途径[32-34]。近年来,新的证据表明miRNA 参与了星形胶质细胞增生的主要信号通路。如miRNA-582 和miRNA-590 靶向NF-κB 信号通路;miRNA-146a、miRNA-133b 和miRNA-124 可 直接调节RhoA 信号通路[35]。虽然缺乏直接证据,但以上发现表明这些miRNA 可能通过调节这些重要途径参与脊髓损伤的过程或恢复。
4 microRNA 与脊髓损伤后细胞凋亡
细胞凋亡或程序性细胞死亡是脊髓损伤的一个标志。已有研究证实,众多miRAN 参与了脊髓损伤后的细胞凋亡过程。在参与这一过程的miRNA中,miRNA-21 被证明是脊髓损伤后重要的差异表达miRNA 之一[36]。miRNA-21 是Fas 配体基因FASLG和PTEN 的抑制因子,两者均促进细胞凋亡[37-38];而上调miRNA-21 表达后,能够明显抑制FASLG 和PTEN的表达从而抑制凋亡[39-41]。Strickland 等[17]证明,脊髓损伤后4 d miRNA-21 表达显著上调,但到第14 天才相对下调。这种效应解释了损伤后4~10 d 从肥大到增生的转变。尽管下调miRNA-21 似乎对星形胶质细胞增生具有抑制作用,但对神经元细胞死亡却具有促进作用。与miRNA-21 相似,miRNA-146a 具有抗凋亡和抗炎作用。除miRNA-21 和miRNA-146a外,miRNA-9 可通过直接调节单核细胞趋化蛋白诱导蛋白1 基因(MCPIP1)来控制细胞凋亡,MCPIP1是已知的促凋亡和巨噬细胞激活基因[42-43]。在脊髓损伤后1~7 d,miRNA-9 在腹角运动神经元中显著下调,而MCPIP1 在损伤部位上调,这一假设已得到证实[44]。然而,到第7 天,miRNA-9 表达增加,从而抑制MCPIP1 的表达。同时,MCPIP1 还促进胶质纤维酸性蛋白(GFAP)表达,在星形胶质细胞增生期间可见反应性星形胶质细胞表达[45]。因此,miRNA-9 似乎对脊髓损伤具有双峰效应,因此在急性期下调miRNA-9 可使GFAP 表达和星形胶质细胞活化,而miRNA-9 在第7 天上调则表明腹侧运动角细胞具有神经保护作用。考虑miRNA-21 在急性脊髓损伤中具有很强的抗凋亡作用,miRNA-9 可能与miRNA-21 相反,因此一个miRNA-21 的下调可被另一个的上调所抵消。为阐明miRNA-9 与miRNA-21之间的关系,还需进一步的研究来观察miRNA-9 和miRNA-21 在7 d 后的表达。
一般情况下,脊髓损伤后的细胞凋亡是由靶向促凋亡基因(如Caspase 家族基因)的miRNA 下调,或靶向抗凋亡基因(如BCL2 或MYC)的miRNA 上调引起的[37,46-55]。这些调节作用为潜在的治疗策略提供了多种途径,包括调节促凋亡和抗凋亡miRNA 的平衡。研究表明,casp21-15b 和casp21-15b 是调节凋亡的重要因子。已有研究认为,脊髓损伤后可通过miRNA-21 对v-akt 小鼠胸腺瘤病毒同源癌基因1同源基因AKT1 和磷脂酰肌醇三磷酸的影响来达到抗凋亡作用[56]。另一种潜在的治疗策略是创伤后低温和反义沉默。Truettner 等[57]研究证明,特定的miRNA 对脑损伤中的创伤后低温敏感,结果会降低其凋亡效应。
5 microRNA 脊髓损伤后炎症反应
在脊髓损伤的情况下,炎症往往会造成组织进一步的损伤和细胞过度死亡。星形胶质细胞增生的主要功能之一是减少病变部位内及周围的炎症反应,以减少继发性损伤在创伤起始点以外的扩散。在脊髓损伤中,帮助调节机体炎症过程的各种miRNA 的表达发生改变,是潜在治疗的重要靶点。miRNA-146a 与miRNA-21 密切相关,可参与星形胶质细胞肥大向增生的转变。研究表明,脊髓损伤时miRNA-146a 在脊髓星形胶质细胞中高表达。其靶点是促炎酶环氧化酶2(COX-2)和由基因IL1B 和IL6编码的蛋白质[58-59]。此外,研究还表明miRNA-146a在巨噬细胞中通过白细胞介素1 受体相关激酶1基因(IRAK1)和肿瘤坏死因子受体相关因子6 基因(TRAF6)与转录因子NF-κB 进行循环反馈[58]。巨噬细胞中NF-κB 途径的激活上调miRNA-146a,导致IRAK1 和TRAF6 途径成分的下调[60]。然而,尽管一些关于增生性胶质瘢痕的研究将功能缺陷归因于miRNA-146a 的过度表达,但有其他研究认为miRNA-146a 在预防炎症的有害影响方面具有重要价值[61-62]。因此,尽管miRNA-146a 在急性抗炎治疗方案中是有益的,但miRNA-146a 在脊髓损伤亚急性期的过度表达似乎变得有害。Notch-1 基因可导致星形胶质细胞恶性增殖,但miRNA-146 对其有抑制作用。另一个miRNA,即miRNA-223 在中性粒细胞聚集增加的区域过度表达,这表明miRNA-223 与中性粒细胞归巢有关。这一过程与肥大的星形胶质细胞相反,后者试图在星形胶质细胞增生的亚急性期清除炎症细胞的中央发生病变[63]。miRNA-223 的表达具有时间依赖性。脊髓损伤后12 h 和3 d 出现两次高峰,之后明显降低。这与脊髓损伤后1 d 中性粒细胞表达高峰相一致,随后在脊髓损伤后5 d 出现下调。上述研究均表明,众多miRNA 在脊髓损伤后的炎症反应中发挥重要作用。
6 microRNA 与脊髓损伤后神经再生
脊髓损伤后,神经元损伤为不可逆。然而,miRNA为实现神经元再生修复提供了一条途径。Liu 等[64]进行的研究认为,当脊髓发生损伤后,机体试图通过miRNA 的作用,通过表达少数基因来保护神经元并刺激神经元的生长、再生和再髓鞘化。脑源性神经营养因子基因(BDNF)和细胞分裂周期42 基因(CDC42)等都是积极影响脊髓损伤自我修复的基因。这些基因的表达与被认为是靶向它们的大量miRNA 成反比(BDNF 可受miRNA-183、miRNA-195、miRNA-30a、miRNA-182、miRNA-381、miRNA-300-3p和miRNA-325-5p 的影响);而CDC42 受miRNA-185、miRNA-329、miRNA-340-5p、miRNA-381 和miRNA-383的影响。此外,一些miRNA 被认为促进了这两个基因,这两组miRNA 之间的平衡可能在自我修复中起着关键作用。
在脊髓损伤中,miRNA-124 在损伤部位及其周围的前7 d 持续下调[65]。其他研究表明,miRNA-124通过下调巨噬细胞/小胶质细胞的表达来减轻中枢神经系统炎症,同时维持星形胶质细胞的表达,从而维持星形胶质瘢痕的抗炎作用[66]。因此,众多miRNA的生物学功能可能于脊髓损伤后神经再生有关,并有望成为脊髓损伤后治疗的潜在靶点并为研发药物提供依据。
7 展 望
脊髓损伤修复机制复杂,多种因子及损伤修复机制参与其中,包括炎症、细胞凋亡、ROS 形成和星形胶质细胞增生等。近年来,众多研究已经证实miRNA在脊髓损伤和修复中的重要作用及其可能的分子机制。不同miRAN 在脊髓损伤中的作用是不同的,有些miRNA 可能起到抑制损伤、促进修复的作用,同时也有一些miRNA 则起到相反的作用。筛选并鉴别这些在脊髓损伤后差异表达及差异功能的miRNA 有望成为促进脊髓损伤康复及治疗的靶点。
利益冲突所有作者均声明不存在利益冲突

