肉豆蔻酰矢车菊素-3-O-葡萄糖苷在混合溶剂体系中的酶法合成
张萍玲,赵振刚
(华南理工大学食品科学与工程学院,广东广州 510640)
花色苷是植物中的主要呈色物质,广泛存在于草莓、黑米、红加伦、黑豆、黑加伦、紫玉米等被子植物表皮细胞液泡中[1]。因其具有典型的C6-C3-C6骨架结构,一般被归为黄酮类化合物。作为一种天然食用色素,它不仅安全无毒、色彩鲜艳、资源丰富,而且具有一定的营养和药理作用,被公认为资源最为丰富的替代苯胺类煤焦合成色素的天然色素[2,3]。作为一种生物活性物质,它具有抗氧化[4]、抗癌[5]、抗衰老、抗炎抑菌[6]、提高视力[7]、预防心血管疾病[8]、修复和保护肝损伤、控制肥胖[9]、减轻糖尿病[10]等多种功能,在食品、医药、化妆品领域均有着巨大的应用潜力。但其结构不稳定,在贮藏与加工过程中易受外界环境,如pH、温度、光、酶、二氧化硫、金属离子、抗坏血酸等理化因子的影响产生分子聚合、异构和降解,从而失去原有的颜色[11,12]。在生理活性方面,由于花色苷的亲脂性低,不易透过磷脂双分子层的细胞膜到达靶向作用点,使得生理价值大大降低。故对花色苷进行结构修饰以提高它的稳定性及生理活性成为近几年学者的研究热点。
研究证明酰基化的花色苷比未酰基化的花色苷具有更强的稳定性。用脂肪酸对花色苷进行酰基化反应,可以降低花色苷在水溶性介质中的溶解性,通过疏水作用和空间位阻效应降低花色苷对介质中水和亚硫酸盐的亲核攻击的敏感性,防止花色苷分子变成无色的假碱基或查尔酮结构,从而增强花色苷的稳定性[13]。除此之外,用脂肪酸对花色苷进行酰基化,可以提高花色苷的亲脂性,有利于拓展他在脂溶性基质中的应用。另有研究发现,酰化的花色苷显示出了最高的细胞模拟膜的亲和力,这表明酰化后花色苷的生物利用度可以得到很大提高[14]。
矢车菊素-3-O-葡萄糖苷(C3G)是自然界中最为常见、分布最广的花色苷[15]。已有研究采用脂肪酸为酰基供体,通过酶法[16]或化学方法[17]对其进行酰基化修饰。酶催化C3G的直接酯化需要加入具有吸附作用的碱性物质分子筛以去除反应的副产物水,导致C3G的大量损失,而使用化学方法进行酰基化反应存在步骤繁琐的问题。有机溶剂是目前非水相酶催化应用和酶学研究最为广泛的体系[18]。C3G作为一种多羟基化合物具有强亲水性,在高极性有机溶剂中溶解度较高,但高极性有机溶剂可能通过剥夺酶分子表面微环境中的必需水导致酶的稳定性和催化活性降低[19],疏水性溶剂虽然可以较好得保持酶的活性,但C3G在疏水性溶剂中溶解度低[20],同样导致反应合成效率降低。混合溶剂由一定配比的疏水性溶剂和强极性溶剂互溶而成,通过改变各溶剂的配比可以改变反应介质的物理性质,从而调控酶在体系中的活性以及选择性[21]。
本研究用固定化脂肪酶Lipozyme 435为生物催化剂,以肉豆蔻酸甲酯为酰基供体,分别在单一有机溶剂和混合有机溶剂中对C3G进行酯交换反应,对酰基化产物的结构进行表征,并通过单因素实验和正交实验优化实验条件,为C3G的酰基化修饰及后续的活性研究提供参考依据。
1 材料与方法
1.1 原料与仪器
1.1.1 实验材料
矢车菊素-3-葡萄糖苷(HPLC≥98%)购自于四川省维克奇生物科技有限公司;固定化脂肪酶Lipozyme 435,购于诺维信(中国)生物技术有限公司;肉豆蔻酸甲酯为分析纯,购于上海麦克林;叔戊醇、叔丁醇、吡啶、乙腈、异辛烷、正己烷、石油醚等均为分析纯,购于上海阿拉丁。
1.1.2 主要仪器设备
CPA224S分析天平,赛多利斯科学仪器有限公司;Centrifuge 5424R台式高速冷冻离心机,Eppendorf公司;ZNCL-GS智能磁力搅拌器,爱博特科技有限公司;DU-730紫外-分光光度仪,Beckman Coulter公司;Waters 1525高效液相色谱仪,德祥科技有限公司;maXis Impact TOF-MS,美国布鲁克-道尔顿公司;1290 Infinity UHPLC,Agilent公司;1260 Infinity半制备高效液相,Aglient公司;Avanve III HD 600M超导核磁共振波谱仪,美国布鲁克-道尔顿公司。
1.2 试验方法
1.2.1 单一溶剂中C3G的酰基化反应
将反应用的磁力搅拌子及玻璃器皿在60 ℃烘箱中预先干燥24 h,将底物放置于干燥器中保持4 d以上,固定化脂肪酶与C3G放置于4 ℃冰箱保存。在2 mL的棕色血清瓶中加入1 mg C3G,以C3G/酰基供体摩尔比为1:150加入肉豆蔻酸甲酯,分别加入乙腈、吡啶、叔戊醇、叔丁醇使反应液总体积为1 mL,并加入Novezym 435酶(20 mg/mL),搅拌子。将棕色血清瓶放置于磁力搅拌锅中,以300 r/min的摇动速度、60 ℃下反应24 h。完成反应后,用离心管收集反应体系,于4 ℃,12000 r/min的条件下离心7 min,最后通过0.22 μm有机滤膜过滤除去脂肪酶和多余底物以终止反应。
1.2.2 混合溶剂中C3G的酰基化反应
按照1.2.1的方法,采用C3G与肉豆蔻酸甲酯的比例1:150,Lipozyme 435脂肪酶用量20 mg,反应温度60 ℃,反应时间24 h,以叔戊醇为主要反应溶剂,于体系中分别加入20%体积分数的异辛烷、石油醚、吡啶和正己烷进行反应。
1.2.3 混合溶剂的比例对酰基化反应的影响
按照1.2.2的方法,以叔戊醇为主要反应溶剂,于体系中分别加入20%、40%、60%、80%、100%体积分数的吡啶进行反应。
1.2.4 反应转化率和相对含量的测定
采用高效液相法测定C3G酰基化产物的生成,并通过峰面积进行转化率及相对含量的计算。高效液相色谱以0.1%三氟乙酸水作为流动相A,甲醇作为流动相B,按1 mL/min的流速进行洗脱,通过PDA检测器在双波长(280 nm和520 nm)下监测峰。流动相的洗脱程序如下:0~5 min,5~10% B;5~10 min,10%B;10~17 min,10~24% B;17~27 min,24~90% B;27~30 min,90% B;30~35 min,90~5% B;35~45 min,5% B。样品进样量为5 μL,分析柱Waters Xbridge C18(4.6×250 mm,5 μm),柱温保持在30 ℃。酰基化反应的转化率由峰面积比进行计算:

式中:T为C3G酰基化反应的转化率(%),A0为反应前液相色谱图中C3G的峰面积,A1为反应后液相色谱图中C3G的峰面积。
因转化率无法直观地表达C3G衍生物的得率,而通过高效液相外标法测定衍生物的得率需消耗一定量的C3G衍生物,故定义花色苷衍生物相对含量来比较不同酰基化反应条件下产物的得率。相对含量用以下公式计算:

式中:Cx为C3G酰基化衍生物的相对含量;Ax为需计算的C3G衍生物的峰面积;Amax为单因素条件下C3G衍生物的最大峰面积。
1.2.5 C3G酰基化衍生物的液相质谱联用分析
采用Agilent 1290 Infinity超高液相色谱仪和maXis Impact TOF-MS高分辨率质谱联用对反应产物进行初步的结构分析。
超高液相色谱测试条件:色谱柱为ZORBAX RRHD SB-C18 column (2.1 × 50 mm,1.8 μm);流动相A为0.1%三氟乙酸水,B为甲醇;以0.2 mL/min的流速进行梯度洗脱,洗脱程序如下:0~1 min,5% B;1~4 min,5~95% B;4~12 min,95% B;12~13.5 min,95~5% B;13.5~15 min,5% B。进样量1 μL,柱温保持在30 ℃,测定波长设置在520 nm。
质谱条件:使用ESI离子发射源;正离子模式;扫描范围:50~1000m/z;毛细管电压3.5 kV;干燥气体为氮气;干燥气温度,180 ℃,流速4.0 L/min;雾化气压0.2 bar。
1.2.6 半制备液相色谱对酰基化产物进行分离提纯
以正己烷/甲醇体积比5:2反复萃取反应体系中多余的脂肪酸甲酯后,用Aglient 1260 Infinity半制备高效液相系统进一步分离纯化肉豆蔻酰C3G。半制备液相条件为:色谱柱:SunFire C18 OBDTM半制备柱(250×19 mm,5 μm);流动相A为0.1%三氟乙酸水,B为甲醇;PDA检测器在双波长(280 nm和520 nm)下监测峰;以5 mL/min的流速进行梯度洗脱,洗脱程序如下:0~12 min,30% B;12~18 min,30~90% B;18~33 min,90% B;33~36 min,90~30% B。进样量为1.0 mL,柱温保持在30 ℃。用高效液相方法确定所收集的酰基化产物的纯度。
1.2.7 C3G酰基化衍生物的核磁共振分析
C3G的肉豆蔻酸甲酯酰基化衍生物的结构通过Bruker Avanve III HD 600超导核磁共振波谱仪进行进一步的探究。将酰基化产物溶解于氘代甲醇中,采用600 MHz扫描,测定产物的氢谱(1H-NMR)和碳谱(13C-NMR)。
1.2.8 单因素实验
按照1.2.2的方法,在20%的吡啶-叔戊醇溶剂中,分别考察反应温度(50、55、60、65 ℃)、C3G与肉豆蔻酸甲酯的摩尔比(1:100、1:150、1:200、1:250)、Lipozyme 435脂肪酶用量(10、20、30、40、50 mg)、反应时间(12、18、24、36、48 h)对反应转化率和酰基化衍生物的相对含量的影响。
1.2.9 正交试验的设计
在单因素实验的基础上,以转化率为响应值,选取温度、时间、底物比例为考察因素,按L9(34)正交表设计正交试验。
1.2.10 数据分析与处理
采用Origin 8.0软件进行绘图,采用SPSS 22.0对数据进行显著性分析,各组实验数据都是通过三次平行操作后获得,数据结果以平均值±标准差表示。
2 结果与讨论
2.1 单一有机溶剂对酰基化反应的影响
用固定化脂肪酶Lipozyme 435为生物催化剂,以肉豆蔻酸甲酯为酰基供体,分别在乙腈、吡啶、叔戊醇、叔丁醇中对C3G进行酰基化修饰,结果如图1所示。C3G在乙腈中获得最高的转化率(69.32%),这是基于已溶解于乙腈中的C3G的反应转化率,然而C3G在乙腈中溶解度低且大多数发生沉淀而未进行酯交换反应。C3G在吡啶中未观察到酰化产物,在叔戊醇和叔丁醇中的转化率分别为10.13%和12.76%。尽管C3G在叔丁醇中的转化率高于叔戊醇,但由于其熔点为25.7 ℃,在室温下容易结晶析出,增加了操作难度。因此,具有良好底物溶解性和低熔点的叔戊醇是C3G酰化反应的最理想反应介质。
反应介质会影响底物溶解度,酶的特异性、对映选择性和区域选择性等,对反应产生重要的影响[22]。Feng等[23]用CALB对油酰酯进行酰基化,综合考虑酶的活性和底物溶解度,发现叔戊醇是最佳的反应介质。Yang等[24]观察到C3G的转化率与其在反应介质中的溶解度呈正相关,在所有测试的有机介质中,叔丁醇的转化率最高。用Novozyme 435催化芦丁、柚皮苷与脂肪酸的酰化反应也观察到相同的结果[25]。但是闫征等[26]用Novozyme 435催化C3G与芳香酸的酰基化反应,发现酯化反应在吡啶中的转化率比叔丁醇和叔戊醇高,反应结果的差异性可能与底物的溶解性和操作条件相关。

图1 不同反应介质对酰基化反应的影响Fig.1 Effect of different reaction media on the acylation reaction efficiency
2.2 混合反应介质对酰基化反应的影响
在叔戊醇中分别添加20%的吡啶、石油醚、正己烷、异辛烷,研究C3G在混合溶剂中的酰基化反应。由图2a和表1可以看出,添加20%的吡啶、石油醚、正己烷、异辛烷后的酰基化转化率从原来的10.13%分别提高到15.62%、17.22%、18.66%、18.96%,相比于纯叔戊醇溶剂体系均显著提高,并且转化率随着混合溶剂体系logP值的增大而增大。说明疏水性有机溶剂的加入,确实能在一定程度上保护酶的催化活性提高反应的转化率。由酰基化产物的相对含量可以看出,除了20%吡啶-叔戊醇混合溶剂外,酰基化产物的含量并没有随着转化率的提高而提高,说明疏水性溶剂的添加除了对体系中的酶活性产生影响,还能与底物或反应产物相互作用,从而影响酶促反应的进行[27]。20%(V/V)吡啶的加入虽然降低了溶剂体系的logP值,但是转化率相比纯的叔戊醇溶剂仍有显著上升(p<0.05),这表明极性可能不是影响酶活性的唯一因素。每种有机溶剂都有其特定的分子结构,并与酶分子发生独特的干扰或者结合,从而导致生物催化剂的活性不同[19]。反应产生的酰基化衍生物含量在20%吡啶-叔戊醇溶剂体系中也相对较高,可能原因是矢车菊素-3-O-葡萄糖苷和肉豆蔻酸甲酯在吡啶中的溶解度较高[28]。综合考虑反应转化率和产物的相对含量,选择20%吡啶-叔戊醇溶剂进行反应。
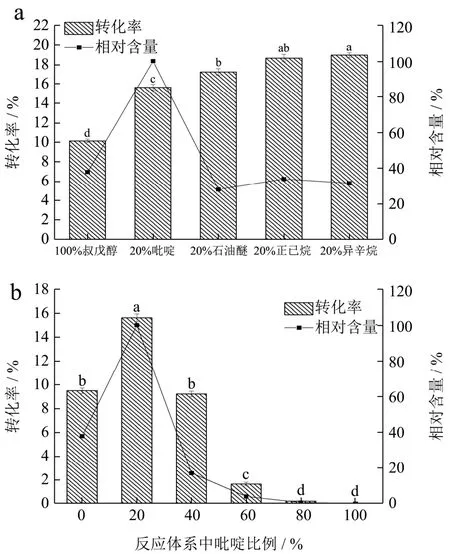
图2 混合溶剂对酰基化反应的影响Fig.2 Effect of mixed solvent on acylation efficiency
由图2b、表1可以看出,随着吡啶添加比例的增加,转化率呈现先上升后下降的趋势,在20%的吡啶添加比例下获得最高的转化率和产物相对含量。一定比例吡啶的添加可以增加底物溶解性,从而提高酰基化反应的转化率及得率,随着吡啶比例的增加,混合溶剂的极性增加,logP值由1.15降至0.71,导致酶活性减弱,酰基化转化率从15.62%降至0%。因此选择20%吡啶-叔戊醇溶剂作为最佳体积配比的混合溶剂。
自Mutua等[29]在研究脂肪酶促糖酯合成中首次采用了混合溶剂后,已有较多生物催化在混合有机溶剂中进行并获得令人满意的结果。Ferrer等[30]采用脂肪酶催化合成月桂酰蔗糖时,在叔丁醇中加入10%的DMSO溶剂后使得反应转化率由35%增加到70%。Feng等[19]用施氏假单胞菌催化葡萄糖酯的合成时,在吡啶中加入25%的异辛烷后,酯交换转化率由原来的77.9%提高到96.7%。

表1 混合溶剂对酰基化反应的影响Table 1 Effect of mixed solvent on acylation efficiency
2.3 酰基化产物的结构鉴定
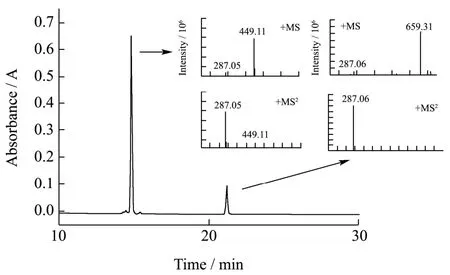
图3 液相及质谱图Fig.3 The liquid phase spectra and mass spectra
采用HPLC检测产物的生成,用HPLC-MS/MS和NMR对产物结构进行表征。如图3所示,反应体系在520 nm波长处检测到两个色谱峰。经HPLC-MS/MS测定,14.83 min处的峰相对分子量为449.11,与C3G的相对分子量一致。21.19 min处峰对应的分子离子峰[M+H]为659.31,恰好跟一个C3G与一个肉豆蔻酸甲酯脱掉一份子水后的相对分子量一致,说明酰基化反应只生成了单酰基化产物。酰化产物的二级质谱只检测到了相对分子量为287.06的离子碎片,与矢车菊素的相对分子质量一致,说明该酰基化反应发生于葡萄糖的羟基上,而非糖苷配体的任何羟基上。
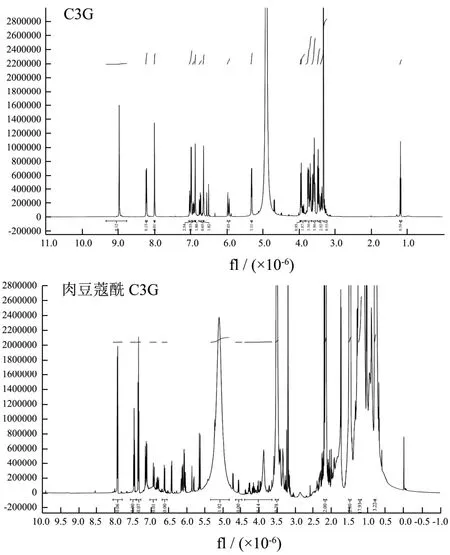
图4 C3G与肉豆蔻酰C3G的1H-NMR谱图Fig.4 1H NMR spectrum of C3G and myristoyl C3G
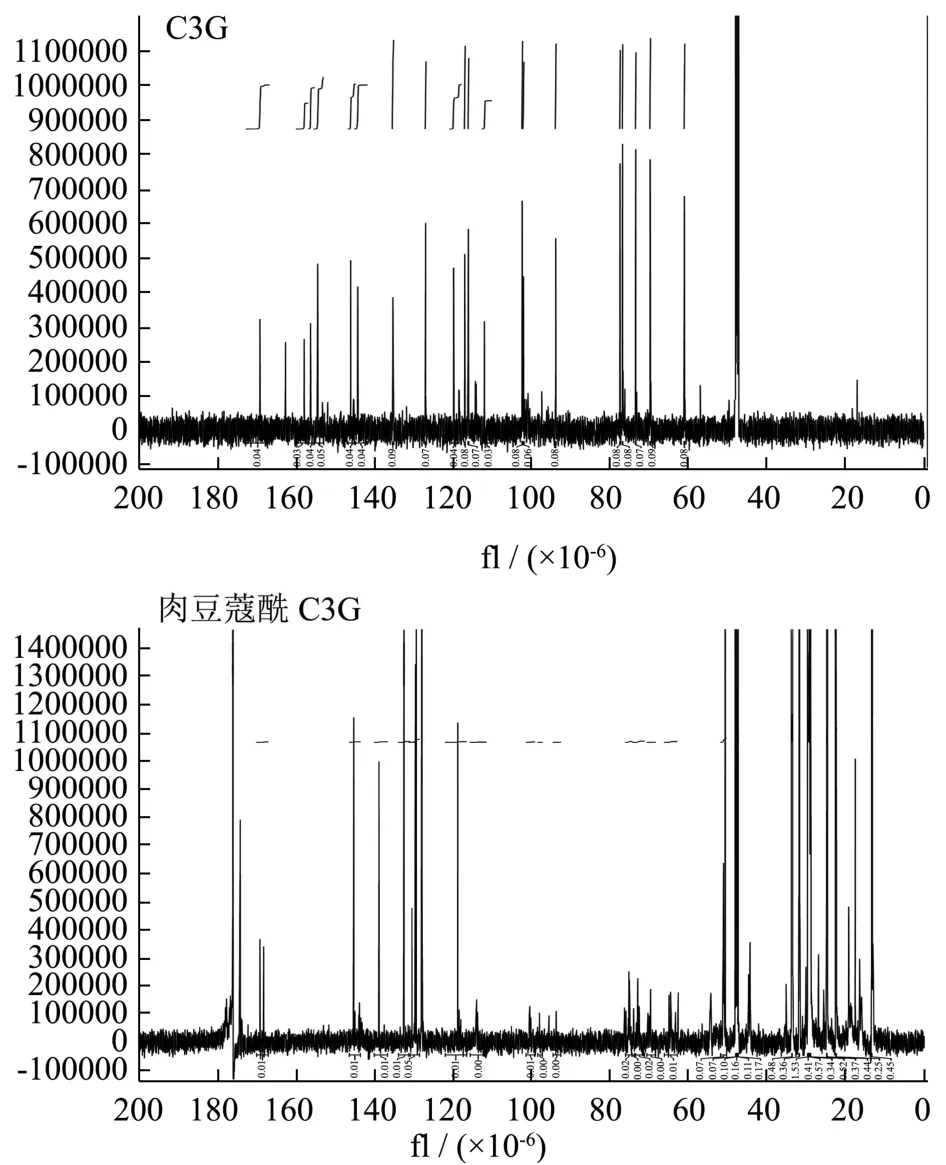
图5 C3G与肉豆蔻酰C3G的13C-NMR谱图Fig.5 13C NMR spectrum of C3G and myristoyl C3G
通过半制备高效液相分离纯化得到纯度接近于100%的C3G酰基化产物,用NMR进行氢谱(1H-NMR)和碳谱(13C-NMR)分析,结果如图4、5所示。C3G酰化反应导致C-6″位置的C化学位移达3.97×10-6(60.91×10-6~64.88×10-6),而其他位置C的化学位移相差2×10-6以内。H-6A″与H-6B″位置的H的化学位移差值也分别达到0.59×10-6(3.96×10-6~4.55×10-6)、0.48×10-6(3.91×10-6~4.39×10-6),这表明酰基化反应很有可能发生在C3G葡萄糖苷部分的C-6''上,C3G的肉豆蔻酸单酰基衍生物被鉴定为矢车菊素-3-(6″-肉豆蔻酰)-葡萄糖苷。
De Oliveira等用CALB脂肪酶对类黄酮进行酰基化反应,研究发现类黄酮的糖苷配基部分可以通过类黄酮酚基与疏水残基的主链羰基之间的氢键相互作用以及酚基与Ala,Ile,Leu和Val残基的侧链之间的氢键相互作用而相对稳定[31]。类黄酮的糖苷部分具有一块较小的极性区域,是唯一可以让催化底物接近的羟基。CALB催化花色苷的酰基化反应通常生成单酰基化衍生物,并且反应通常发生在糖苷部分的伯羟基上[24]。这种严格的区域选择性与之前的研究结果一致[16,26]。
2.4 单因素实验
2.4.1 反应温度对酰基化反应的影响
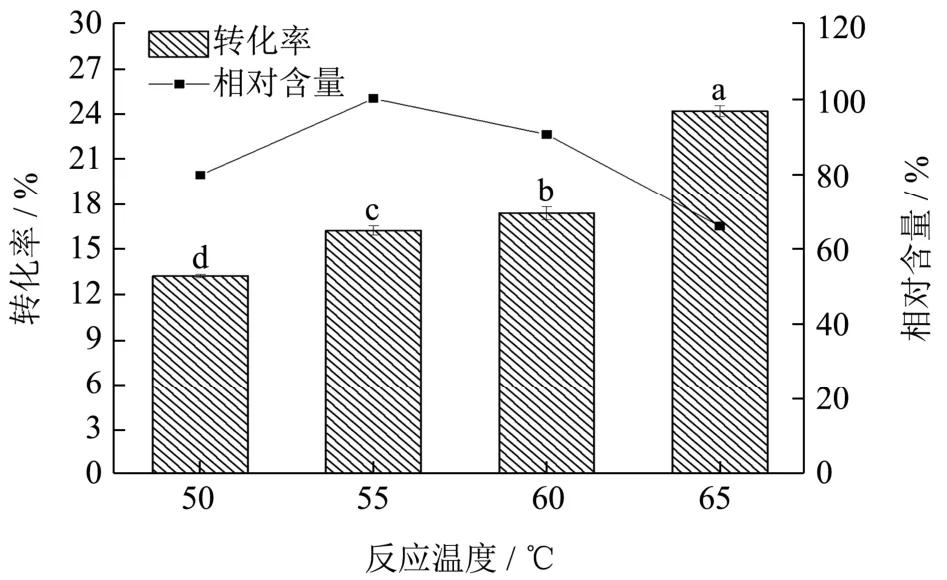
图6 温度对酰基化反应的影响Fig.6 Effect of temperature on acylation efficiency
温度会影响C3G的稳定性及溶解性,并影响酶的催化活性及稳定性,是酶催化反应的一个重要因素[32]。Lipozyme 435是一种耐热性较高的脂肪酶,随着温度的升高其活性会越来越强,但温度高达一定程度后,酶容易受热变性造成活力下降。分别在50、55、60和65 ℃温度下催化C3G的酰化反应。由图6可以看出,酰基化反应的转化率随着温度的升高而显著增加(p<0.05),由13.20%最终提高到24.17%。这是由于随着反应温度的提高,Lipozyme 435酶的活性越来越强,且底物的溶解度增强,反应体系中传质速度加快导致底物相互接触的机会增多的原因[28]。但是酰基化产物的相对含量呈现先上升后下降的趋势。当温度低于55 ℃时,酰基化产物的相对含量随着转化率的增加而增加,但当温度超过55 ℃之后,长时间的热处理致使C3G及其反应产物发生降解,导致酰基化产物的相对含量减少。因此,选取55 ℃为此单因素实验的最优条件。
2.4.2 底物摩尔比对酰基化反应的影响
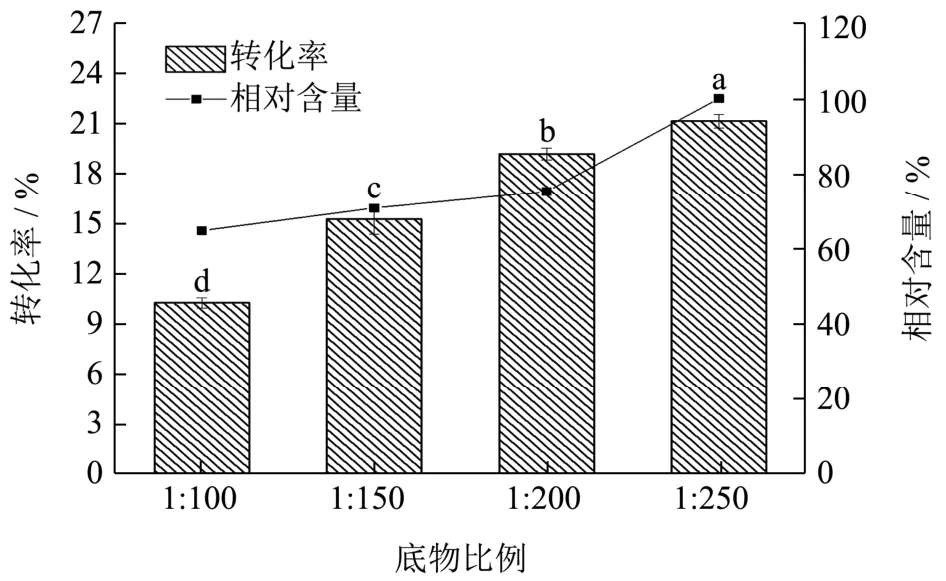
图7 底物摩尔比酰基化反应的影响Fig.7 Effect of molar ratio of C3G to methyl myristate on acylation efficiency
增加酰基供体的含量有利于底物与脂肪酶、底物之间的碰撞,提高反应转化率。分别以C3G与酰基供体的摩尔比1:100、1:150、1:200、1:250进行酰基化反应。由图7可以看出,随着肉豆蔻酸甲酯添加量的增加,C3G的转化率随之升高,由10.24%最终提高到21.15%,且各组数据之间存在显著性差异(p<0.05),酰基化产物的相对含量也显示出了相同的趋势。肉豆蔻酸甲酯的凝固点较高,添加过多的肉豆蔻酸甲酯会导致反应后的体系在常温下凝固,不利于后续酰基化产物的分离纯化,故选取底物摩尔比1:200作为此单因素实验的最优条件。
2.4.3 酶的添加量对酰基化反应的影响
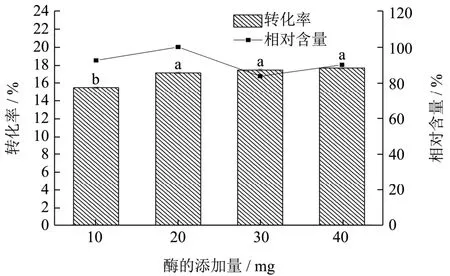
图8 酶的添加量对酰基化反应的影响Fig.8 Effect of f enzyme usage level on acylation efficiency
酶的添加量也是影响酶催化反应的重要因素。酶的添加量过小无法催化C3G与肉豆蔻酸甲酯的充分反应,酶的添加量过大又不利于节约成本。分别添加10、20、30、40 mg的Lipozyme 435脂肪酶催化酰基化反应的进行。如图8所示,随着体系中脂肪酶添加量的增加,C3G的转化率呈上升的趋势。当酶的添加量从10 mg增加为20 mg时,其转化率从15.45%增加到17.10%,表现出明显差异(p<0.05),当酶的添加量进一步增加后,其转化率并没有呈现出显著差异,这是由于酶的量与底物浓度接近“饱和”,无法进一步有效得提高转化率。酰基化产物的相对含量也呈现出相同趋势。结合转化率和衍生物的相对含量,同时考虑经济成本,选用20 mg酶用量作为此单因素实验的最优条件。
2.4.4 反应时间对酰基化反应的影响
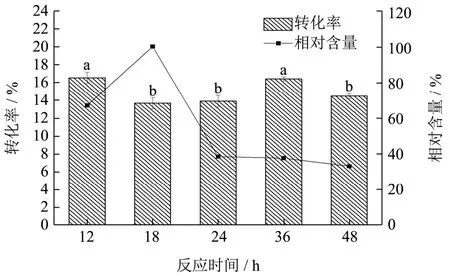
图9 反应时间对酰基化反应的影响Fig.9 Effect of reaction time on acylation efficiency
酰基化反应分别进行12、18、24、36、48 h后测其转化率和产物相对含量。结果见图9所示,随着反应时间的增加,转化率没有呈现出明显的规律。酰基化产物的相对含量随着反应时间的增加呈现出先上升后下降的趋势,前期的上升是由于酰基化反应的进行导致酰基化衍生物的积累,反应进行18 h之后C3G及其酰基化衍生物由于长时间维持在较高温度下分解导致含量的减少。因此,选取反应时间18 h为此单因素的最优条件。
2.5 正交试验的设计及结果
在单因素实验的基础上,选取反应温度(A)、反应时间(B)、底物摩尔比(C)三个因素进行正交试验,每个因素选取三个水平进行分析,并对结果进行极差分析来确定最佳反应条件。采用L9(34)正交表进行试验,结果见表2。
由极差分析结果可以看出,三个因素对C3G酰基化反应转化率的影响大小顺序为底物摩尔比>温度>时间。分析各因素的K值,可以得出最优反应条件为:温度60 ℃、反应时间22 h、底物摩尔比1:250。对上述反应条件进行验证性实验,得到的反应转化率为33.25%,比单因素实验得出的最优转化率结果高出10.63%。
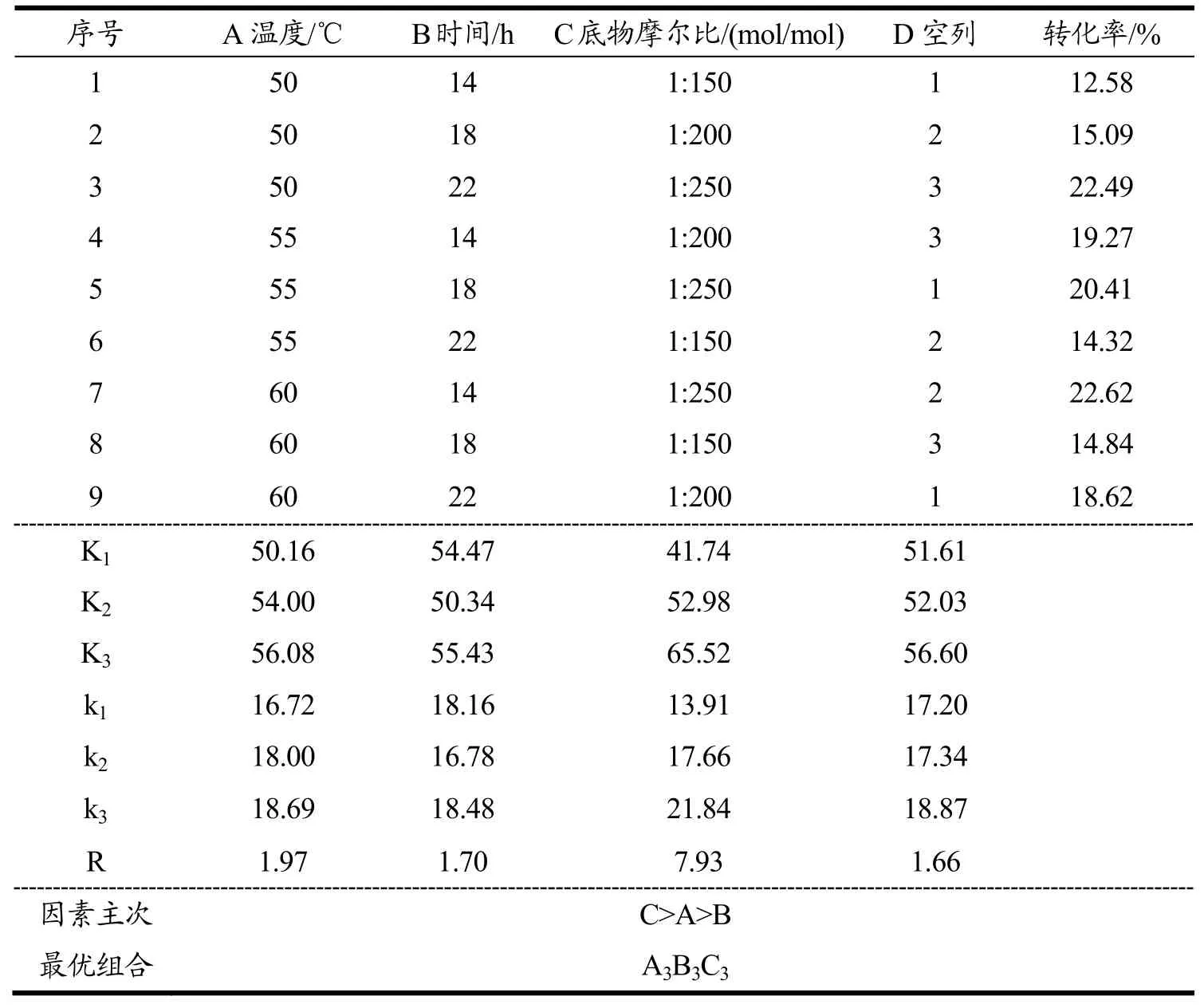
表2 正交试验因素水平及结果Table 2 Orthogonal experimental design and results
3 结论
本研究用固定化脂肪酶Lipozyme 435为生物催化剂,以肉豆蔻酸甲酯为酰基供体对C3G进行酰基化修饰,分别在单一有机溶剂和混合有机溶剂中进行该反应,得出在混合溶剂体系中的C3G酰基化反应的转化率均比单一溶剂显著提高(p<0.05),20%吡啶-叔戊醇作为最佳反应介质使酰基化转化率由10.13%提高到15.62%。对酰基化产物的结构进行表征,发现酰基化反应很有可能发生于C3G的6″-OH上。最后以20%吡啶-叔戊醇为反应介质,通过单因素实验和正交实验优化合成条件,获得肉豆蔻酰C3G的最优合成条件:温度60 ℃、反应时间22 h、C3G/肉豆蔻酸甲酯摩尔比1:250、酶的添加浓度20 mg/mL,在该条件下以肉豆蔻酸甲酯为酰基供体对C3G进行酰基化修饰获得了33.25%的转化率。后续可以通过HMBC等技术进一步确证肉豆蔻酰C3G的结构,并尝试在离子液体中进行C3G的酰基化修饰,使得酰基化反应更加环保。

