饥饿复投喂对长江鲟肝脏、肠道和肌肉抗氧化功能的影响
吴晓雲 陈叶雨 赖见生 刘亚 宋明江 龚全





摘要:【目的】明確饥饿与复投喂对长江鲟肝脏、肠道和肌肉抗氧化功能的影响,为揭示其对环境胁迫的生理适应机制提供参考依据。【方法】选取120尾体重相近(60.532±0.284 g)、健康、活力好的长江鲟随机分为4个处理组,分别进行0、3、7和14 d饥饿再复投喂14 d,试验结束后检测长江鲟肝脏、肠道和肌肉的各项抗氧化指标,包括丙二醛(MDA)含量、蛋白质羰基(PC)含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、谷胱甘肽硫转移酶(GST)活性、谷胱甘肽过氧化物酶(GSH-Px)活性、谷胱甘肽还原酶(GR)活性、谷胱甘肽(GSH)活性及抗超氧阴离子(ASA)和抗羟基自由基(AHR)能力。【结果】在饥饿期间,长江鲟肝脏MDA含量、GST活性、GSH-Px活性和GR活性均随饥饿胁迫时间的延长显著下降(P<0.05,下同);肠道GR活性和GSH活性也随饥饿胁迫时间的延长逐渐下降,MDA含量呈先升高后下降的变化趋势,CAT活性、GST活性和GSH-Px活性则先下降后上升;肌肉MDA含量和PC含量呈先显著升高后下降的变化趋势,CAT活性以饥饿14 d后最高,GR活性、GSH活性及ASA能力均无显著差异(P>0.05,下同)。复投喂后,长江鲟肝脏GSH-Px活性呈显著下降趋势,GR活性的变化趋势与GSH-Px活性恰好相反;肠道PC含量随饥饿胁迫时间的延长而显著下降,CAT活性、GST活性、GSH-Px活性和GR活性则先升高后降低,说明其肠道抗氧化能力在饥饿7 d复投喂14 d后显著上调;肌肉MDA含量、PC含量、SOD活性和AHR能力均呈显著下降趋势,CAT活性、GST活性和GR活性则以饥饿14 d复投喂14 d的最高。【结论】饥饿会抑制长江鲟体内抗氧化能力,随着饥饿胁迫时间的延长,其体内通过调动不同抗氧化酶活性逐渐形成新的氧化平衡以维持正常生理状态;复投喂后由于营养物质得到补充,促使鱼体各项生理机能得到恢复,一定程度上缓解饥饿产生的氧化应激并形成新的氧化平衡。
关键词: 长江鲟;饥饿;复投喂;抗氧化酶;氧化平衡
中国分类号: S965.219 文献标志码: A 文章编号:2095-1191(2021)11-3157-09
Effects of starvation and refeeding on antioxidative function of liver, intestine and muscle in Acipenser dabryanus
WU Xiao-yun, CHEN Ye-yu, LAI Jian-sheng, LIU Ya,
SONG Ming-jiang, GONG Quan*
(Fishery Institute, Sichuan Academy of Agricultural Sciences/Observation and Research Station of Sichuan Province of Fish Resources and Environment in Upper Reaches of the Yangtze River, Chengdu 611713, China)
Abstract:【Objective】In order to study the effects of starvation and refeeding on antioxidant function of liver, intestine and muscle in Acipenser dabryanus, so as to provide reference basis for revealing its physiological adaptation mechanism to environmental stress.【Method】One hundred and twentyhealthy and vigorous A.dabryanus with similar body weight(60.532±0.284 g)were randomly divided into four treatment groups for 0, 3, 7 and 14 d starvation and 14 d refee-ding test.After the experiment,the activities of antioxidant enzymes in liver, intestine and muscle were detected,including malondialdehyde(MDA) content and protein carbonyl(PC) content, superoxide dismutase(SOD) activity,catalase (CAT) activity, glutathione S-transferase (GST) activity, glutathione peroxidase (GSH-Px)activity,glutathione reductase(GR) activity and glutathione(GSH) activity and anti-superoxide anion(ASA) and anti-hydroxyl radical(AHR) ability. 【Result】During starvation, the results showed that the MDA content, GST, GSH-Px and GR activities in liver decreased significantly with prolonged starvation(P<0.05, the same below); GR activity and GSH content in intestine decreased gradually with prolonged starvation, CAT, GST and GSH-Px activities decreased first and then increased, while the MDA content increased first and then decreased. MDA and PC content in muscle increased significantly at first and then decreased, the highest activity of CAT was observed in 14 dgroup, whilethere was no significant difference in GR,GSH and ASA activities(P>0.05,the same below). After refeeding, GSH-Px activities in liver decreased significantly, the change trend of GR activity was opposite to that of GSH-Px; intestinal PC content decreased significantly with with prolonged starvation, CAT, GST, GSH-Px and GR activities increased first and then decreased,it showed that the intestinal antioxidant capacity was significantly up-regulated after 7 d of starvation and 14 d of refeeding; the content of MDA and PC, activities of SOD and AHR in muscle sinificantly decreased,where the CAT, GST and GR enzymes activities were the highestin14 d group. 【Conclusion】Starvation can inhibit the antioxidant capacity of A. dabryanus. With the extension of starvation stress time, a new oxidative balance is gradually formed by mobilizing different antioxidant enzyme activities to maintain the normal physiological state. After refeeding, nutrients are supplemented to restore the physio-logical functions of the fish, alleviate the oxidative stress caused by starvation to a certain extent, and form a new oxidative balance.
Key words: Acipenser dabryanus; starvation; refeeding; antioxidant enzymes; oxidative balance
Foundation item:Sichuan Science and Technology Project(2021YFYZ0015); Project of Key Laboratory of Sichuan Province for Fishes Conservation and Utilization in the Upper Reaches of the Yangtze River(NJTCCJSYSYS07); Frontier Project of Sichuan Academy of Agricultural Sciences(2019QYXK021);Sichuan Freshwater Fish Innovation Team Construction Project of National Modern Agricultural Industrial Technology System(2019-2023)
0 引言
【研究意義】长江鲟(Acipenser dabryanus)又称达氏鲟、沙腊子或小腊子,隶属于鲟形目(Acipense-riformes)鲟科(Acipenseridae),曾是长江上游重要的经济捕捞对象(刘亚等,2018),但由于过度捕捞、水体污染、海滩开垦及人类活动的干扰,从20世纪后期开始长江鲟自然种群资源规模急剧缩小,现已被列为国家一级重点保护野生动物(陈俊和徐承旭,2019;胡伟等,2020),并被世界自然保护联盟(IUCN)升级为极危级(GR)保护物种。营养状况、免疫力和抗氧化能力间的动态平衡决定了鱼类抵抗疾病的生理能力(Feng et al.,2011;谢雨欣等,2018)。在自然水域生态系统中,鱼类常因时间、空间、季节更替及环境变化导致食物短缺而受饥饿胁迫的影响(徐蕾,2019)。饥饿胁迫过程中鱼类的抗氧化水平降低,易引起活性氧(Reactive oxygen species,ROS)侵袭,当细胞内ROS水平超过清除酶系统的处理能力则导致组织损伤甚至死亡,即氧化应激(Oxidative stress,OS)。抗氧化剂(酶类和非酶类)能有效调节动物机体氧化还原平衡,减轻氧化应激反应,阻止或减少自由基氧化应激的破坏(朱若岑等,2015)。因此,通过饥饿复投喂模拟自然环境变化研究长江鲟抗氧化功能,可为评估长江鲟对环境胁迫的生理适应机制提供参考依据,同时对进一步优化其人工养殖技术具有重要意义。【前人研究进展】至今,已有大量研究证实饥饿能显著影响意大利鲟(A. naccarii)(Furné et al.,2009)、虹鳟(Oncorhynchus mykiss)(Furné et al.,2009)、卵形鲳鲹(Trachinotus ovatus)幼鱼(苏慧等,2012)、罗非鱼(Oreochroms mossambcus)(卢俊姣等,2013)、团头鲂(Megalobrama amblycephala)(苏艳莉等,2017)及黄姑鱼(Nibea albiflora)(Song et al.,2019)等鱼类的肝脏抗氧化酶活力;其次,饥饿对鱼类的消化系统结构影响极大(高露姣等,2004;Zeng et al.,2012),能引起闪光鲟(Acipenser stellatus)(Gune et al.,2021)和翘嘴鳜(Siniperca chuatsi)(徐蕾,2019)等鱼类肠道的氧化应激。此外,鱼类肌肉中含有大量不饱和脂肪酸,饥饿引起的氧化应激会导致脂质过氧化,已有研究发现饥饿胁迫能影响大黄鱼(Pseudosciaena crocea)(Zhang et al.,2008)、波纹短须石首鱼(Umbrina cirrosa)(Hidalgo et al.,2017)和黑鲷(Sparus macrocephalus)(徐蕾,2019)的肌肉抗氧化防御。可见,饥饿胁迫显著影响鱼类肝脏、肠道和肌肉中抗氧化功能。【本研究切入点】目前,有关长江鲟的研究主要集中在人工养殖技术、早期发育及基因克隆等方面(杜军等,2009;单喜双等,2015;刘亚等,2017),仅有Yang等(2019)研究报道了禁食能激活长江鲟的抗氧化防御,同时在饥饿4周后其血清和肝脏中的氧化应激得到缓解。鱼类体内抗氧化酶活性的变化能反映其对外界环境变化的抗氧化防御能力,但至今未见短期自然环境更替对长江鲟抗氧化功能影响的研究报道。【拟解决的关键问题】通过探究饥饿复投喂期间长江鲟肝脏、肠道和肌肉中相关抗氧化剂含量或酶活性的变化规律,明确饥饿与复投喂对其抗氧化功能的影响,为揭示长江鲟对环境胁迫的生理适应机制提供参考依据。
1 材料与方法
1. 1 试验设计
供试长江鲟为四川省农业科学院水产研究所人工繁殖的F2代幼鱼。试验前将长江鲟置于循环水养殖系统暂养2周,每天早晚各投喂1次饲料。饲料营养成分:粗蛋白含量41.31%、粗脂肪含量10.00%、粗纤维含量4.68%、粗灰分含量13.51%、水分含量9.14%。暂养2周后,选取120尾体重相近(60.532±0.284 g)、健康、活力好的长江鲟随机分为4个处理组,每处理组3个平行,每个平行10尾。其中,A组(对照组)连续投喂14 d,B组饥饿3 d后连续投喂14 d,C组饥饿7 d后连续投喂14 d,D组饥饿14 d后连续投喂14 d。试验期间水温控制在(18.5±2.0)℃,溶解氧(DO)≥5.0 mg/L。
1. 2 样品采集
试验方案经四川省农业科学院水产研究所动物伦理咨询委员会批准(20180929001A)。分别于试验前(对照组)、饥饿后(饥饿处理组)及复投喂后(对照组和饥饿处理组)选取3尾长江鲟,经MS-222麻醉后采集其肝脏、肠道和肌肉组织样品,放入液氮速冻后置于-80 ℃冰箱保存备用。
1. 3 酶活性检测
采用匀浆器制备10%的组织匀浆,3000 r/min离心10 min后取上清液用于各项指标测定。指标测定前以考马斯亮蓝方法测定组织样品总蛋白含量,预试验确定各项指标测定的适宜匀浆浓度后,参照南京建成生物工程研究所试剂盒说明分别测定各项抗氧化指标,包括丙二醛(MDA)含量、蛋白质羰基(PC)含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、谷胱甘肽硫转移酶(GST)活性、谷胱甘肽过氧化物酶(GSH-Px)活性、谷胱甘肽还原酶(GR)活性、谷胱甘肽(GSH)活性及抗超氧阴离子(ASA)和抗羟基自由基(AHR)能力。
1. 4 统计分析
试验数据采用SPSS 19.0进行统计处理,并通过方差分析(ANOVA)结合Tukey法进行多重比较以检验差异显著性。
2 结果与分析
2. 1 饥饿对长江鲟肝脏、肠道和肌肉抗氧化功能的影响
2. 1. 1 饥饿对长江鲟肝脏抗氧化功能的影响 由表1可知,长江鲟肝脏MDA含量随饥饿胁迫时间的延长而显著下降(P<0.05,下同),而PC含量、SOD活性和ASA能力在饥饿胁迫期间无显著变化(P>0.05,下同)。B组长江鲟肝脏CAT活性显著低于对照组,其他处理组间无显著差异;饥饿组(B组、C组和D组)长江鲟肝脏GST活性显著低于对照组,但组间无显著差异;C组和D组长江鲟肝脏GSH-Px活性显著低于对照组和B组,B组与对照组间无显著差异;长江鲟肝脏GSH水平在饥饿期间整体上呈逐渐下降趋势;饥饿组(B组、C组和D组)长江鲟肝脏GR活性显著低于对照组,其中D组的GR活性最低;长江鲟肝脏AHR能力以B组最低,显著低于D组,其他处理组间无显著差异。
2. 1. 2 饥饿对长江鲟肠道抗氧化功能的影响 由表2可知,B组长江鲟肠道MDA含量显著高于对照组,其他处理组间无显著差异;长江鲟肠道SOD活性以B组显著低于对照组,其他处理组间无显著差异;长江鲟肠道CAT活性在饥饿胁迫期间显著降低,以C组的最低,而B组和D组间无显著差异;C组长江鲟肠道的GST活性和GSH-Px活性均最低,显著低于对照组和D组;长江鲟肠道GR活性和GSH活性均随饥饿胁迫时间的延长呈逐渐下降趋势,以D组的最低,显著低于对照组;长江鲟肠道PC含量、ASA能力和AHR能力在各处理组间均无显著差异。
2. 1. 3 饑饿对长江鲟肌肉抗氧化功能的影响 由表3可知,C组长江鲟肌肉MDA含量显著高于对照组,但D组的含量显著低于对照组;长江鲟肌肉PC含量以C组显著高于其他处理组,而SOD活性以C组最低,显著低于对照组;D组长江鲟肌肉CAT活性显著高于其他处理组,其他处理组间无显著差异;C组长江鲟肌肉GST活性显著低于对照组和B组,但与D组间无显著差异;饥饿组(B组、C组和D组)长江鲟肌肉GSH-Px活性显著低于对照组,且以B组最低;长江鲟肌肉AHR能力以C组最低,显著低于对照组,B组和D组与对照组间无显著差异;长江鲟肌肉GR活性、GSH活性及ASA能力在饥饿胁迫期间均无显著差异。
2. 2 饥饿复投喂对长江鲟肝脏、肠道和肌肉抗氧化功能的影响
2. 2. 1 饥饿复投喂对长江鲟肝脏抗氧化功能的影响 由表4可知,复投喂后饥饿处理组(B组、C组和D组)长江鲟肝脏MDA含量逐渐升高,且C组和D组显著高于对照组;长江鲟肝脏PC含量和GST活性均以C组显著高于对照组,而SOD活性、CAT活性、ASA能力和AHR能力在各处理组间无显著差异;D组长江鲟肝脏GSH-Px活性最低,显著低于对照组和B组;长江鲟肝脏GR活性的变化趋势与GSH-Px活性恰好相反,以D组显著高于其他处理组;B组长江鲟肝脏GSH活性显著高于C组和D组,但与对照组间无显著差异。
2. 2. 2 饥饿复投喂对长江鲟肠道抗氧化功能的影响 由表5可知,B组长江鲟肠道MDA含量显著低于对照组,但与C组和D组间无显著差异;长江鲟肠道PC含量随饥饿胁迫时间的延长而显著下降;对照组长江鲟肠道SOD活性显著高于B组和D组,但各饥饿组间无显著差异;长江鲟肠道CAT活性、GST活性、GSH-Px活性和GR活性均以C组显著高于对照组和D组,GSH活性则以D组最低,显著低于对照组和B组;长江鲟肠道的ASA能力和AHR能力在各处理组间均无显著差异。
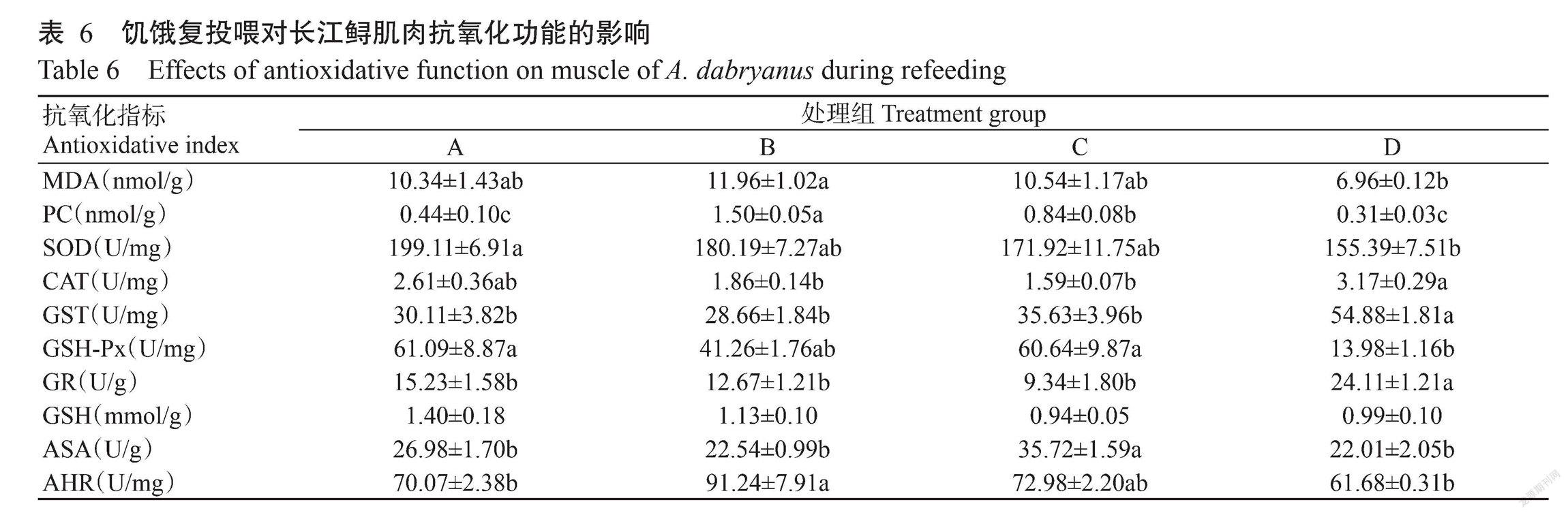
2. 2. 3 饥饿复投喂对长江鲟肌肉抗氧化功能的影响 由表6可知,长江鲟肌肉MDA含量和PC含量均以B组最高、D组最低,且二者间差异显著;D组长江鲟肌肉SOD活性和GSH-Px活性显著低于对照组,而GST活性和GR活性显著高于对照组;D组长江鲟肌肉CAT活性也最高,与对照组间无显著差异,但显著高于B组和C组;长江鲟肌肉GSH活性在各处理组间无显著变化;长江鲟肌肉ASA能力和AHR能力均以D组最低,但与对照组间无显著差异。
3 讨论
3. 1 饥饿对长江鲟肝脏、肠道和肌肉抗氧化酶功能的影响
肝脏作为重要的代谢器官,在协助排毒和代谢产物降解的过程中极易受内源性或外源性自由基的攻击(Lee et al.,2015;李思和刘晓宇,2019)。Varju等(2018)研究发现,长期饥饿会削弱梭鲈(Sander lucioperca)谷胱甘肽氧化还原系统的活性。在本研究中,长江鲟肝脏GST、GSH-Px、GR和GSH的活性在饥饿胁迫后均呈下降趋势,即饥饿过程中肝脏氧化应激反应不活跃,但长时间的饥饿胁迫会造成ROS积累,从而上调肝脏对超氧阴离子和羟自由基的清除功能。GST虽然不能清除体内的H2O2,但具有清除体内过氧化物及解毒的双重功效(马森,2008)。Bayir等(2011)研究报道,饥饿能导致褐鳟(Salmo trutta)肝脏GST活性降低23%,即长期饥饿胁迫后鱼类承受氧化应激的能力显著降低。GSH-Px是清除体内H2O2和脂质过氧化物的抗氧化酶(况新宇,2016;王晶晶等,2019)。Furné等(2009)研究分析意大利鲟和虹鳟在饥饿10 d后其肝脏GSH-Px活性显著下调,Varju等(2018)研究表明饥饿3周后梭鲈的GSH-Px活性显著下降,究其原因是持续饥饿胁迫致使鱼体缺乏连续氨基酸供应,而导致含巯基基团的GSH合成受到干扰,GSH作为GSH-Px的辅助底物,其含量下降必然引起GSH-Px活性下降(Furné et al.,2009)。GR在清除自由基和活性氧及保持细胞内物种氧化还原状态中发挥关键作用,CAT的主要作用是清除体内H2O2,且在持续饥饿胁迫过程中能将ROS浓度控制在理想的平衡状态(徐蕾,2019)。本研究结果表明,长江鲟在饥饿3 d时其肝脏CAT活性显著下降,之后又恢复至正常水平,推测CAT参与调节肝脏中的ROS平衡。MDA是细胞中多不饱和脂肪酸过氧化的最终产物之一,是衡量氧化性脂质损伤的重要标志物(丁立云等,2019)。长江鲟肝脏MDA含量在饥饿3 d时无显著变化,但随着饥饿时间的延长而显著下降,与董学兴等(2011)研究异育银鲫(Carassiusauratus gibelio)血清MDA含量变化得出的结论一致,可能是由于饥饿过程中鱼类脂质优先被降解供能,体内游离脂肪酸水平下降,导致MDA含量随之减少。超氧阴离子和羟自由基是组成ROS的2个重要成员,长江鲟肝脏的AHR能力在饥饿14 d时达最高值,表明其抗氧化防御能力依然存在,与刘松岩(2006)、Bayir等(2011)的研究结论存在差异,可能是由于不同物种的抗氧化反应机制不同所致。
在长江鲟肠道方面,其MDA含量随着饥饿时间的延长呈先升后降的变化趋势,短期饥饿(3 d)肠道细胞的脂质过氧化程度加深,可能与SOD活性下降有关。SOD是生物体内的重要抗氧化酶类,能消除生物体在新陈代谢过程中产生的ROS。长江鲟肠道SOD活性在饥饿第3 d显著下降,之后略有回升。这与董学兴等(2011)研究表明短期饥饿8 d时异育银鲫血液SOD活性显著下降,随后恢复正常的结论相似,说明短期饥饿时会抑制长江鲟的肠道抗氧化功能,使其免疫能力下降。至饥饿14 d时长江鲟肠道的抗氧化功能又被激活,CAT、GST和GSH-Px的活性相对饥饿7 d时均呈升高趋势,即肠道新的抗氧化平衡逐渐恢复。本研究还发现,随着饥饿胁迫时间的延长,长江鲟肠道GR活性受到抑制。GR主要负责维持抗氧化剂GSH浓度,二者的变化趋势基本保持一致,与在肝脏中的现象相似,但至饥饿14 d时GSH-Px活性和GST活性的增加似乎与GR或GSH的活性变化无关,与Bayir等(2011)对褐鳟肝脏的研究结果相似,但具体原因有待进一步探究。
本研究结果表明,长江鲟肌肉MDA和PC的含量在饥饿7 d时显著上调,与此同时SOD活性、GST活性、GSH-Px活性及AHR能力却显著下降,说明至饥饿7 d时肌肉抗氧化能力下降。饥饿14 d后,长江鲟肌肉MDA和PC的含量均呈下降趋势,而CAT活性、SOD活性、GST活性及AHR能力均呈上调趋势,说明肌肉氧化损伤得到缓解,新的氧化平衡逐渐实现,抗氧化功能缓慢恢复。但Bayir等(2011)研究发现饥饿14 d内黑鲷和大黄鱼的肌肉MDA含量变化均不明显,而饥饿21~28 d后显著高于其他处理组,即当饥饿周期超过21 d后黑鲷和大黄鱼的自身防御无法清除过多的ROS,究其原因可能是物种或个体大小不同所造成,也可能与饥饿试验模式有关(Zhang et al.,2007)。
3. 2 饥饿复投喂对长江鲟肝脏、肠道和肌肉抗氧化功能的影响
复投喂后观察发现,C组和D组的长江鲟肝脏脂质氧化损伤程度加剧,蛋白氧化损伤以C组最严重,其GST活性显著上调。同时,D组长江鲟肝脏GSH-Px活性显著下降,GSH活性达最低值,但GR活性显著提高。Bayir等(2011)也研究证实,饥饿49 d以后饱食投喂14 d褐鳟肝脏GR活性显著提高。说明长江鲟肝脏在饥饿7~14 d复投喂后的抗氧化能力尚未得到完全恢复,同时可能通过提高GST活性和GR活性以增强肝脏清除活性氧的能力。饥饿复投喂对长江鲟肝脏SOD活性无明显影响,但在周期性饥饿复投喂试验中,团头鲂肝脏SOD活性在饥饿1 d复投喂1 d模式下显著提高,而建鲤(Cyprinus carpiovar Jian)肝脏SOD活性在各周期间均显著提高(乔秋实,2011),说明不同物种在不同投喂模式下的抗氧化调控机制存在明显差异。
本研究发现,复投喂后对照组和B组长江鲟肠道的CAT活性、GST活性、GR活性、GSH活性及ASA和AHR能力均无显著差异,表明饥饿3 d后复投喂14 d长江鲟肠道抗氧化功能受到的影响较小。经14 d复投喂后,C组长江鲟肠道MDA含量和PC含量均呈下降趋势,CAT活性、GST活性、GSH-Px活性和GR活性则以C组最高,表明长江鲟肠道抗氧化能力在饥饿7 d复投喂14 d后显著上调。此外,SOD活性与ASA能力的变化趋势基本相似,表明长江鲟肠道的抗氧化能力在饥饿7 d复投喂14 d后最高。
在长江鲟肌肉中,复投喂后B组的MDA含量和PC含量显著提高,说明饥饿后复投喂对肌肉脂质和蛋白过氧化作用显著。Furné等(2009)对意大利鲟和虹鳟的研究发现,复投喂能使其肌肉脂质过氧化作用提高,主要是对饥饿期的代偿性代謝反应。长江鲟MDA含量和PC含量的变化可能与食物匮乏导致鱼类活跃度下降在补饲期间得到恢复,或导致肌肉中氧化应激增加有关。长江鲟肌肉的SOD活性、CAT活性、GST活性、GSH-Px活性和GR活性在对照组、B组和C组间均无显著差异,表明短期的饥饿复投喂对长江鲟肌肉抗氧化功能影响不明显;AHR能力在B组显著提高,ASA能力在C组显著提高,推测短期饥饿复投喂过程中由于ROS含量增加,刺激肌肉对超氧化物和羟自由基的清除能力提高,但由于此时大部分酶类活性变化不明显,说明免疫能力有所提升,而对抗氧化功能的影响并不明显;D组长江鲟的SOD活性和GSH-Px活性显著下降,而GST活性和GR活性显著提高,表明饥饿14 d复投喂14 d致使长江鲟肌肉中的ROS清除能力下降,但机体依然试图调动GST和GR(代偿性增高)以抵消这部分的影响。
综上所述,长江鲟体内抗氧化过程复杂,不同组织间的抗氧化调节机制存在明显差异,饥饿或复投喂过程中抗氧化功能也有所不同。饥饿会抑制长江鲟体内抗氧化能力,但随着饥饿胁迫时间的延长,其体内通过调动不同抗氧化酶活性逐渐形成新的氧化平衡以维持正常生理状态。复投喂后,营养物质得到补充,促使鱼体各项生理机能得到恢复,形成新的氧化平衡。在饥饿及复投喂过程中,首先对长江鲟的肝脏抗氧化功能影响最大,其次是肠道,最后是肌肉,究其原因可能是白肌作为厌氧性肌肉需要的血液供给较少,对氧气的需求也较其他组织少,因而对氧化应激的耐受能力较强(Furné et al.,2009)。饥饿3~7 d后再复投喂14 d对长江鲟肠道和肌肉的抗氧化功能影响相对较小,表明短期饥饿后进行复投喂能在一定程度上缓解其氧化应激反应。
4 结论
饥饿会抑制长江鲟体内抗氧化能力,随着饥饿胁迫时间的延长,其体内通过调动不同抗氧化酶活性逐渐形成新的氧化平衡以维持正常生理状态;复投喂后由于营养物质得到补充,促使鱼体各项生理机能得到恢复,一定程度上缓解饥饿产生的氧化应激并形成新的氧化平衡。
参考文献:
陈俊,徐承旭. 2019. 极危物种长江鲟全人工繁殖成功[J]. 水产科技情报,46(4):235. [Chen J,Xu C X. 2019. Successful artificial propagation of a critically endangered species,Acipenser dabryanus[J]. Fisheries Science & Technology Information,46(4):235.]
丁立云,陈文静,饶毅,张桂芳,傅义龙,张爱芳. 2019. 饥饿胁迫对彭泽鲫幼鱼生长、体组成、消化酶活性及抗氧化性的影响[J]. 河南农业科学,48(1):141-145. [Ding L Y,Chen W J,Rao Y,Zhang G F,Fu Y L,Zhang A F. 2019. Effects of starvation on growth,body composition,activities of digestive enzyme and antioxidant of Carassius auratus var. Pengze[J]. Journal of Henan Agricultural Scien-ces,48(1):141-145.] doi:10.15933/j.cnki.1004-3268.2019. 01.023.
董学兴,吕林兰,黄金田,王爱民,於叶兵. 2011. 饥饿后再投喂对异育银鲫血液生理和非特异性免疫指标的影响[J]. 中国农学通报,27(23):76-79. [Dong X X,Lü L L,Huang J T,Wang A M,Yu Y B. 2011. Effect of starvation and re-feeding on blood physiological and non-specific immune parameters of Carassius auratus gibelio[J]. Chinese Agricultural Science Bulletin,27(23):76-79.]
杜军,赵刚,龚全,沈丹舟,吴明森,刘光迅. 2009. 达氏鲟亲鱼池塘人工培育试验[J]. 西南农业学报,22(3):824-827. [Du J,Zhao G,Gong Q,Shen D Z,Wu M S,Liu G X. 2009. Study on Acipenser dabryanus Dumeril farmed in pool[J]. Southwest China Journal of Agricultural Sciences,22(3):824-827.] doi:10.3969/j.issn.1001-4829.2009.03. 064.
高露姣,陈立侨,赵晓勤,庄平. 2004. 施氏鲟幼鱼的饥饿和补偿生长研究——对消化器官结构和酶活性的影响[J]. 中国水产科学,11(5):413-419. [Gao L J,Chen L Q,Zhao X Q,Zhuang P. 2004. Starvation and compensantory growth of Acipenser schrenckii—Effects on digestive organs structure and digestive ezymes activity[J]. Journal of Fishery Science of China,11(5):413-419.] doi:10.3321/j.issn:1005-8737.2004.05.006.
胡偉,许巧情,郭慧芝,李由申,韩盼盼,袁汉文,张书环,陈敦学. 2020. 达氏鲟自噬基因MAP1LC3B克隆及其组织表达分析[J]. 南方农业学报,51(2):445-452. [Hu W,Xu Q Q,Guo H Z,Li Y S,Han P P,Yuan H W,Zhang S H,Chen D X. 2020. Cloning and expression of autophagy-related gene MAP1LC3B in Dabry’s sturgeon (Acipenser dabryanus)[J]. Journal of Southern Agriculture,51(2):445-452.] doi:10.3969/j.issn.2095-1191.2020.02.026.
况新宇. 2016. 高溶氧对西伯利亚鲟、杂交鲟生长、氧化应激及免疫功能的影响[D]. 大连:大连海洋大学. [Kuang X Y. 2016. Effction of high dissolved oxygen on growth,oxidative stress,and immune capacity of Acipenser baerii and hybird sturgeon[D]. Dalian:Dalian Ocean University.] doi:10.7666/d.D01051577.
李思,刘晓宇. 2019. 辛硫磷对鲫鱼肝微粒体中CYP1A活性及其表达水平的影响[J]. 南方农业学报,50(10):2329-2334. [Li S,Liu X Y. 2019. Effects of phoxim on the activity and expression of CYP1A in liver microsomes of Carassius auratus gibebio(crucian carp)[J]. Journal of Southern Agriculture,50(10):2329-2334.] doi:10.3969/j.issn.2095-1191.2019.10.25.
刘松岩. 2006. 环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响[D]. 武汉:华中农业大学. [Liu S Y. 2006. Effect of environmengtal stress on free radical le-vel and antioxdant enzyme activities of Chinese sturgeon,Acipenser sinensis[D]. Wuhan:Huazhong Agricultural University.] doi:10.7666/d.y1004947.
刘亚,龚全,李强,杜军,赵刚. 2017. 全人工繁殖达氏鲟胚胎发育的形态学和组织学观察[J]. 西南农业学报,30(7):1686-1692. [Liu Y,Gong Q,Li Q,Du J,Zhao G. 2017. Morphological and histological observation of embryonic development of artificially-bred Acipenser dabryanus Dumeril[J]. Southwest China Journal of Agricultural Scien-ces,30(7):1686-1692.] doi:10.16213/j.cnki.scjas.2017.7. 039.
刘亚,杨锐,陈叶雨,宋明江,颜其贵,龚全,李强,杨焕超,赖见生. 2018. 达氏鲟维氏气单胞菌的分离鉴定及病理组织学观察[J]. 南方农业学报,49(6):1235-1241. [Liu Y,Yang R,Chen Y Y,Song M J,Yan Q G,Gong Q,Li Q,Yang H C,Lai J S. 2018. Isolation,identification of Aeromonas veronii in Acipenser dabryanus and its histological observations[J]. Journal of Southern Agriculture,49(6):1235-1241.] doi:10.3969/j.issn.2095-1191.2018. 06.28.
盧俊姣,刘淑兰,翟少伟. 2013. 饥饿胁迫对罗非鱼肝胰脏抗氧化能力的影响[J]. 中国农学通报,29(35):75-79. [Lu J J,Liu S L,Zhai S W. 2013. Effects of starvation stress on antioxidant capacity in hepatopancreas of tilapia (Oreochromis niloticus)[J]. Chinese Agricultural Science Bulletin,29(35):75-79.]
马森. 2008. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展,29(10):53-56. [Ma S. 2008. Progress on GSH-Px and GST[J]. Progress in Veterinary Medicine,29(10):53-56.] doi:10.3969/j.issn.1007-5038. 2008.10.015.
乔秋实. 2011. 周期性饥饿再投喂对团头鲂和建鲤生长性能、体组成、消化酶及抗氧化酶的影响[D]. 南京:南京农业大学. [Qiao Q S. 2011. Effects of the cyclic starvation-refeeding on growth performance,body composition,digestive enzymes and antioxidant enzymes of Megalobrama amblycephala and Cyprinus carpio var. Jian[D]. Nanjing:Nanjing Agricultural University.] doi:10.7666/d.Y2038231.
单喜双,岳华梅,陈细华,叶欢,杨晓鸽,李创举. 2015. 达氏鲟生长激素基因cDNA克隆、表达及免疫荧光定位研究[J]. 水生生物学报,39(2):307-314. [Shan X S,Yue H M,Chen X H,Ye H,Yang X G,Li C J. 2015. cDNA cloning,expression and immunolocalization of growth hormone gene in Acipenser dabryanus[J]. Acta Hydrobio-logica Sinica,39(2):307-314.] doi:10.7541/2015.41.
苏慧,区又君,李加儿,王永翠,刘汝建,曹守花. 2012. 饥饿对卵形鲳鲹幼鱼不同组织抗氧化能力、Na+/K+-ATP酶活力和鱼体生化组成的影响[J]. 南方水产科学,8(6):28-36. [Su H,Ou Y J,Li J E,Wang Y C,Liu R J,Cao S H. 2012. Effects of starvation on antioxidative capacity,Na+/K+-ATPase activity and biochemical composition in juvenile Trachinotus ovatus[J]. South China Fisheries Scien-ce,8(6):28-36.] doi:10.3969/j.issn.2095-0780.2012.06. 005.
苏艳莉,戈贤平,孙盛明,朱健,张武肖,余含. 2017. 高温季节饥饿后补偿摄食对团头鲂幼鱼生长性能、血清生化指标、肠道消化酶活性及肝脏抗氧化酶活性的影响[J]. 动物营养学报,29(11):4198-4206. [Su Y L,Ge X P,Sun S M,Zhu J,Zhang W X,Yu H. 2017. Effects of compensatory feeding after starvation on growth performance,serum biochemical indexes,intestinal digestive enzyme activities and hepatic antioxidant enzyme activities of juvenile blunt snout bream (Megalobrama amblycephal) in summer[J]. Chinese Journal of Animal Nutrition,29(11):4198-4206.] doi:10.3969/j.issn.1006-267x.2017.11.044.
王晶晶,张新笑,卞欢,耿志明,李鹏鹏,王道营,徐为民. 2019. 麻鸭磷脂氢谷胱甘肽过氧化物酶高效可溶性表达及其部分酶学性质[J]. 南方农业学报,50(5):1120-1126. [Wang J J,Zhang X X,Bian H,Geng Z M,Li P P,Wang D Y,Xu W M. 2019. Highly efficient soluble expression and partial enzymatic properties of shelduck phospholipid hydroperoxide glutathione peroxidase[J]. Journal of Southern Agriculture,50(5):1120-1126.] doi:10.3969/j.issn.2095-1191.2019.05.28.
謝雨欣,张木子,黎明,袁莉霞,李冰,陈雨诗,王日昕. 2018. 氨氮胁迫下饥饿和再投喂对黄颡鱼幼鱼生长性能、血液健康、抗氧化能力及免疫应答的影响[J]. 动物营养学报,30(8):3073-3081. [Xie Y X,Zhang M Z,Li M,Yuan L X,Li B,Chen Y S,Wang R X. 2018. Effects of starvation and refeeding on growth performance,blood health,antioxidant capacity and immune response of juvenile yellow catfish under ammonia stress[J]. Chinese Journal of Animal Nutrition,30(8):3073-3081.] doi:10.3969/j.issn.1006-267x.2018.08.024.
徐蕾. 2019. 短期饥饿对翘嘴鳜肠道氧化应激及自噬的影响[D]. 桂林:广西师范大学. [Xu L. 2019. Effects of short-term fasting on the oxidative stress and autophagy in intestinal of Siniperca chuatsi[D]. Guilin:Guangxi Normal University.]
朱若岑,蒋维维,谭柱良,易金娥. 2015. 动物体内活性氧、氧化应激与细胞凋亡以及抗氧化剂研究进展[J]. 中兽医医药杂志,34(3):21-25. [Zhu R C,Jiang W W,Tan Z L,Yi J E. 2015. Progress of resctive oxygen spcies,oxidative strss,cell apoptosis and antioxidant in animals[J]. Journal of Traditional Chinese Veterinary Medicine,34(3):21-25.] doi:10.13823/j.cnki.jtcvm.2015.03.005.
Bayir A,Sirkecioglu A N,Bayir M,Haliloglu H I,Kocaman E M,Aras N M. 2011. Metabolic responses to prolonged starvation,food restriction,and refeeding in the brown trout,Salmo trutta:Oxidative stress and antioxidant defenses[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry & Molecular Biology,159(4):191-196. doi:10.1016/j.cbpb.2011.04.008.
Feng G P,Shi X T,Huang X R,Zhuang P. 2011. Oxidative stress and antioxidant defenses after long-term fasting in blood of Chinese sturgeon (Acipenser sinensis)[J]. Procedia Environmental Sciences,8:469-475. doi:10.1016/j.proenv.2011.10.074.
Furné M,García-Gallego M,Hidalgo M C,Morales A E,Domezain A,Domezain J,Sanz A. 2009. Oxidative stress parameters during starvation and refeeding periods in Adriatic sturgeon (Acipenser naccarii) and rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Nutrition,15(6):587-595. doi:10.1111/j.1365-2095.2008.00626.x.
Gune I E F,Georgescu S E,Dudu A,Bala M,Voicu S,Grecu I,Dediu L,Dinischiotu A,Costache M. 2021. Oxidative stress and antioxidant defense mechanisms in response to starvation and refeeding in the intestine of stellate sturgeon(Acipenser stellatus) juveniles from aquaculture[J]. Animals,11(1):76. doi:10.3390/ani11010076.
Hidalgo M C,Morales A E,Arizcun M,Abellán E,Cardenete G. 2017. Regional asymmetry of metabolic and antioxidant profile in the sciaenid fish shi drum (Umbrina cirrosa) white muscle. Response to starvation and refeeding[J]. Redox Biology,11:682-687. doi:10.1016/j.redox. 2017.01.022.
Lee J W,Choi Y C,Kim R,Lee S K. 2015. Multiwall carbon nanotube-induced apoptosis and antioxidant gene expression in the gills,liver,and intestine of Oryzias latipes[J]. BioMed Research International,2015:485343. doi:10. 1155/2015/485343.
Song H B,Xu D D,Tian L,Chen R Y,Wang L G,Tan P,You Q C. 2019. Overwinter mortality in yellow drum (Nibea albiflora):Insights from growth and immune responses to cold and starvation stress[J]. Fish & Shellfish Immunology,92:341-347. doi:10.1016/j.fsi.2019.06.030.
Varju M,Müller T,Bokor Z,Żarski D,Mézes M,Balogh K. 2018. The effects of excessive starvation on antioxidant defence and lipid peroxidation in intensively reared,commercial-size pikeperch(Sander lucioperca L.)[J]. Egyptian Journal of Aquatic Research,44(4):349-352. doi:10.1016/j.ejar.2018.11.003.
Yang S,He K,Yan T,Wu H,Zhou J,Zhao L L,Wang Y,Gong Q. 2019. Effect of starvation and refeeding on oxidative stress andantioxidant defenses in Yangtze sturgeon (Acipenser dabryanus)[J]. Fish Physiology Biochemistry,45(3):987-995. doi:10.1007/s10695-019-0609-2.
Zeng L Q,Li F J,Li X M,Cao Z D,Fu S J,Zhang Y G. 2012. The effects of starvation on digestive tract function and structure in juvenile southern catfish(Silurus meridionalis Chen)[J]. Comparative Biochemistry and Physiology. Part A:Molecular & Integrative Physiology,162(3):200-211. doi:10.1016/j.cbpa.2012.02.022.
Zhang X D,Wu T X,Cai L S,Zhu Y F. 2007. Influence of fasting on muscle composition and antioxidant defenses of market-size Sparus macrocephalus[J]. Journal of Zhejiang University. Science B,8(12):906-911. doi:10.1631/jzus.2007.B0906.
Zhang X D,Zhu Y F,Cai L S,Wu T X. 2008. Effects of fas-ting on the meat quality and antioxidant defenses of market-size farmed large yellow croaker (Pseudosciaena crocea)[J]. Aquaculture,280(1-4):136-139. doi:10.1016/j.aquaculture.2008.05.010.
收稿日期:2020-10-13
基金項目:四川省科技计划项目(2021YFYZ0015);长江上游鱼类资源保护利用四川省重点实验室开放基金项目(NJTCCJSYSYS07);四川省农业科学院前言学科研究基金项目(2019QYXK021);国家现代农业产业技术体系四川淡水鱼创新团队建设专项(2019-2023)
通讯作者:龚全(1979-),https://orcid.org/0000-0001-8044-9227,副研究员,主要从事鱼类增养殖及营养与免疫研究工作,E-mail:admiral671@163.com
第一作者:吴晓雲(1993-),https://orcid.org/0000-0002-7437-8327,主要从事鱼类增养殖及营养与免疫研究工作,E-mail:cloudyheaven@qq.com
1012501186288

