广东省医疗器械注册审评和核查现状分析
孙志刚 陈卓


摘 要:近年来,党中央国务院出台了一系列激励产业技术创新发展的政策,进一步完善了医疗器械行业的有关法律法规和政策,使我国医疗器械行业结构不断完善,具有自主知识产权的创新产品在国内医疗市场份额不断增加,医疗器械行业内的兼并、联合、重组日渐增多,企业的规模不断扩大,龙头企业的生长态势良好。本文就我省医疗器械行业发展现状、医疗器械监管法规制度、医疗器械注册管理现状、医疗器械注册审评审批情况进行分析,通过收集我省医疗器械注册审评和核查数据并进行分析,探索更高效、科学的审评、检查工作模式。
关键词:医疗器械监管;技术审评;注册核查
广东省医疗器械生产企业近4000多家,随着医疗器械新技术、新产品的不断发展,如何在保证产品安全有效的前提下,确保新产品及时上市,造福公众,推动医疗器械审评、检查工作科学化、规范化管理已成为亟需解决的问题。
1.广东省医疗器械注册审评审批情况
广东省是改革开放的排头兵、先行地、试验区,也是医疗器械大省强省,从目前广东省医疗器械产业发展情况来看,广东省医疗器械产业主要呈现出以下特点:
1.1、生产企业多,产业分布全面 2020年度全省实有医疗器械生产企业4368家,同比增加35.02%,一类2737家,其中一类企业数靠前的地市为广州、深圳、佛山,三个地市的总数为2031家,占全省的74.2%;二类2260家,三类226家。
医疗器械生产企业中,仅无菌275家,仅植入性25家,无菌/植入性297家,体外诊断试剂(IVD)177家,定制式义齿347 家,重点监管企业总数167家。
1.2、流通企业数量庞大,2020 年度全省共有二、三類医疗器械经营企业 147396 家,其中,仅经营二类医疗器械产品的企业 128319 家,仅经营三类医疗器械产品的企业 5007 家,同时从事第二、三类医疗器械经营的企业 14070 家。
1.3、注册品种覆盖面广,2020 年度,省内一类医疗器械产品备案凭证15215个,省内二类医疗器械产品注册证9692个,基本涵盖医疗器械主要品种门类。
1.4、产业集聚效应显现,广东省通过建立医疗器械产业园,积极促进产业集中化和规模化,为医疗器械产业的发展打造更为坚实的基础,医疗器械产业配套齐全,影响力辐射全国。
1.5、创新活跃,2020 年度,进入国家局创新特别审批程序产品6个,进入广东省第二类创新特别审批程序产品7个;进入国家局优先审批程序产品1个,进入广东省局优先审批程序产品5个。
1.6、政府重视,广东地方政府十分重视医疗器械产业,如广州、深圳、珠海、东莞、中山、佛山等多地政府将医疗器械产业纳入《广东省制造业高质量发展“十四五”规划》重点发展内容,出台大量的激励政策与措施。
2.广东省医疗器械注册审评审批情况分析
2.1受理情况
2020年广东省局共受理了医疗器械产品注册申请5621项,同比增加了67.99%。注册核发3077项,延续注册1576项,许可事项变更注册968项。2016年至2020年广东省第二类医疗器械申请受理情况如表1所示。其中,医疗器械(有源和无源类,不含疫情防控产品)2070项,注册核发917项,延续注册748项,许可事项变更注册405项,登记事项变更注册1018项;体外诊断试剂1464项,注册核发468项,延续注册565项,许可事项变更注册431项。2020 年度广东省第二类医疗器械(不含疫情防控产品) 注册申请受理情况如表2所示。
从以上表数据可以看出,2020年度广东省第二类医疗器械产品注册申请受理总数同比增长67.99%。
究其原因,主要是以下几个方面:
(1)随着我国日益加剧的人口老龄化、日益增长的各种疾病发病率、以及我国国内生产总值不断攀升后同步增长的国民高质量医疗需求,为我国医疗器械行业提供了巨大的发展机遇。
(2)国家局修订、发布了多批免于进行临床试验的医疗器械目录,其中免临床品种剧增。目录中对工作机理明确、设计定型、生产工艺成熟、已上市的同品种医疗器械临床应用多年且无严重不良事件记录的产品进行了汇总。多批目录的发布减少了企业在临床试验的人力、物力投入,缩短了注册周期,使得单元注册成本大大降低。
(3)受疫情影响,为保障民众的防疫物资,疫情防控产品申报数量成几何倍数增长。
(4)地方政府补贴力度大,如广州、深圳、珠海、东莞等地,企业研发生产的医疗器械取得产品注册证,给予不等的奖励。这些鼓励扶持政策极大激发了企业的研发、注册申报活力。
2.2审批情况
2020年广东省局共批准医疗器械产品注册4455项,同比减少了98.53%,注册核发2137项,延续注册1642项,许可事项变更注册676项登记事项变更注册996项。2016-2020 年广东省第二类医疗器械注册审批情况如表3所示。其中,医疗器械(有源和无源类)注册核发718项,延续注册707项,许可事项变更注册295项;体外诊断试剂注册核发547项,延续注册759项,许可事项变更注册313项。2020 年度广东省第二类医疗器械(不含疫情防控产品) 注册审批情况如表4所示。
3、广东省医疗器械注册体系核查基本情况
3.1受理情况
2020年广东省局共受理了医疗器械注册体系核查申请3163家次,同比增加了99.99%。其中,规范1989家次,无菌/植入附录492家次,体外诊断试剂附录625家次,义齿附录57家次。2016-2020年广东省医疗器械注册体系核查申请受理情况,如表5所示。
3.2完成情况
2020年广东省局共完成了医疗器械注册体系核查2975家次,同比增加100.60%。其中,规范1899家次,无菌/植入附录443家次,体外诊断试剂附录590家次,义齿附录43家次。2016-2020年广东省医疗器械注册体系核查完成情况见表6所示。
从以上体系核查数据可以进一步看到,规范及无菌/植入体系核查申报及完成量均大幅度增加,与规范及无菌/植入注册核发申请成正比。
4、广东省医疗器械注册其他事项基本情况
2020年广东省局共完成了说明书变更备案270项,完成量同比增长了14.89%。医疗器械分类界定初审完成了850项,完成量同比增长了-27.19%%;受理了第二类医疗器械省局创新界定初定20项,完成量同比增长了-23.07%,2016-2020广东省医疗器械说明书变更、分类界定和省局创新界定初定基本情况,如表7所示。
2020年分类界定完成量有所回落。首先因为疫情原因,很多企业的新项目,新想法因疫情推迟,导致申报数量有所下降。但是在医疗器械的大环境下,产品分类尤为重视。其中广东省局主动担当、积极作为,一方面在各种会议、各种场合反复向企业宣贯应重视并提前做好产品分类界定工作;另一方面刀刃向内,将医疗器械分类界定申请初审的办理时限由法定的20个工作日压缩40%至12个工作日,加快办理进度。为服务产业发展,避免企业因产品分类界定不明确而在产品注册/备案过程中多走弯路、错失良机。同时,广东省局通过积极派员参加国家局分类界定会议、加强与医疗器械标准管理中心沟通协调、虚心向兄弟省局学习请教等方法,不断提高自身的分类界定工作水平和能力,对于具有较大把握、不至于引起后续争议的分类界定申请,广东省局直接予以界定告知,为企业节省数月以上的等待时间,助力产品加快上市。
2020年广东省医疗器械生产企业虽然因疫情影响,数量有所回落,但是生产企业创先争优热情高涨。2018年10月1日实施的《广东省食品药品监督管理局第二类医疗器械优先审批程序》,一是重新梳理予以优先审批的情形,凸显保障临床急需,确保审评审批资源得到合理配置;二是原注册检验、技术审评提速20%的要求提高到40%,行政审批提速40%的要求提高到50%,以进一步实现急临床之需;三是对优先审批的申请流程进行优化,目的是更好地与全省许可信息系统衔接,实现自动缩减和监督办理时限;四是对优先审批申请所需提交的资料进行了明确,便于申请人申报准备。
5、广东省医疗器械审评和注册核查建议
5.1如何优化审评流程,进一步压缩审评时限;
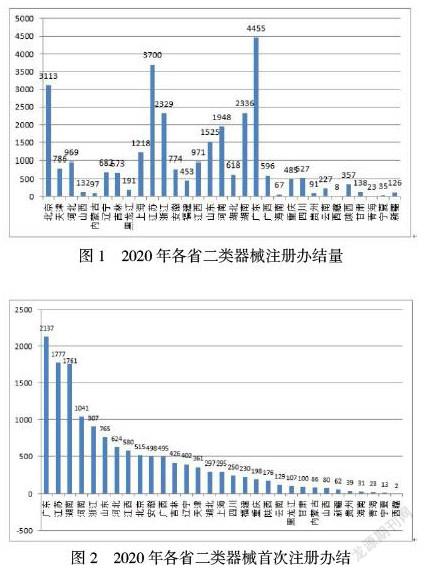
目前政府主导的审评资源不足。技术审评总量逐年攀升,但审评人员受编制限制无法增加,人均审评量居高不下。以广东省中心为例,2018至2020年的审评办结量分别为1191件、1412件、2519件(此件数包含不至于注册件数);2020年仅首次注册人均审评办结量就达到114件,已达到《食品药品监管总局关于加强省级医疗器械技术审评能力建设的指导意见》要求的人均审评量(30~50件)上限的2.28倍,更是高达其他医疗器械发达省(市)如5-7倍多。同时专职审评员,往往还是职业化检查员,在审评总量不断攀升、人均审评量巨大的情况下,为做好保质保量提速增效的要求,亟需增加审评人手。如图1、图2所示。
5.2如何畅通审评路径,加快创新优先产品上市;
新产品新技术不断涌现带来的风险挑战。医疗器械安全性、有效性评估涉及学科范围广、领域多、应用性强,尤其是近年来新产品新技术不断涌现,如人工智能、大数据、3D打印等,如何做到上市前以临床应用为导向,科学评价申报产品的风险受益,需要審评人员具有与之相应的素质及国内一流乃至国际化水准。审评人员队伍如何跟上行业发展的步伐,以及如何引领行业高质量发展,化解质量风险,是亟需解决的问题。因此,需要持续加强和完善审评人才队伍建设,加强技术、法规、创新复合人才培养,建设符合新时代发展要求的审评人员队伍。
5.3、如何结合已上市产品情况,优化注册体系核查;
建议考虑注册核查的告知承诺,由审评中心依企业申报注册事项的实际情况科学的启动注册核查,并确保核查启动时间不影响企业的注册进度,使注册核查更加有针对性。图3、图4 2018-2020年广东省二类医疗器械注册核查办结量及检查员抽选数量。
5.4、如何加强制度建设,进一步完善审评制度,完善责任划分。
在目前存量大、增量不断的情况下,需要进一步完善审评机制改革,以提升审评科学化水平,化解廉政风险和质量风险。探索建立“三分法”(分级、分路和分段)审评新模式,根据产品风险科学设计审评流程、合理配置审评资源。下一步建议参考国家局器审中心的集体决策机制,成立技术委员会及专业分会,对争议产品或疑难、共性问题实行重大事项集体商议决策,助推审评要求和结论更加科学合理。
参考文献:
[1]中华人民共和国国务院令.医疗器械监督管理条例[EB/OL][2021.- 4.-24]https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20210319202057136.html
[2]中华人民共和国国务院办公厅.关于建职业化专业化药品检查员队伍的意见[EB/OL][2021.-4.-24]http://www.gov.cn/zhengce/content/ 2019-07/18/content_5411172.htm

