溶剂蒸发法制备丙硫菌唑微囊及其性能研究
陈歌,曹立冬,许春丽, 赵鹏跃,曹冲,李凤敏,黄啟良
溶剂蒸发法制备丙硫菌唑微囊及其性能研究
陈歌,曹立冬,许春丽, 赵鹏跃,曹冲,李凤敏,黄啟良
中国农业科学院植物保护研究所,北京 100193
【】以生物可降解材料聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(P(3HB-co-4HB))为壁材制备丙硫菌唑微囊,研究制备工艺对微囊粒径、载药量及包封率的影响,筛选出分散性好、粒径较小、载药量高的配方,并对其释放动力学、光降解、对花生白绢病菌()室内生物活性等性能进行初步研究和表征,为提高丙硫菌唑在环境中的稳定性及利用率提供理论指导和技术支撑。采用溶剂蒸发法制备丙硫菌唑微囊,通过单因素试验探究芯壁材质量比、油水体积比、乳化剂质量分数和剪切速率对微囊粒径、载药量和包封率的影响;以载药量与粒径为关键技术指标,通过L9(34)正交试验筛选出最优制备工艺参数,并对正交试验结果进行验证;通过扫描电镜(SEM)、傅里叶红外光谱(FTIR)、高效液相色谱(HPLC)和室内毒力测定对微囊的外观形貌、释放性能、光稳定性能以及对花生白绢病菌的室内生物活性进行研究。芯壁材质量比对微囊的载药量有显著影响,随着芯材质量的增大,载药量逐渐增大;油水体积比、PVA质量分数、剪切速率对微囊粒径具有显著影响,随着剪切速率与PVA质量分数的增大,微囊粒径逐渐减小,油水体积比对微囊形态及分散性影响较大。试验中各因素对微囊包封率的影响并不显著。通过L9(34)正交试验配方优化获得最佳制备工艺:芯壁材质量比1﹕5,油水体积比1﹕5,PVA质量分数2%和剪切速率12 000 r/min。在最佳制备工艺条件下制备了粒径(D50)为3.32 μm、跨距为2.82,分散性良好的球形丙硫菌唑微囊,载药量为15.52%,包封率为80.24%。该微囊具有较好的缓释性能,其释放动力学符合Fick扩散规律,呈现先“突释”后“缓释”两个过程。与原药相比,丙硫菌唑微囊在水溶液中的光稳定性增强,光解半衰期延长了一倍。菌丝生长抑制试验表明其对花生白绢病菌的抑制活性与原药相当。以生物可降解材料P(3HB-co-4HB)为载体制备丙硫菌唑微囊,不同制备工艺影响微囊的载药量、分散性和粒径大小,其缓释及光稳定性能对减少农药施用量、提高农药利用率具有重要意义。丙硫菌唑微囊在花生白绢病的防治方面具有良好的应用前景。
丙硫菌唑;聚羟基丁酸酯;微囊;制备工艺;控制释放;花生白绢病菌
0 引言
【研究意义】农药在防治农作物病虫草害、保障粮食安全等方面发挥了重要的作用。然而,由于风吹、日晒、雨淋等自然环境的影响易造成农药有效成分降解和流失(飘移、淋溶、挥发等),降低了农药利用率,并对环境产生一定影响[1-2]。丙硫菌唑(prothioconazole)是新型广谱三唑硫酮类脱甲基化抑制剂杀菌剂[3],具有良好的内吸活性,同时具有优异的治疗、保护和铲除性能,持效期长,在全球杀菌剂,尤其是谷物用杀菌剂市场居于领先地位[4-5]。自2004年首次获得登记以来已在全球60多个国家登记并销售。然而,丙硫菌唑在水溶液中见光易分解,且对施药人员存在健康风险[6]。因此,利用先进的材料和制备工艺进行丙硫菌唑剂型优化,对于提高其环境稳定性和利用率、降低对施用者的健康风险具有重要的理论和实际应用价值。【前人研究进展】目前,国内外丙硫菌唑的剂型主要为悬浮剂、乳油和可分散油悬浮剂[7]。许春丽等[8]以荧光介孔二氧化硅为载体制备了丙硫菌唑纳米载药颗粒,该载药颗粒具有良好的缓释性能,表现出与原药相当的毒力效果,材料的荧光性能有助于研究农药在靶标中的吸收和传导情况。然而,荧光介孔二氧化硅制备成本较高,限制其在实际生产中的应用。近年来,具有良好产业化前景的农药微囊剂型已经成为研究的热点,利用生物可降解材料为壁材,对农药进行微囊化,可有效解决农药活性成分释放快、持效时间短、易光解及对人畜的刺激性和毒性等问题[9]。Tsuji[10]报道了微囊化可抑制农药的蒸发,降低施药人员的暴露量和健康风险。目前农药微囊的制备方法主要分为界面聚合法、原位聚合法、乳液聚合法、溶剂蒸发法、纳米沉淀法、凝聚相法和喷雾干燥法等[11-12]。其中溶剂蒸发法制备微囊操作简单,不需要相分离剂,具有体系稳定、温度改变小、溶剂可回收和残留低等优点[13-14]。因此,溶剂蒸发法可以作为制备农药微囊的绿色环保方法。聚羟基脂肪酸酯(PHA)是目前唯一一种由微生物直接合成的生物基聚酯,能够实现材料合成、制品加工和回收降解的全周期绿色生态循环,已广泛应用于医学、工业等领域[15]。PHA作为农药载体在杀菌剂腐霉利、乙烯菌核利、戊唑醇,杀虫剂马拉硫磷及除草剂苯磺隆、莠去津、莠灭净、草克净等均有报道[16]。CAO等利用PHA制备了氟乐灵微囊[17]和吡唑醚菌酯微囊[18],研究表明农药的释放主要是基质降解后的自发扩散并以缓慢释放为主,且氟乐灵微囊显著提高了氟乐灵的光稳定性及除草活性,吡唑醚菌酯微囊对稻瘟病的防治效果与原药相当。【本研究切入点】丙硫菌唑微囊化剂型未见报道。充分发挥农药微囊化和PHA的优点制备PHA丙硫菌唑微囊,并深入考察微囊制备工艺及微囊化对丙硫菌唑性能提升的影响。【拟解决的关键问题】利用生物可降解材料聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(P(3HB-co-4HB))为壁材,通过乳化溶剂蒸发法制备丙硫菌唑微囊,通过单因素试验、正交试验研究制备参数对微囊粒径、载药量和包封率的影响,确定最佳制备工艺;通过释放动力学、光解和室内毒力测定,明确丙硫菌唑微囊化对其性能提升的影响,为克服丙硫菌唑应用过程中的局限性提供理论指导。
1 材料与方法
试验于2018—2019年在中国农业科学院植物保护研究所完成。
1.1 试剂
丙硫菌唑原药(99%,四川华英化工有限公司);聚乙烯醇(PVA-124,国药集团化学试剂有限公司);甲醇(色谱纯,国药集团化学试剂有限公司);三氯甲烷(北京化工厂);聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(山东意可曼科技有限公司);透析袋(相对截留分子质量为8 000—14 000,北京索莱宝科技有限公司);供试花生白绢病菌()由中国农业大学植物保护学院植物病理学实验室提供,试验用水均为超纯水。
1.2 仪器
DF-101S集热式恒温加热磁力搅拌器(巩义市英峪仪器厂);IKA T25型高速分散机(德国IKA集团);日立Regulus 8100冷场发射扫描电子显微镜(日本日立公司);高效液相色谱仪Agilent 1260(美国安捷伦科技有限公司);BT-9300ST型激光粒度分布仪(丹东百特有限公司);KQ-500DE 型数控超声波清洗器(昆山市超声波仪器有限公司);恒温培养箱(上海圣科仪器设备有限公司);TG20-WS离心机(长沙湘智离心机仪器有限公司);CX22光学显微镜(日本奥林巴斯公司);FD-1-50型真空冷冻干燥机(北京博医康实验仪器有限公司)等。
1.3 试验方法
1.3.1 丙硫菌唑微囊的制备 采用O/W(油相/水相)型乳化溶剂蒸发法制备丙硫菌唑微囊[19-20]。具体方法如下:分别准确称取一定量的丙硫菌唑原药(图1)和P(3HB-co-4HB)(图2),用三氯甲烷溶解分别配制成质量浓度为50 mg·mL-1的溶液,两者按一定的比例混合为油相;准确称取一定量的PVA加至去离子水中,90℃加热搅拌使其溶解,冷却后配制成一定质量浓度的PVA水溶液为水相;按照设定的油水相体积,将油相倒入水相混合置于烧杯中,高速剪切5 min;将剪切后的均质乳化液于40℃搅拌蒸发有机溶剂;待溶剂蒸发完全,在10 000 r/min下离心10 min,用去离子水洗涤沉淀3次,于低温冷冻干燥机内冷冻干燥48 h,即得丙硫菌唑微囊粉末,干燥储存。以相同条件制备P(3HB-co-4HB)未载药微囊。

图1 丙硫菌唑结构式
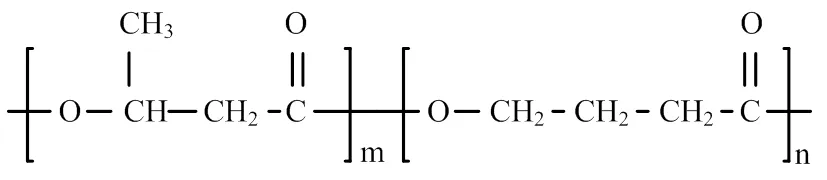
图2 聚(3-羟基丁酸酯-co-4-羟基丁酸酯)结构式
1.3.2 丙硫菌唑微囊性能 微囊形貌表征:取适量微囊粉末稀释成微囊悬浮液于光学显微镜下观察其外貌形态;取干燥微囊粉末涂抹在双面胶带上,经离子镀膜仪喷金,喷金厚度为6—8 nm,采用扫描电子显微镜(SEM)观察其表面形态。
微囊粒径分布及测定:利用激光粒度分析仪测定其微囊悬浮液的粒径大小及分布,由公式(1)计算跨距。
跨距=(D90-D10)/D50(1)
式中,D10、D50和 D90分别表示微囊累积粒度分布百分数为10%、50%和90%时所对应的粒径;跨距值越小,微囊的单分散性越好,粒径分布越窄,反之,跨距值越大,则单分散性越差,粒径分布越宽。
红外光谱分析:取适量溴化钾分别与干燥的丙硫菌唑原药、未载药微囊和丙硫菌唑微囊混合均匀,压片,采用傅里叶变换红外光谱仪进行分析。
微囊载药量与包封率测定:取0.025 g(精确至0.0001 g)微囊置于50 mL容量瓶中,用甲醇超声定容至50 mL,将悬浮液超声处理30 min。于离心机内10 000 r/min离心5 min,收集上清液过0.22 μm滤膜,利用高效液相色谱仪(HPLC)进行丙硫菌唑载药量和包封率测定。分别采用公式(2)和(3)测定丙硫菌唑微囊载药量和包封率:


高效液相色谱分析条件:流动相V(甲醇)﹕V(0.2%甲酸水)= 80﹕20,流速l.0 mL·min-1;Waters sunfire-C18色谱柱(4.6 mm×250 mm,5 μm);紫外检测器波长260 nm;柱温30℃;进样体积5 μL。
1.3.3 单因素试验设计 考察乳化溶剂蒸发法中微囊制备的工艺条件芯壁材质量比、油水体积比、乳化剂PVA质量分数和剪切速率对微囊粒径大小、载药量和包封率的影响(表1)。设芯壁材质量为1﹕5,油水体积比1﹕5,PVA质量分数为1%,剪切速率为12 000 r/min为基准条件,分别考察单个因素水平对微囊粒径、包封率、载药量的影响。每个试验重复3次。

表1 单因素试验水平表
1.3.4 正交试验设计筛选最优配方 采用L9(34)正交试验,考察各因素之间的相互关系对微囊工艺的影响并筛选乳化溶剂蒸发法制备丙硫菌唑微囊最佳制备工艺条件。选取芯壁质量比、油水体积比、PVA质量分数和剪切速率4个因素作为考察对象,每个因素选择3个水平,以载药量和粒径为考察指标,在测试条件下筛选丙硫菌唑微囊的最佳制备工艺。其因素水平见表2。

表2 正交试验因素水平表
A:芯壁材质量比Mass ratio of core to wall;B:油水体积比Volume ratio of oil to water;C:PVA质量分数Mass fraction of PVA (%);D:剪切速率Shearing speed (r/min)。表7、表8同 The same as Table 7, Table 8
1.3.5 微囊缓释性能 采用透析袋法[21]研究丙硫菌唑原药与最优制备工艺条件下丙硫菌唑微囊的释放性能。将一定质量样品浸入含200 mL 30%甲醇水溶液的密封容器中,室温下于转速200 r/min搅拌,每隔一段时间取一定体积上清液,每次取样后立即补充相同体积缓冲溶液,通过HPLC测定丙硫菌唑的释放量。按公式(4)计算丙硫菌唑累积释放量并绘制累积释放曲线。
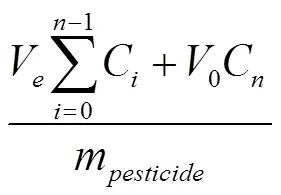
:累积释放量(%);:每次取样体积(1 mL);C:第i次取样时释放液的浓度(mg·mL-1);V:释放介质总体积(200 mL);:第次取样释放液的浓度(mg·mL-1);:取样次数;m:丙硫菌唑微囊有效成分的总质量(mg)。
1.3.6 微囊水中光解 取一定量的丙硫菌唑微囊,分散于30 mL 0.2%吐温-80水溶液中,置于具塞石英管内,以高压氙灯作为光源,辐照度为25 mW·cm-2,石英管距光源10 cm,启动转动电机并不断搅拌使反应液均匀受光,温度保持在(20±1)℃,待光解仪稳定后进行光解试验。光照不同时间后分别取样1 mL,用甲醇稀释后超声处理30 min,过0.22 μm滤膜后用HPLC检测丙硫菌唑浓度(mg·L-1)。以丙硫菌唑原药作为对照。每个试验重复3次。
农药在溶液中光化学降解可按一级反应动力学方程进行描述,其光解动力学方程及半衰期计算公式如(5)和(6):
Ct=C0e-kt(5)
T1/2=ln2/k (6)
式中,Ct为t时刻反应液中丙硫菌唑的质量浓度(mg·L-1),C0为丙硫菌唑的初始质量浓度(mg·L-1),k为光解速率常数(min-1),T1/2为光解半衰期(min)。
1.3.7 室内生物活性测定 采用菌丝生长速率法[22]测定丙硫菌唑微囊对花生白绢病菌的杀菌活性。将丙硫菌唑微囊分别使用二甲基亚砜(DMSO)、无菌水配制成相同浓度的母液,使用无菌水进行稀释配制不同浓度的工作溶液。依次定量吸取不同浓度的药液分别加入马铃薯葡萄糖琼脂(PDA)培养基中,充分摇匀,然后倒入直径为90 mm培养皿中,制成浓度分别为2.5、5、10、20和40 mg·L-1的含药平板。丙硫菌唑原药用DMSO溶解,无菌水稀释作为对照。将培养好的花生白绢病菌接种于含药平板中央,置于25℃培养箱中。当空白处理菌落直径接近长满培养皿直径时,采用“十字交叉法”测量各处理菌落直径,取其平均值按公式(7)计算菌丝生长抑制率。


1.3.8 数据统计与分析 各试验因素对微囊性能的研究指标以平均值±标准误(mean±SE)表示,通过SPSS 22.0软件采用Duncan氏新复极差法进行差异显著性分析。测量的数据采用Excel和Origin 9.1软件统计分析并绘制丙硫菌累积释放曲线。通过Origin 9.1软件拟合方程,得到k值,通过降解动力学方程,计算半衰期。
2 结果
2.1 单因素试验
2.1.1 PVA质量分数对丙硫菌唑微囊性能的影响 随着PVA质量分数的增大,乳状液体系逐渐达到稳定,微囊粒径呈减小的趋势,跨距也逐渐减小,微囊粒径D50由4.61 µm减至2.55 µm,单因素方差分析表明其对微囊粒径的影响显著。在0.5%—2%范围内,PVA质量分数对微囊载药量和包封率的影响并不显著,分别为15.12%—15.69%和77.47%—80.47%(表3)。
2.1.2 芯壁质量比对丙硫菌唑微囊性能的影响 随着芯壁质量比由1﹕20增至1﹕5,载药量由4.66%逐渐增至15.31%,微囊粒径D50由4.33 µm逐渐减至3.46 µm,包封率由71.72%增至77.04%。由单因素方差分析可知,芯壁质量比对微囊粒径和载药量的影响显著,对包封率的影响不显著(表4)。
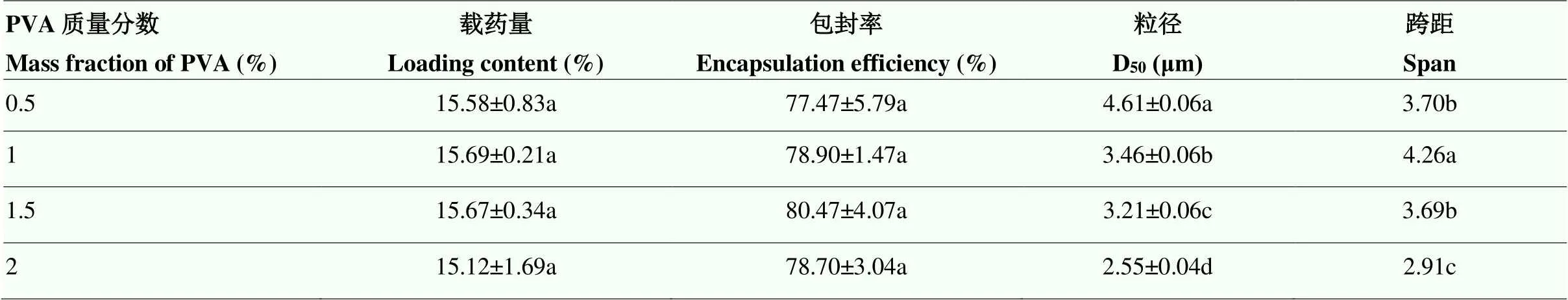
表3 PVA质量分数对微囊性能的影响
同列数据后不同小写字母表示经Duncan氏新复极差法检验在<0.05水平差异显著。下同
Different lowercases after the data in the same column indicate significant difference at 0.05 level by Duncan’s new multiple range test. The same as below
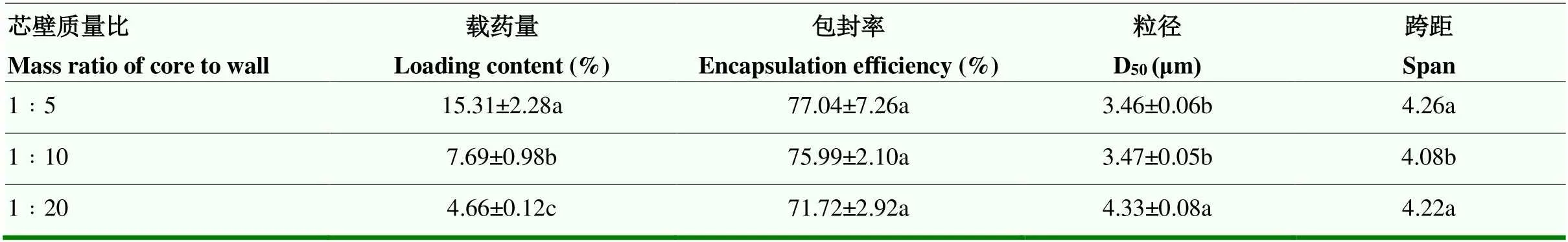
表4 芯壁质量比对微囊性能的影响
2.1.3 油水体积比对丙硫菌唑微囊性能的影响 油水体积比由1﹕5降至1﹕20,载药量为14.82%—15.38%,包封率67.07%—76.98%,粒径2.65—3.46 µm。由单因素方差分析可知,油水体积比对微囊粒径有显著的影响,对微囊载药量与包封率影响不显著(表5)。油水体积比对形成稳定的乳液具有很大的影响,当比例过小时,在溶剂蒸发过程中,乳化液滴变得不稳定,易导致微囊发生聚结,造成微囊成囊率降低。
2.1.4 剪切速率对丙硫菌唑微囊性能的影响 随着剪切速率的增大,微囊粒径逐渐减小,跨距先增后减。单因素方差分析表明,剪切速率对微囊粒径的影响显著,对微囊载药量和包封率的影响不显著,分别为15.29%—15.84%和77.88%—78.33%(表6)。
2.2 正交试验结果
以粒径和载药量为筛选试验工艺的关键指标,采用极差法和综合平衡法对L9(34)正交试验结果进行分析(表7、表8)。结果表明,各因素对载药量的影响程度依次为芯壁比>油水体积比>剪切速率>PVA质量分数;对粒径的影响由大到小的因素:剪切速率>PVA质量分数>芯壁材质量比>油水体积比(表8)。综合载药量与粒径进行考虑,其最佳制备工艺条件为A3B3C3D3,即芯壁比为1﹕5,油水体积比1﹕5,PVA质量分数2%,剪切速率为12 000 r/min。
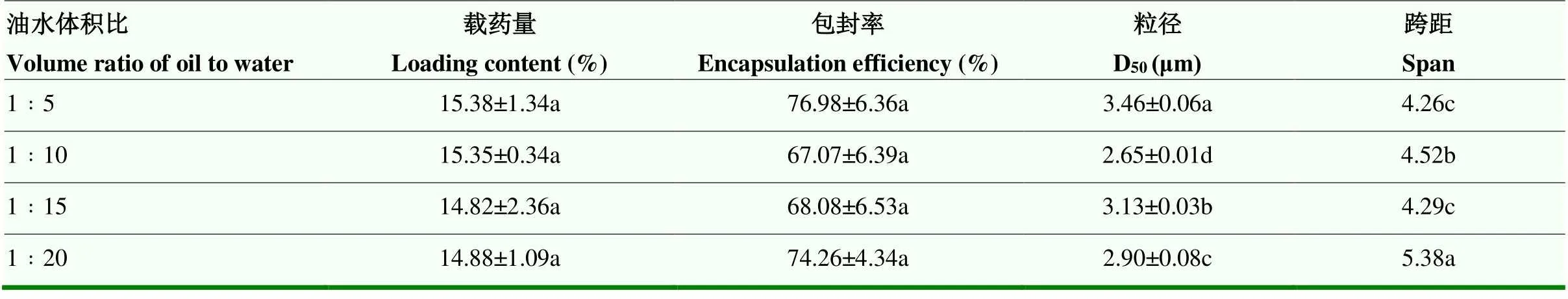
表5 油水体积比对微囊性能的影响

表6 乳化剪切速率对微囊性能影响
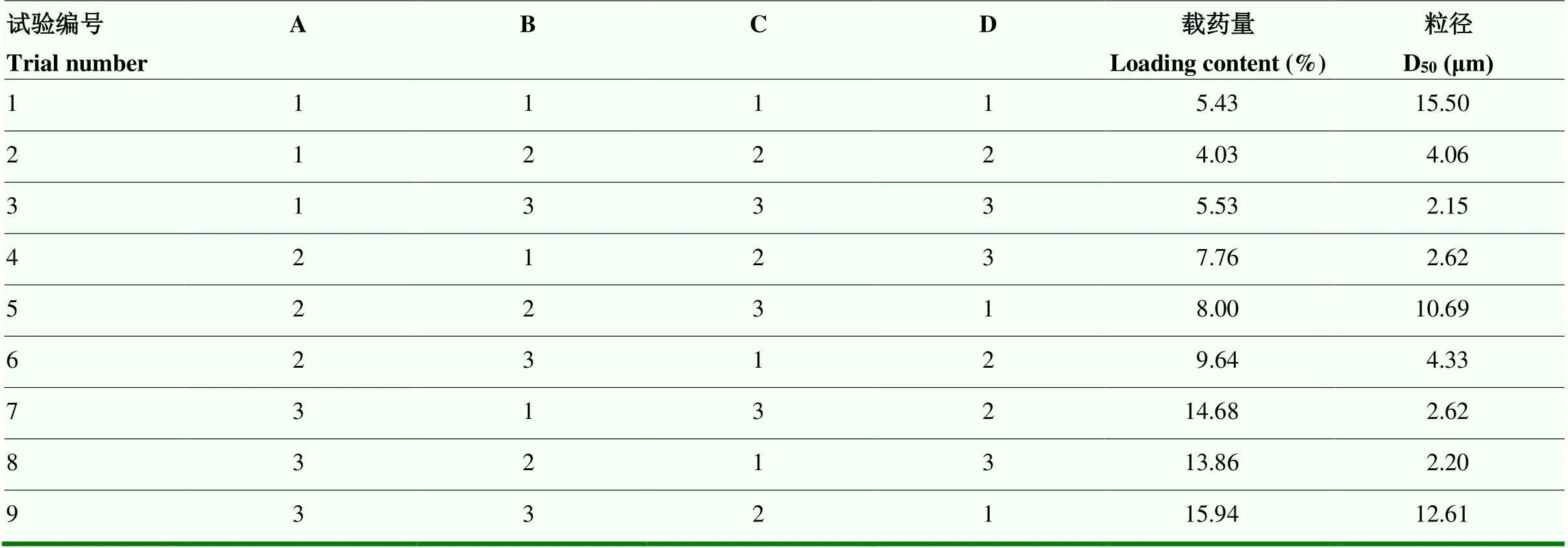
表7 正交试验结果

表8 正交试验极差分析
2.3 工艺验证
按上述最佳工艺条件(A3B3C3D3)进行3次丙硫菌唑微囊制备,测得3次平均粒径D50为3.32 μm,跨距为2.82,载药量为15.52%,包封率为80.24%;与正交表中的试验结果进行比较,符合其试验分析结果,表明优选条件合理,该工艺制备条件最佳。
2.4 微囊形貌观察
最佳制备工艺条件下得到的微囊为彼此没有黏连流动性良好的粉末状固体,扫描电镜结果显示其为表面较为光滑、粒径较为均匀的球形微囊,较大粒径的微囊表面出现了凹陷(图3)。制备工艺中油水体积比对微囊的分散性能影响显著。通过光学显微镜观察可以看出,随着油水体积比的减小,微囊易发生聚结,使微囊跨距逐渐增大(图4)。图5为单因素试验中油水体积比为1﹕20时的微囊SEM观察图,当对其微囊局部放大后,可以观察到微囊之间彼此黏连,并未形成分散性良好的球形微囊。
2.5 红外光谱分析
由图6可见,丙硫菌唑原药在3 000 cm-1处出现苯环C-H键不对称伸缩振动吸收峰,1 560 cm-1为苯环骨架伸缩振动,750 cm-1为C-Cl键的伸缩振动。载药微囊在1 560和750 cm-1显示出丙硫菌唑的特征峰;未载药微囊在1 735 cm-1处有较大的吸收峰,由C=O键不对称伸缩振动引起。载药微囊与空载体相比,1 735 cm-1处的吸收峰出现了蓝移,可能受到了丙硫菌唑的影响。丙硫菌唑原药特征的1 560和750 cm-1吸收峰在载药微囊中出现,表明丙硫菌唑已成功包埋在P(3HB-co-4HB)载体中。
2.6 释放动力学
从丙硫菌唑原药和微囊的累积释放曲线(图7)可以看出,室温下原药释放20 h后不再释放,累积释放率为45%。丙硫菌唑微囊在前20 h释放较快,之后缓慢释放,84 h时累积释放率达到84%。为了揭示药物从缓控释体系中释放的机理或释放动力学,一般将释放数据进行数学模型的拟合。利用Origin软件对累积释放数据分别进行零级、一级、Higuchi、Ritger- Peppas释放拟合[23],其拟合结果见表9。由回归方程分析,丙硫菌唑原药的释放(决定系数2=0.9727)更符合一级动力学方程,为扩散释放。丙硫菌唑原药受其外观形态、晶型及溶解性能的影响,其释放过程受丙硫菌唑浓度的影响。丙硫菌唑微囊释放更符合Higuchi(2=0.9596)与Ritger-Peppas(2= 0.9622)方程。当芯材均匀分布在整个微囊中或者部分芯材分布在外壁中,其释放动力学更符合Higuchi拟合方程,微囊释放的芯材质量与时间的平方根成正比,释放机理是Fick扩散[24]。Ritger-Peppas方程的对数形式为:lg (Mt/M∞)=lgk+nlgt,其中,Mt/M∞为药物累积释放百分率,k为药物释放速率常数,n为扩散指数。根据n的数值可以推断释放机理的类型,当n≤0.45时,药物释放以Fick扩散为主;当0.45<n<0.89时,释放以非Fick扩散为主,药物释放呈现扩散和溶蚀并存;当n>0.89时,以载药体系骨架的溶蚀而释放药物为主[25]。丙硫菌唑微囊释放Ritger-Peppas拟合方程n=0.42,属于Fick扩散。丙硫菌唑释放呈现先“突释”后“缓释”两个过程,“突释”比“缓释”速率大,其属于Fick扩散。方程拟合结果证明了P(3HB-co-4HB)丙硫菌唑微囊具有缓释作用。

图3 丙硫菌唑微囊扫描电镜图
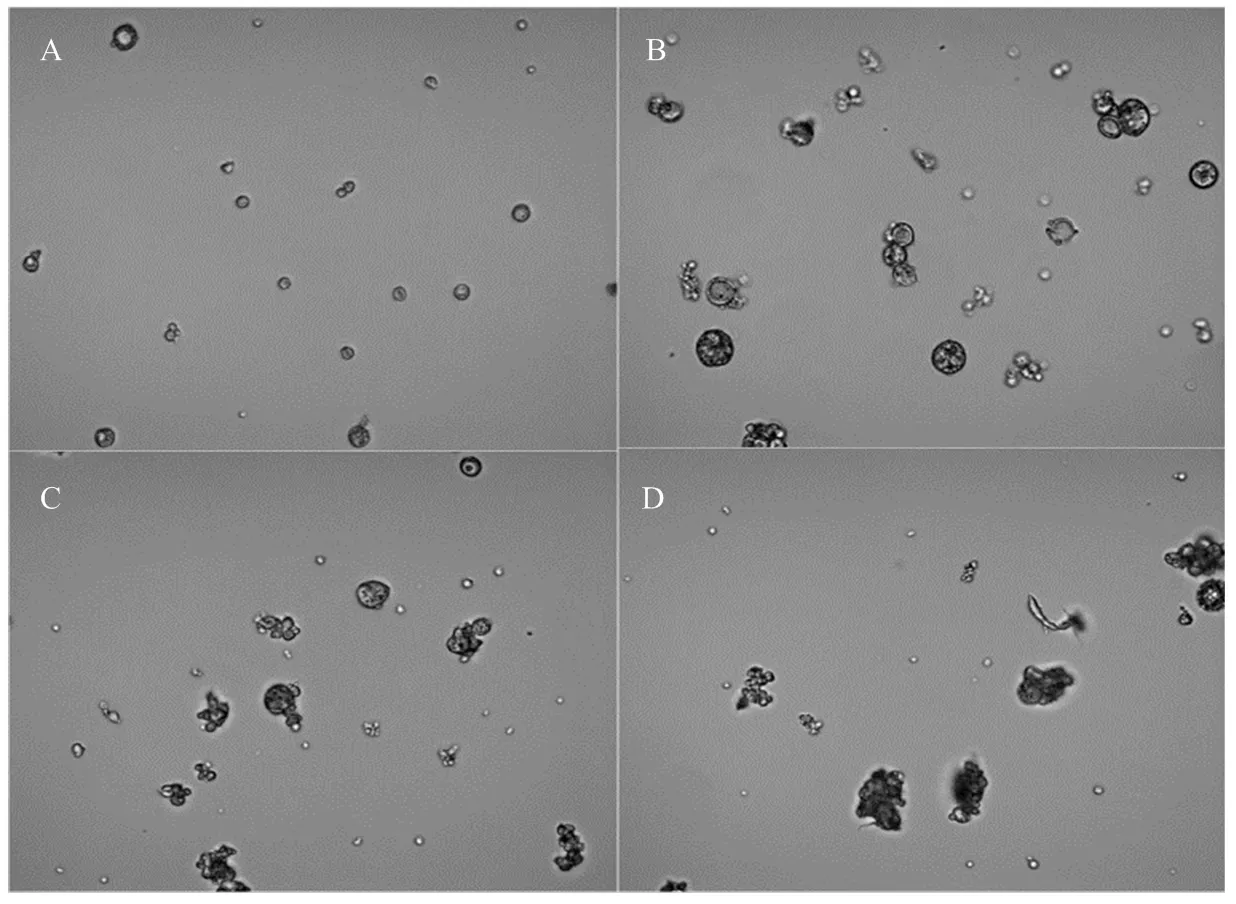
A: 1﹕5; B: 1﹕10 ; C: 1﹕15; D: 1﹕20

图5 油水体积比1﹕20丙硫菌唑微囊扫描电镜图
2.7 水中光解
用一级反应动力学模型对丙硫菌唑原药和微囊在水中的光降解反应进行拟合分析,光解曲线如图8所示,拟合结果见表10。结果表明,丙硫菌唑的光降解反应符合一级反应动力学(2介于0.975—0.997),在高压氙灯的照射下,丙硫菌唑微囊的光解半衰期为1.52 h,而丙硫菌唑原药的半衰期为0.76 h。丙硫菌唑微囊化可显著降低其在水环境中的光解速率,提高其稳定性。

表9 丙硫菌唑原药和微囊缓释曲线拟合结果
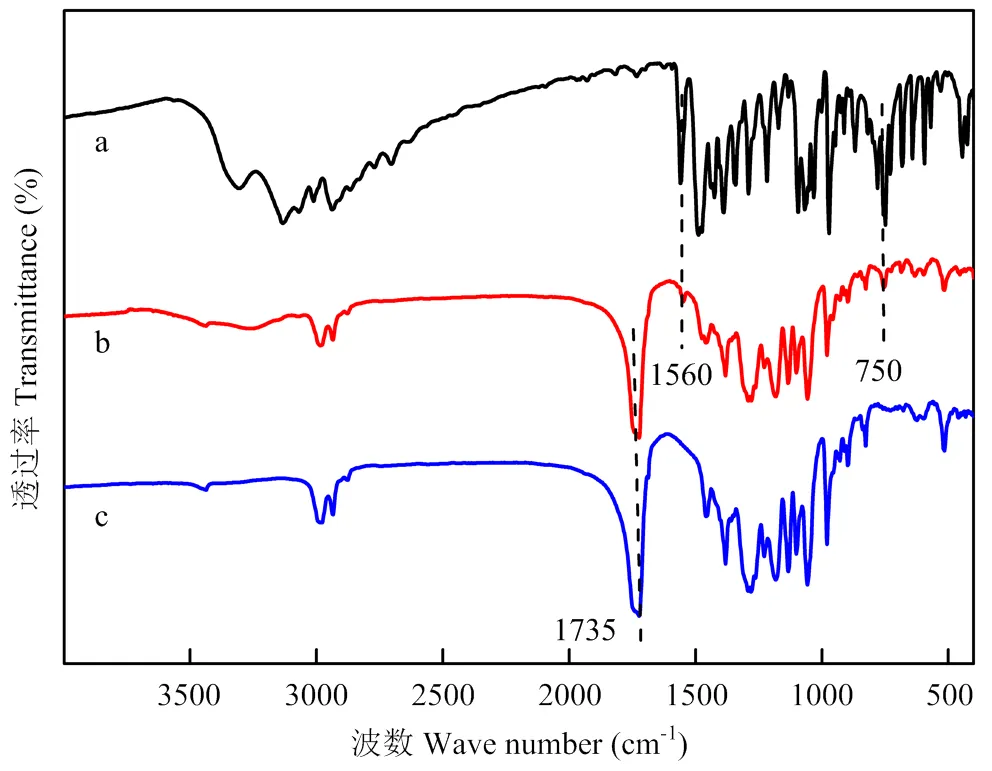
图6 丙硫菌唑原药(a)、丙硫菌唑微囊(b)和未载药P(3HB-co-4HB)微囊(c)红外光谱图
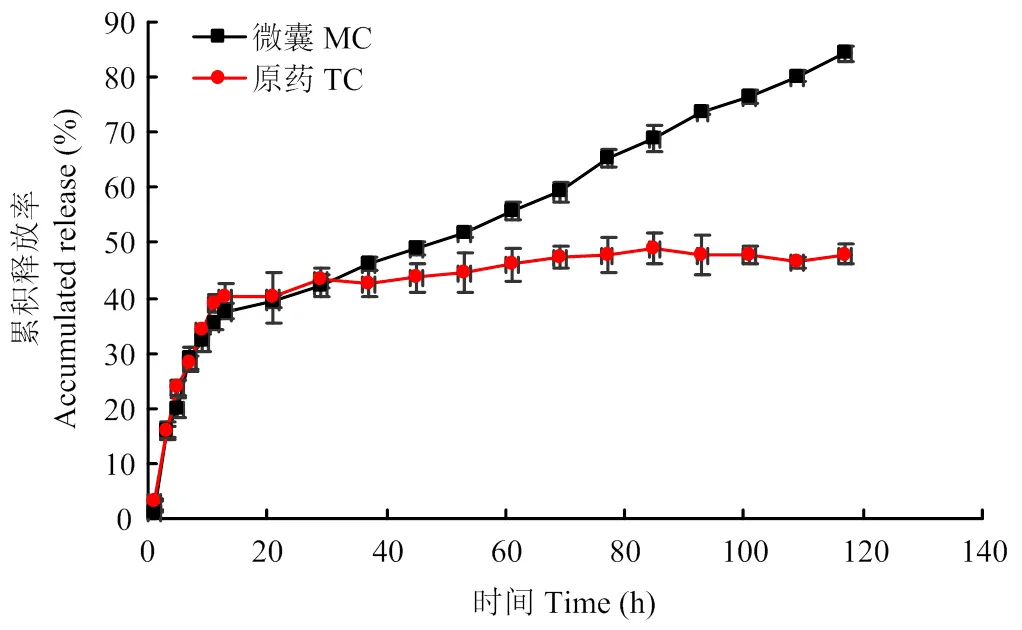
图7 丙硫菌唑原药和微囊缓释曲线
2.8 室内毒力测定
为明确丙硫菌唑微囊化仍然保持有效成分的活性,采用菌丝生长抑制试验进行室内毒力测定。微囊分别采用DMSO和无菌水进行母液配制。在测试质量浓度范围内,丙硫菌唑测试药剂对花生白绢病菌菌丝生长表现出显著的抑制作用。当采用DMSO配制微囊母液时,微囊壁材因溶解于DMSO而导致微囊破壁,微囊中的丙硫菌唑游离释放出来,与原药具有基本一致的溶液浓度。质量浓度为40 mg·L-1的丙硫菌唑原药与微囊对花生白绢病菌的抑制率分别为94.70%和92.98%,其毒力效果相当,在其他低浓度情况下也具有同等毒力。当采用无菌水配制微囊母液时,由于丙硫菌唑在水中具有一定的溶解度,微囊表面和初始阶段释放出来的丙硫菌唑可以发挥杀菌活性的作用。当微囊均匀分布在PDA培养基中,由于缺少液体释放介质,微囊内部的丙硫菌唑释放非常缓慢。因此,在低浓度时,无菌水配制的微囊溶液具有与原药相当的生物活性,当浓度较高时,由于水中溶解度和释放的限制,对靶标病原菌的抑制率低于同等浓度的原药(表11)。

图8 丙硫菌唑原药和微囊水中光解曲线
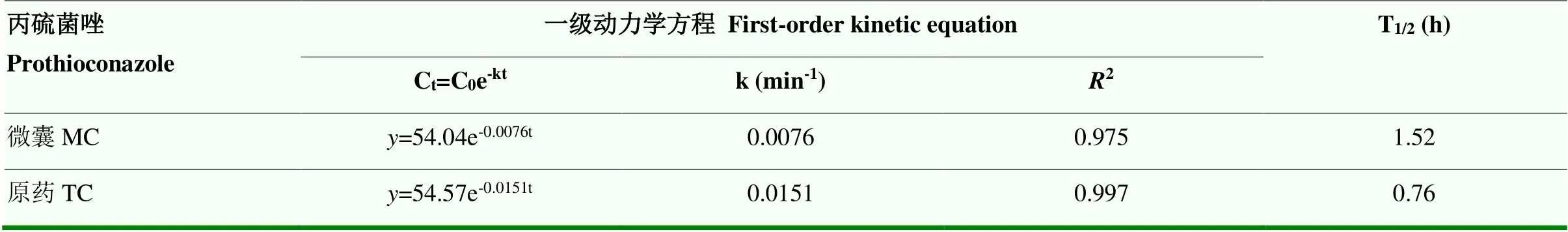
表10 丙硫菌唑原药和微囊水中光解动力学
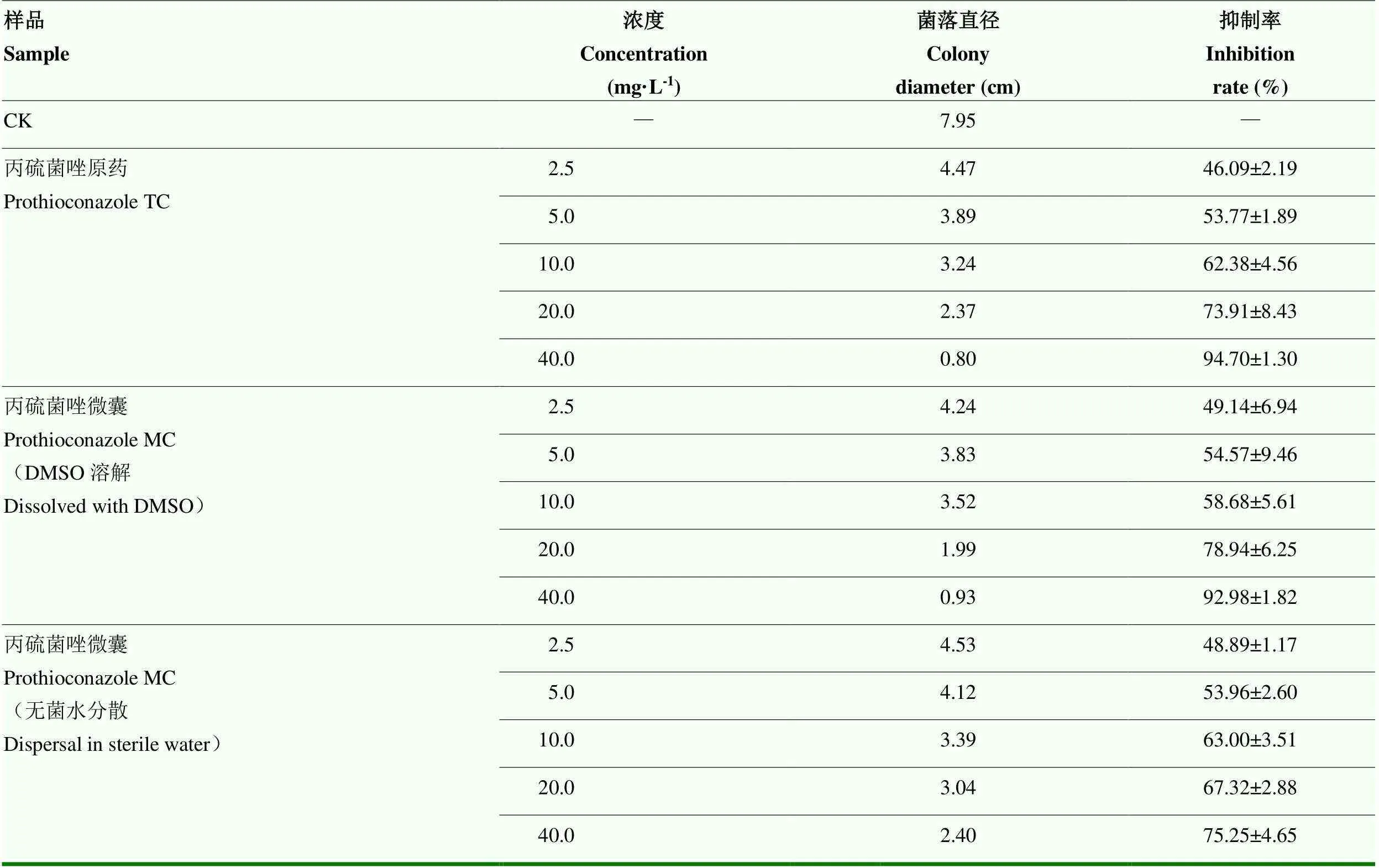
表11 丙硫菌唑原药和微囊对花生白绢病菌的毒力
3 讨论
3.1 制备工艺的筛选
农药微囊的制备工艺会对微囊形态、粒径及分布、载药量、包封率及缓释性能等理化性质产生影响,一套完善而可行的制备工艺对微囊的工业化生产具有重要意义。在微囊最佳制备工艺条件下,微囊呈球形且分散性良好。由SEM观测到在某些粒径较大的微囊表面出现凹陷,可能是在溶剂挥发过程中,微囊之间以及微囊与搅拌磁子之间的碰撞所致[26]。载体P(3HB-co-4HB)具有较宽的分子量分布,在溶剂蒸发时可能存在非均相沉析现象,高分子量链段首先析出,而低分子量链段后析出,导致微囊内外部出现微孔及表面产生皱缩现象,Embleton等[27]也观察到类似现象。
PVA具有乳化剂及分散剂双重作用,其质量分数增加连续相黏度增大,能够防止乳滴聚合,导致微囊粒径减小[28-31]。乳化剂用量对微囊包封率没有显著影响[32],但对微囊形态影响较大,乳化剂用量过大或者不足均会造成微囊乳状液不稳定。当PVA浓度过大,乳状液黏稠,微囊难以离心分离,溶剂蒸发与干燥过程中微囊会黏结、形成形状不规则的团聚体,使微囊收得率降低。随着芯壁质量比增加,包裹在丙硫菌唑液滴周围壁材的量逐渐减少,囊壁的厚度逐渐变薄,芯材所占比重增大,载药量呈递增趋势[33]。随着剪切速率的增大,微囊粒径及其分布逐渐减小,其变化规律与文献报道一致[34-36]。油水体积比例在合适范围内降低,使乳滴分散效果好,凝聚机会减少,对载药量与包封率没有显著影响。Conti等[37]发现当PVA的浓度为0.5%时,药物的包封率依赖于搅拌速度,随着搅拌速度的提高,包封率从17.5%升至90%。本研究单因素试验中各因素对微囊包封率的影响均不显著。丙硫菌唑微囊理论上应具有较高的包封率,然而在制备微囊的过程中,由于P(3HB-co-4HB)和丙硫菌唑溶解于三氯甲烷中所得溶液的黏度较大,在实验室制备量较小的条件下,试验材料黏附在与其接触的容器上,造成损失,从而降低微囊包封率,随着制备量的增加,损失量逐渐减小,包封率会有所提高,黄彬彬等[38]在文献中也有相同的分析;另外,在微囊制备过程中微囊的收率是影响包封率的关键因素,并不是所有的微囊干燥后均为分散性良好的微囊,部分微囊黏结成块,成为形状不规则的团聚体,使得到的微囊质量下降,造成包封率降低。Shenderova等[39]则认为聚合物在载体溶液中的浓度降低,包封率也随之降低,载体材料浓度下降,所需挥发溶剂时间较长,乳滴析出成固态的时间过长造成包封率降低。
除了试验所考察的4个主要因素,其他参数如壁材的性质和浓度、制备温度、溶剂蒸发时间和搅拌速率等也会对微囊的形态、性能产生一定的影响[40-42]。载体材料浓度提高使油相溶液黏度增加,乳滴中载体材料向外迁移困难,易发生粘连,使微囊形状不规则。温度升高过快或者蒸发时间太长,会使微囊材料析出,微囊粘结严重,分散性不好,控制蒸发时的温度,可防止微囊粘连聚结。王光磊等[43]采用溶剂蒸发法制备牛樟芝总三萜微囊,加入抗粘剂硬脂酸铝以防止微囊之间的粘结,增加其分散性,提高微囊收率。在本研究最佳制备工艺条件下得到的微囊具有良好的分散性,没有黏结,但微囊跨距较大,值得进一步研究,比如油相加入水相时逐滴滴加,或者增加高速剪切的时间以降低微囊跨距。
3.2 微囊性能
微囊的释放及降解速度与微囊形态及尺寸、内部结构、聚合物组成及降解方式等均有关系[44]。此外,药物的含量也会影响微囊的释药,微囊中的药物能提供释药过程中药物扩散的势能,所以药物含量高,释药速度快。微球粒径越小,表面积越大,释药加快[45-46]。由丙硫菌唑微囊的累积释放曲线分析,丙硫菌唑的释放大致可分为“突释”和“缓释”两个阶段:“突释”阶段为微囊在开始很短的时间内大量快速释放药物,吸附在微囊表面和浅层的丙硫菌唑在初始阶段快速释放到环境介质中,可保证速效性的要求;“缓释”阶段为药物“突释”后相对较长一段时间内持续缓慢释放,包裹在微囊内部的丙硫菌唑持续缓慢释放出来,可提高丙硫菌唑的持效期。生物完全可降解材料聚乳酸-羟基乙酸共聚物载药微囊的释放分为3个阶段[47],除了上述的两个阶段,第3阶段是药物缓慢释放后出现的较快药物释放,为快速释放阶段,这是聚合物降解所致。明确丙硫菌唑微囊的药物释放规律,可根据农作物病害对防控剂量的需求制备不同释放速率的丙硫菌唑微囊,延长持效期、减少农药使用量。
农药水中光解是环境化学及环境毒理学的研究热点之一。此外,喷洒使用后的农药在植物及土壤表面也会受到光的影响而发生降解,使药效逐步丧失。研究降解速度低的剂型及施药方式,对于延长持效期,充分发挥农药的综合效益具有重要价值。丙硫菌唑微囊的光解半衰期约为丙硫菌唑原药的两倍,显著降低了丙硫菌唑在水中的光解。在光降解试验中,影响药物在水环境中降解的因素有很多,比如温度,随着温度的升高降解速率增大,pH、光源、药物初始浓度等都会影响微囊的光降解行为[48]。管磊等以紫外灯为光源,研究了吡唑醚菌酯在水环境中光化学降解及微囊化对其光稳定性的影响,结果表明微囊化明显降低了吡唑醚菌酯在水中的光降解速率[49]。
丙硫菌唑微囊生物活性测定选用花生白绢病菌,主要原因是白绢病为花生田土传病害,近几年来危害严重,造成花生减产。聚羟基脂肪酸酯(PHA)在土壤中可生物降解,土壤中施用丙硫菌唑微囊后可随着载体材料的降解缓慢释放出丙硫菌唑,有效防控土传病害。另外PHA可促进土壤中PHA降解菌的生长[50],调节土壤微生物群落结构,从而有利于土壤养分循环能力的保持和生态系统的稳定[51]。
4 结论
以生物可降解聚(3-羟基丁酸酯-co-4-羟基丁酸酯)为载体材料,采用乳化溶剂蒸发法制备丙硫菌唑微囊,对其制备工艺进行优化,制备出分散性良好,粒径D50为3.32 μm,跨距为2.82,载药量为15.52%,包封率为80.24%的球形微囊。该微囊具有较好的缓释性能,与原药相比微囊在水溶液中的光稳定性增强,菌丝生长抑制试验表明其对花生白绢病菌的抑制活性与原药相当。丙硫菌唑微囊化延长药物持效期,降低丙硫菌唑对使用者的暴露风险,生物可降解的载体材料降低对环境的负面影响,具有较大的开发和应用潜力。
[1] SANKOH A I, WHITTLE R, SEMPLE K T, JONES K C, SWEETMAN A J. An assessment of the impacts of pesticide use on the environment and health of rice farmers in Sierra Leone. Environment International, 2016, 94: 458-466.
[2] ARIAS-ESTÉVEZ M, LÓPEZ-PERIAGO E, MARTÍNEZ-CARBALLO E, SIMAL-GÁNDARA J, MejutoJ C,García-Río L. The mobility and degradation of pesticides in soils and the pollution of groundwater resources. Agriculture, Ecosystems and Environment, 2008, 123(4): 247-260.
[3] PARKER J E, WARRILOW A G S, COOLS H J, MARTEL C M, NES W D, FRAAIJE B A, LUCAS J A, KELLY D E, KELLY S L. Mechanism of binding of prothioconazole toCYP51 differs from that of other azole antifungals. Applied and environmental microbiology, 2011, 77(4): 1460-1465.
[4] 程圆杰, 崔蕊蕊, 郭雯婷, 左文静, 主艳飞, 庄占兴, 范金勇. 丙硫菌唑研究开发现状与展望. 山东化工, 2018, 47(6): 58-61.
CHENG Y J, CUI R R, GUO W T, ZUO W J, ZHU Y F, ZHUANG Z X, FAN J Y. A review of research progress in the development of prothioconazole. Shandong Chemical Industry, 2018, 47(6): 58-61. (in Chinese)
[5] 黄华树, 柏亚罗. 丙硫菌唑的全球市场与应用开发. 现代农药, 2017, 16(6): 45-51.
HUANG H S, BAI Y L. Global market, application and development of prothioconazole.Modern Agrochemicals, 2017, 16(6): 45-51. (in Chinese)
[6] 于雪骊, 邢立国, 楼少巍. 杀菌剂丙硫菌唑施用人员健康风险评估. 农药科学与管理, 2017, 38(7): 37-43.
YU X L, XING L G, LOU S W. Operators’ health risk assessment of fungicide prothioconazole. Pesticide Science and Administration, 2017, 38(7): 37-43. (in Chinese)
[7] 农业农村部农药检定所. 中国农药信息网. http://www.chinapesticide. org.cn/.
Pesticide inspection institute, Ministry of Agriculture and Rural Affairs. China pesticide information network. http://www.chinapesticide. org.cn/. (in Chinese)
[8] 许春丽, BILAL M, 徐博, 冉刚超, 赵鹏跃, 曹冲, 李凤敏, 曹立冬, 黄啟良. 荧光介孔二氧化硅负载丙硫菌唑纳米颗粒的制备及性能研究. 农药学学报, 2020, 22(2): 214-224.
XU C L, BILAL M, XU B, RAN G C, ZHAO P Y, CAO C, LI F M, CAO L D, HUANG Q L. Preparation and characterization of prothioconazole-loaded fluorescent mesoporous silica nanoparticles.Chinese Journal of Pesticide Science, 2020, 22(2): 214-224. (in Chinese)
[9] 李北兴, 张大侠, 张灿光, 管磊, 王凯, 刘峰. 微囊化技术研究进展及其在农药领域的应用. 农药学学报, 2014, 16(5): 483-496.
LI B X, ZHANG D X, ZHANG C G, GUAN L, WANG K, LIU F. Research advances and application prospects of microencapsulation techniques in pesticide. Chinese Journal of Pesticide Science, 2014, 16(5): 483-496. (in Chinese)
[10] TSUJI K. Microencapsulation of pesticides and their improved handling safety. Journal of Microencapsulation, 2001, 18(2): 137-147.
[11] 王安琪, 王琰, 王春鑫, 崔博, 孙长娇, 赵翔, 曾章华, 姚俊伟, 刘国强, 崔海信. 农药纳米微囊化剂型研究进展. 中国农业科技导报, 2018, 20(2): 10-18.
WANG A Q, WANG Y, WANG C X, CUI B, SUN C J, ZHAO X, ZENG Z H, YAO J W, LIU G Q, CUI H X. Research progress on nanocapsules formulations of pesticides. Journal of Agricultural Science and Technology, 2018, 20(2): 10-18. (in Chinese)
[12] 朱峰, 许春丽, 曹立冬, 曹冲, 李凤敏, 杜凤沛, 黄啟良. 农药微囊剂及其制备技术研究进展. 现代农药, 2018, 17(2): 12-16.
ZHU F, XU C L, CAO L D, CAO C, LI F M, DU F P, HUANG Q L. Research advances of pesticide microcapsule and its preparative technique. Modern Agrochemicals, 2018, 17(2): 12-16. (in Chinese)
[13] 冯建国, 徐妍, 罗湘仁, 严寒, 吴学民. 浅谈溶剂蒸发法制备微胶囊与农药胶囊的开发. 农药学学报, 2011, 13(6): 568-575.
FENG J G, XU Y, LUO X R, YAN H, WU X M. Discussion on the solvent evaporation method for preparation of microcapsules and the development of the pesticides microcapsules. Chinese Journal of Pesticide Science, 2011, 13(6): 568-575. (in Chinese)
[14] 乔吉超, 胡小玲, 张团红, 管萍. 溶剂蒸发法制备药物微胶囊研究进展. 化工进展, 2006, 25(8): 885-889, 927.
QIAO J C, HU X L, ZHANG T H, GUAN P. Application of solvent evaporation method in preparation of drug microcapsule. Chemical Industry and Engineering Progress, 2006, 25(8): 885-889, 927. (in Chinese)
[15] THORAT GADQIL B S, KILLI N, RATHAN G V N. Polyhydroxyalkanoates as biomaterials. MedicinalCommunication, 2017, 8(9): 1774-1787.
[16] 陈歌, 许春丽, 徐博, 冉刚超, 曹冲, 赵鹏跃, 曹立冬, 黄啟良. 聚羟基脂肪酸酯作为农药载体的研究进展. 农药学学报, 2019, 21(5/6): 871-882.
CHEN G, XU C L, XU B, RAN G C, CAO C, ZHAO P Y, CAO L D, HUANG Q L. Research progress of polyhydroxyalkylates as pesticide carriers. ChineseJournal of Pesticide Science, 2019, 21(5/6): 871-882. (in Chinese)
[17] CAO L D, LIU Y J, XU C L, ZHOU Z L, ZHAO P Y, NIU S J, HUANG Q L. Biodegradable poly (3-hydroxybutyrate-co-4- hydroxybutyrate) microcapsules for controlled release of trifluralin with improved photostability and herbicidal activity.Materials Science and Engineering C, Materials for Biological Applications, 2019, 102: 134-141.
[18] 陈慧萍, 陈歌, 许春丽, 徐博, 曹立冬, 黄啟良. 吡唑醚菌酯微囊的制备及性能表征. 现代农药, 2020, 19(1): 28-31, 39.
CHEN H P, CHEN G, XU C L, XU B, CAO L D, HUANG Q L. Preparation and characterization of pyraclostrobin microcapsules.Modern Agrochemicals, 2020, 19(1): 28-31, 39. (in Chinese)
[19] FREITAS S, MERKLE H P, GANDER B. Microencapsulation by solvent extraction/evaporation: reviewing the state of the art of microsphere preparation process technology. Journal of Controlled Release, 2005, 102(2): 313-332.
[20] Jelvehgari M, Barar J, Valizadeh H, SHADROU S, NOKHODCHI A. Formulation characterization andevaluation of theophylline-loaded Eudragit RS 100 microspheres prepared by an emulsion-solvent diffusion/evaporation technique. Pharmaceutical Development and Technology, 2011, 16(6): 637-644.
[21] ASRAR J, DING Y, MONICA R E, NESS L C. Controlled release of tebuconazole from a polymer matrix microparticle: release kinetics and length of efficacy. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4814-4820.
[22] 孙广宇, 宗兆锋. 植物病理学实验技术. 北京: 中国农业出版社, 2002: 141-142.
SUN G Y, ZONG Z F. Experimental Techniquesof plant pathology. Beijing: ChinaAgriculturePress, 2002: 141-142. (in Chinese)
[23] 叶玉杰, 李芳, 任德全, 张永忠, 刘嵩. Origin软件拟合制剂体外释药规律的应用. 数理医药学杂志, 2014, 27(1): 93-94.
YE Y J, LI F, REN D Q, ZHANG Y Z, LIU S. Application of Origin software to fit the drug release.Journal of Mathematical Medicine, 2014, 27(1): 93-94. (in Chinese)
[24] RAVI P R, KOTREKA U K, SAHA R N. Controlled release matrix tablets of zidovudine: Effect of formulation variables on thedrug release kinetics. AAPS PharmSciTech, 2008, 9(1): 302-313.
[25] SATHE P, TSONG Y, SHAH V P.dissolution profile comparison: Statistics and analysis, model dependent approach. Pharmaceutical Research, 1996, 13(12): 1799-1803.
[26] 陈建海, 陈志良, 侯连兵, 刘世霆. 聚羟基丁酸酯缓释微球的制备与性能. 功能高分子学报, 2000, 13(1): 61-64.
CHEN J H, CHEN Z L, HOU L B, LIU S T. Preparation and characterization of diazepam-polyhydroxybutyrate microspheres. Journal of Functional Polymers, 2000, 13(1): 61-64. (in Chinese)
[27] EMBLETON J K, TIGHE B J. Polymers for biodegradable medical devices. IX: Microencapsulation studies; effects of polymer composition and process parameters on poly-hydroxybutyrate- hydroxyvalerate microcapsule morphology. Journal of Microencapsulation, 1992, 9(1): 73-87.
[28] 舒丹丹, 张淑娟, 金丽娜, 王铁闯, 李大吉. 乳化溶剂挥发法及在微囊化制剂中的应用. 北方药学, 2012, 9(4): 22-23.
SHU D D, ZHANG S J, JIN L N, WANG T C, LI D J. Emulsion solvent evaporation method and its application in microencapsulated preparations.Journal of North Pharmacy, 2012, 9(4): 22-23. (in Chinese)
[29] LI M, ROUAUD O, PONCELET D. Microencapsulation by solvent evaporation: state of the art for process engineering approaches. International Journal of Pharmaceutics, 2008, 363(1/2): 26-39.
[30] LI D, LIU B X, YANG F, WANG X, SHEN H, WU D C. Preparation of uniform starch microcapsules by premix membrane emulsion for controlled release of avermectin. Carbohydrate Polymers, 2016, 136: 341-349.
[31] MAIA J L, SANTANA M H, RÉ M I. The effect of some processing conditions on the characteristics of biodegradable microspheres obtained by an emulsion solvent evaporation process. Brazilian Journal of Chemical Engineering, 2004, 21(1): 1-12.
[32] YAN X F, WANG Y, LIU H H, LI R H, QIAN C Q. Synthesis and characterization of melamine-formaldehyde microcapsules containing pyraclostrobin bypolymerization. Polymer Science Series B, 2018, 60(6): 798-805.
[33] 滑海涛, 李敏, 翟晓曼, 曲文岩, 折冬梅, 李凤敏, 黄啟良. 反应时间、芯壁比及表面活性剂用量对阿维菌素微囊制备的影响. 农药学学报, 2010, 12(1): 54-60.
HUA H T, LI M, ZHAI X M, QU W Y, SHE D M, LI F M, HUANG Q L. Studies on the influence of polymerization time, ratio of core material to wall material and percentage of SDS on the preparation of abamectin capsule suspensions.Chinese Journal of Pesticide Science, 2010, 12(1): 54-60. (in Chinese)
[34] HEISKANEN H, DENIFL P, PITKÄNEN P, HURME M. Effect of preparation conditions on the properties of microspheres prepared using an emulsion-solvent extraction process. Chemical Engineering Research and Design, 2012, 90(10): 1517-1526.
[35] BAHRI Z, TAVERDET J. Preparation and optimization of 2, 4-D loaded cellulose derivatives microspheres by solvent evaporation technique.Journal of Applied Polymer Science, 2007, 103(4): 2742-2751.
[36] MATEOVIC T, KRIZNAR B, BOGATAJ M, MRHAR A. The influence of stirring rate on biopharmaceutical properties of eudragit RS microspheres. Journal of Microencapsulation, 2002, 19(1): 29-36.
[37] CONTI B, GENTA I, MODENA T, PAVANETTO F. Investigation on process parameters involved in polylactide-co-glycolide microspheres preparation. Drug Development and Industrial Pharmacy, 2008, 21(5): 615-622.
[38] 黄彬彬, 杨丰梅, 张旭溪, 钟建斌, 吴祖建, 吴刚. 多杀菌素微球制备关键工艺研究:Ⅱ. 农药学学报, 2011, 13(4): 402-408.
HUANG B B, YANG F M, ZHANG X X, ZHONG J B, WU Z J, WU G. Study on key process of preparation of spinosad microsphere: Ⅱ. Chinese Journal of Pesticide Science, 2011, 13(4): 402-408. (in Chinese)
[39] SHENDEROVA A, BURKE T G, SCHWENDEMAN S P. Stabilization of 10-hydroxycampthecin in poly (lactide-co-glycolide) microsphere delivery vehicles. Pharmaceutical Research, 1997, 14(10): 1406-1414.
[40] HEISKANEN H, DENIFL P, PITKÄNEN P, HURME M. Effect of concentration and temperature on the properties of the microspheres prepared using an emulsion-solvent extraction process. Advanced Powder Technology, 2012, 23(6): 779-786.
[41] GÜRSEL I, HASIRCI V. Properties and drug release behaviour of poly (3-hydroxybutyric acid) and various poly (3-hydroxybutyrate- hydroxyvalerate) copolymer microcapsules. Journal of Microencapsulation, 1995, 12(2): 185-193.
[42] YANG Y Y, CHIA H H, CHUNG T S. Effect of preparation temperature on the characteristics and release profiles of PLGA microspheres containing protein fabricated by double-emulsion solvent extraction/evaporation method. Journal of Controlled Release, 2000, 69(1): 81-96.
[43] 王光磊, 陈璨, 魏文增, 王宫. 溶剂挥发法制备牛樟芝总三萜微囊的研究. 海峡药学, 2019, 31(2): 5-10.
WANG G L, CHEN C, WEI W Z, WANG G. Study on preparation of microcapsule loaded total triterpene from theby emulsion-solvent evaporation technique. Strait Pharmaceutical Journal, 2019, 31(2): 5-10. (in Chinese)
[44] MORITA T, HORIKIRI Y, YAMAHARA H, SUZUKI T, YOSHINO H. Formation and isolation of spherical fine protein microparticles through lyophilization of protein-poly (ethylene glycol) aqueous mixture. Pharmaceutical Research, 2000, 17(11): 1367-1373.
[45] O’DONNELL P B, MOGINITY J W. Influence of processing of the stability and release properties of biodegradable microspheres containing thioridazine hydrochloride. European Journal of Pharmaceutics Biopharmaceutics, 1998, 45(1): 83-94.
[46] LIU B X, WANG Y, YANG F, WANG X, SHEN H, CUI H X, WU D C. Construction of a controlled-release delivery system for pesticides using biodegradable PLA-based microcapsules.Colloids and Surfaces B: Biointerfaces, 2016, 14: 38-45.
[47] ROSKOS K V, MASKIEWICZ R. Degradable controlled release systems useful for protein delivery. Pharmaceutical Biotechnology, 1997, 10: 45-92.
[48] 刘晓旭, 侯志广, 吴敬慧, 王雪, 逯忠斌. 嘧菌酯水解动力学研究. 农业环境科学学报, 2012, 31(8): 1603-1607.
LIU X X, HOU Z G, WU J H, WANG X, LU Z B. Hydrolyze kinetics and mechanism of azoxystrobin. Journal of Agro-Environment Science, 2012, 31(8): 1603-1607. (in Chinese)
[49] 管磊, 张鹏, 王晓坤, 任玉鹏, 郭贝贝, 刘峰. 吡唑醚菌酯在水环境中的光解及微囊化对其光稳定性的影响. 农业环境科学学报, 2015, 34(8): 1493-1497.
GUAN L, ZHANG P, WANG X K, REN Y P, GUO B B, LIU F. Photodegradation of pyraclostrobin in water environment and microencapsulation effect on its photostability. Journal of Agro- Environment Science, 2015, 34(8): 1493-1497. (in Chinese)
[50] VOLOVA T, ZHILA N, VINOGRADOVA O, SHUMILOVA A, PRUDNIKOVA S, SHISHATSKAYA E. Characterization of biodegradable poly-3-hydroxybutyrate films and pellets loaded with the fungicide tebuconazole.Environmental Science and Pollution Research International, 2016, 23(6): 5243-5254.
[51] XU W B, LI W, XIONG W, REN Y, LIU Y P, MIAO Y Z, XU Z H, ZHANG N, SHEN Q R, ZHANG R F. Diversity-triggered deterministic bacterial assembly constrains community functions. Nature Communications, 2019, 10: 3833.
Performance Study of Prothioconazole Microcapsules Prepared by Solvent Evaporation Method
Chen Ge, CAO LiDong, XU ChunLi, ZHAO PengYue, CAO Chong, LI FengMin, HUANG QiLiang
Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193
【】The biodegradable material poly (3-hydroxybutyrate-co-4-hydroxybutyrate) (P (3HB-co-4HB)) was used as the wall material to prepare prothioconazole microcapsules. The effect of preparation process on the microcapsule size, pesticide loading and encapsulation efficiency was optimized. The microcapsules with good dispersion, small particle size, and high pesticide loading were screened out, and the preliminary researches on the release kinetics, photodegradation, and indoor biological activity onwere carried out. The purpose of this study is to provide a theoretical basis and technical support for improving the stability and utilization efficiency of prothioconazole in the environment.【】The solvent evaporation method was used to prepare prothioconazole microcapsules, and the effects of the mass ratio of core to wall material, volume ratio of oil to water, mass fraction of emulsifier and shearing speed on the particle size, pesticide loading and encapsulation efficiency of the microcapsules were investigated through a single factor test. Taking pesticide loading and particle size as the key technical indicators, the optimal preparation parameters were screened out through the L9(34) orthogonal test, which was further verified. The morphological and structural features, release performance and photodegradability of the microcapsules were determined by scanning electron microscope (SEM), fourier transform infrared (FTIR) spectrometer, and high performance liquid chromatography (HPLC). The toxicity of prothioconazole microcapsules onwas investigated by indoor bioassay.【】The mass ratio of core to wall material had a significant effect on the pesticide loading capacity of the microcapsules. As the ratio of core material increased, the loading capacity gradually increased. the volume ratio of oil to water, PVA mass fraction, and shearing speed had significant effects on the microcapsule particle size. As the shearing speed and PVA mass fraction increased, the microcapsule particle size gradually decreased. The volume ratio of oil to water had a great influence on the morphology and dispersion of microcapsules, and the influence of various factors on the encapsulation efficiency of the microcapsules was not significant. The optimal preparation parameters obtained through the L9(34) orthogonal test was as follows: the mass ratio of core to wall material of 1﹕5, volume ratio of oil to water of 1﹕5, PVA mass fraction of 2%, and shearing speed of 12 000 r/min. Under the optimal preparation process, spherical prothioconazole microcapsules with a particle size (D50) of 3.32 μm and a span of 2.82 were prepared with a loading content of 15.52% and an encapsulation efficiency of 80.24%. Compared with prothioconazole technical material, the microcapsules had better sustained-release performance, and the release kinetics conformed to Fick’s diffusion law, presenting two processes of “burst release” followed by “sustained release”. The photostability of prothioconazole in the microcapsules in aqueous solution was enhanced, and the half-life of photolysis was doubled. The mycelial growth rate inhibition result showed that the fungicidal activity of prothioconazole microcapsules againstwas equivalent to that of prothioconazole technical material.【】Prothioconazole microcapsules with biodegradable material P (3HB-co-4HB) as a carrier were prepared, and different preparation processes affect the pesticide loading, dispersion state and particle size of microcapsules. The slow and sustained release and photostability are of great significance for reducing the amount of pesticide applied and improving the utilization efficiency of pesticide, which has potential application in control of peanut southern blight.
prothioconazole; polyhydroxybutyrate; microcapsule; preparation process; controlled release;

10.3864/j.issn.0578-1752.2021.04.008
2020-05-14;
2020-07-08
国家重点研发计划(2017YFD0200300)、中央级公益性科研院所基本科研业务费(Y2020XK14)
陈歌,Email:chenge0036@126.com。通信作者曹立冬,Email:caolidong@caas.cn。通信作者黄啟良,E-mail:qlhuang@ippcaas.cn
(责任编辑 岳梅)

