非编码RNA在索拉非尼治疗肝细胞癌耐药中的作用机制
陈国想, 周 茉, 陈 圣, 王 元, 周元龙, 杨季红
河北大学附属医院 肝胆外科, 河北 保定 071000
肝细胞癌(HCC)是临床上常见的、最具侵袭性的消化系统恶性肿瘤之一,从全球范围来看,HCC的发病率在所有恶性肿瘤疾病中位居第6位。由于我国的HBV感染率较高,全世界约50%的HCC发生在我国[1]。由于早期HCC症状不典型,患者就诊时已经失去最佳手术时机。对于这些患者来说,系统性治疗是十分必要的,索拉非尼在控制HCC细胞增殖以及血管生成过程具有重要作用。研究[2]表明,索拉非尼能使晚期HCC患者的中位生存时间延长2~3个月,较高的耐药率是制约索拉非尼效益的主要原因之一,所以为有效延长晚期HCC患者生存时间,索拉非尼耐药是目前急需解决的问题。目前研究显示,非编码RNA(non-coding RNA ,ncRNA)与索拉非尼耐药存在相关性,本文将对与HCC索拉非尼耐药相关的ncRNA进行总结,并对其在索拉非尼耐药的作用机制进行探讨,以期为解决HCC索拉非尼耐药提供新的思路。
1 ncRNA简介
人类基因组中有20 000~25 000个基因,但其中98%的基因转录产物并不能翻译出蛋白质,这类转录出来的RNA统称为ncRNA。其中大于200个核苷酸的称为长链非编码RNA(long noncoding RNA,lncRNA),而目前研究较多的微小RNA(microRNA,miRNA)则属于短链ncRNA[3],过去认为ncRNA在机体中并没有明确的生物学功能,是基因转录过程中的“噪声”,但随着近些年的研究,ncRNA在肿瘤疾病中存在的作用逐渐显现出来,它们作为功能性调节分子,参与各种细胞活动,包括转录、翻译、染色质重塑、基因表达及调控[4]。近期研究[5]发现,ncRNA还参与肿瘤疾病的化疗耐药。如lncRNA H19通过增强多药耐药基因1/P-糖蛋白(P-gp)的表达,促进化疗药物外排,来介导肝癌出现阿霉素耐药;lncRNA HOTAIR通过增加STAT3的水平,促进STAT3磷酸化,使癌细胞将药物外排能力增强,导致肝癌细胞出现顺铂耐药[6]。
2 索拉非尼治疗HCC中的耐药机制
索拉非尼通过抑制Raf/MEK/ERK和PI3K/AKT/mTOR信号通路来抑制肿瘤细胞的增殖,从而抑制肝癌的进展。此外,索拉非尼还具有抑制血管内皮生长因子受体和血小板衍生生长因子受体的能力,进一步阻断肿瘤血管的形成,从而间接抑制肿瘤的生长[7-8]。索拉非尼作为HCC诊疗指南推荐的晚期HCC的一线治疗药物,能够延长晚期HCC患者3个月的生存时间,但多数患者在服药后会出现索拉非尼耐药。索拉非尼耐药机制复杂,随着对ncRNA研究的深入,发现ncRNA对HCC出现索拉非尼耐药存在调控作用,作为ncRNA的代表,lncRNA及miRNA通过诱导HCC细胞自噬、HCC细胞上皮-间质转化、激活PI3K/AKT通路、促进肝癌干细胞增殖以及调节肿瘤微环境等生物学活动参与索拉非尼耐药[9]。
2.1 ncRNA通过诱导HCC细胞自噬导致索拉非尼耐药
ncRNA在调控HCC细胞自噬方面有着重要作用,ncRNA通过调节相应自噬相关蛋白的表达、激活AKT信号通路,促进HCC细胞自噬,导致HCC细胞出现索拉非尼耐药。
2.1.1 ncRNA通过调节自噬相关蛋白促进索拉非尼耐药 细胞自噬是真核生物进化过程中出现的一种依赖自身溶酶体消化自身蛋白质的过程,研究[10-12]发现,自噬是HCC出现耐药的重要机制之一,ncRNA可以通过调控肿瘤细胞胞内自噬相关蛋白表达,促进HCC细胞保护性自噬,进而导致HCC出现索拉非尼耐药。研究[13]发现,lncRNA CRNDE在HCC中的高表达能够使HCC细胞对索拉非尼的敏感性降低,其通过抑制miRNA-543上调自噬相关蛋白ATG4B,促进HCC细胞自噬,导致HCC出现索拉非尼耐药,通过敲低CRNDE能够使HCC细胞重新获得对索拉非尼的敏感性。Jing等[14]发现对索拉非尼耐药的肿瘤组织中SNHG16普遍高表达,SNHG16已经被证实参与多种肿瘤疾病的发生及发展。在耐索拉非尼的HCC细胞系Hep3B(Hep3B/SO)中,SNGH16通过上调EGR1的表达来抑制miRNA-23b-3p导致自噬相关蛋白LC3-Ⅱ及LC3-Ⅰ表达增多,来促进Hep3B/SO的存活和自噬,在Hep3B/SO中沉默SNHG16可以明显提高Hep3B/SO对索拉非尼的敏感性。lncRNA NEAT1通过海绵样吸附miRNA-204 来上调自噬相关蛋白ATG3的表达,NEAT1通过调控miRNA-204/AGT3促进HCC细胞自噬,增强细胞对索拉非尼的耐药性[15]。而miRNA-142-3p则通过靶向自噬相关基因5(ATG5)和ATG16L1抑制索拉非尼诱导的自噬并使HCC细胞对索拉非尼的敏感性增加。miRNA-142-3p的上调可能是克服HCC细胞索拉非尼耐药性的有前途的治疗措施[16]。由此可见,ncRNA参与调节多种自噬相关蛋白的表达,并通过调节它们来促进HCC细胞的保护性自噬行为,导致HCC细胞出现索拉非尼耐药。
2.1.2 ncRNA激活AKT通路促进HCC细胞自噬 ncRNA诱导AKT通路激活在HCC细胞出现索拉非尼耐药中具有重要作用。AKT是一类AGC家族的丝氨酸/苏氨酸激酶,它在调控细胞生长、增殖、存活、转录以及蛋白质合成中发挥着重要作用。研究[17-18]发现过表达的lncRNA SNHG1通过调节SLC3A2(一种溶质转运蛋白)激活AKT通路,从而参与索拉非尼的耐药,去除SNHG1可通过抑制AKT通路的激活而增强索拉非尼耐药HCC细胞凋亡,并且SNHG1受miRNA-21正向调节,miRNA-21可以直接下调PTEN的表达,导致AKT通路的激活,进而调节HCC细胞自噬行为,介导HCC细胞的索拉非尼耐药。
2.2 ncRNA通过促进HCC细胞增殖导致索拉非尼耐药
实体肿瘤中存在少量未分化,能够进行持续分裂的具有多细胞分化能力的细胞,称为肿瘤干细胞。研究发现,肿瘤干细胞在肿瘤的发生、增殖、复发以及耐药中均具有重要作用。ncRNA可以与调节肿瘤干细胞的因子结合,激活相关信号通路,促进肿瘤干细胞激活以及增殖,导致HCC对索拉非尼的敏感性降低。研究发现,上皮-间质转化作为肿瘤恶性行为的标志,不仅有助于细胞迁移,还有助于肿瘤细胞耐药行为的产生。Van等[19]发现,与上皮性HCC细胞相比,间叶性HCC细胞对索拉非尼的耐药性更强。
2.2.1 ncRNA促进肝癌干细胞增殖导致索拉非尼耐药 研究[20]发现,肝癌干细胞在HCC产生耐药性的过程中起到关键作用,lncRNA ROR通过影响肝癌干细胞的生长抑制索拉非尼诱导的HCC细胞凋亡,促进HCC细胞出现索拉非尼耐药。除此之外,部分ncRNA通过调节以下信号通路来影响肝癌干细胞的增殖,导致HCC细胞出现索拉非尼耐药。(1)通过活化转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路诱导肝癌干细胞增殖。STAT3是STAT家族中的一个功能蛋白,激活后的STAT与胞核中靶基因的转录密切相关。lncRNA ARSR通过激活下游的STAT3通路,促进STAT3磷酸化,使HCC中的肝癌干细胞增殖,导致HCC细胞出现索拉非尼耐药[21]。(2)通过抑制腺嘌呤核苷酸转运子2(ANT2)及Ras相关的C3肉毒毒素底物1(RAC1)的表达促进诱导HCC出现索拉非尼耐药。Lu等[22]在研究中发现,ANT2可以诱导Huh7细胞形成肝癌干细胞表型,并且促进HCC转移及耐药,miRNA-137表达使Huh7细胞中ANT2蛋白表达下调,抑制Huh7细胞中肝癌干细胞的形成,使耐药细胞重新获得对索拉非尼的敏感性。miRNA-194、miRNA-365通过调节RAC1来抑制肝癌干细胞增殖,并且miRNA-194的过表达可以使HCC细胞对索拉非尼更敏感[23-24]。(3)通过调节SOX9信号通路促进肝癌干细胞增殖。SOX9是由SOX9基因编码的转录因子,目前已发现它广泛参与细胞调节,并且在肺癌、HCC以及乳腺癌中作为癌基因发挥作用。Li等[25]研究发现,表面标志物CD24或OV6阳性的肝癌干细胞中,miRNA-613的表达显著降低,miRNA-613的表达下调促进HCC细胞的去分化以及促进肝癌干细胞的自我更新。进一步研究发现miRNA-613通过靶向SOX9信号通路抑制HCC细胞去分化及肝癌干细胞增殖,从而使HCC细胞对索拉非尼的敏感性增强。总之,肝癌干细胞在HCC的生长、转移及耐药中存在着重要作用,多种ncRNA通过调节肝癌干细胞的增殖调控HCC细胞对索拉非尼的敏感性。
2.2.2 ncRNA诱导HCC细胞上皮-间质转化过程导致索拉非尼耐药 上皮-间质转化是指细胞从上皮细胞通过特定程序向间质细胞转化的过程,表现为细胞极性消失,细胞间连接能力下降,研究发现,肿瘤细胞上皮-间质转化过程与肿瘤的转移、抗凋亡以及出现耐药存在相关性。
近年来研究者发现ncRNA可以通过以下几种机制来介导HCC细胞出现索拉非尼耐药:(1)激活PI3K/AKT及TGFβ通路诱导HCC细胞上皮-间质转化过程导致HCC索拉非尼耐药。Zhang等[26]研究发现,lncRNA SNHG3的高表达与HCC细胞的增殖以及耐药有关,进一步机制研究发现,SNHG3作为内源竞争RNA(ceRNA)参与miRNA-128/CD151反馈环的抑制,并且激活PI3K信号通路,诱导HCC细胞上皮-间质转化,从而促进HCC细胞的侵袭性以及对索拉非尼的耐药性;miRNA-93、miRNA-216a/217的过表达对TGFβ通路和PI3K/AKT信号激活的典型通路起正反馈调节作用,并且miRNA-216a/217的过表达参与了PI3K/AKT信号的激活并导致HCC细胞出现对索拉非尼的获得性耐药,通过阻断TGFβ以及PI3K/AKT信号通路的激活则能逆转miRNA-216a/217诱导的索拉非尼耐药[27-28]。(2)通过抑制Notch-1通路介导HCC索拉非尼耐药。Notch-1通路激活促进肿瘤细胞的上皮-间质转化过程,并诱导肿瘤细胞抗凋亡。研究[29]发现,miRNA-34a表达增加能够抑制Notch-1通路激活,增加HCC耐药细胞株对索拉非尼的敏感性; ncRNA通过干扰TGFβ、PI3K/AKT及Notch通路,调节HCC细胞上皮-间质转化过程,诱导HCC细胞出现索拉非尼耐药。
2.3 ncRNA通过干扰HCC细胞凋亡调节索拉非尼耐药 细胞凋亡是一种程序性的细胞死亡过程,阻碍细胞凋亡过程是肿瘤细胞出现耐药的重要原因,多种ncRNA通过调控以下信号通路阻碍肿瘤细胞的凋亡,从而出现药物耐药。研究[30]发现,miRNA-222能够促进HepG2细胞的增殖、迁移、侵袭及细胞周期的G1/S转换,并阻碍细胞凋亡,机制研究发现,miRNA-222通过激活PI3K/AKT信号通路,减少细胞凋亡,增强HCC细胞对索拉非尼的耐药性;miRNA-494通过抑制PTEN的表达,上调PI3K和AKT的表达,从而促进HCC细胞的增殖、迁移和侵袭,增加索拉非尼对HCC细胞的耐药性[31]。在Fornari等[32]的研究中发现,miRNA-221的过表达与索拉非尼耐药有关,Casepase-3是细胞凋亡过程中最主要的终末剪切酶,参与细胞的凋亡过程,它通过剪切多聚聚合酶PARP,使其与DNA结合的两个锌指结构与羧基端的催化区域分离,调控细胞凋亡过程。miRNA-221通过下调Casepase-3抑制HCC细胞凋亡过程,导致HCC细胞对索拉非尼的敏感性下降。lncRNA NEAT1通过抑制药物诱导的凋亡增加HCC细胞的索拉非尼耐药性,NEAT1负向调控miRNA-335,减轻其对c-MET-AKT的抑制作用,从而促进HCC生长[33]。Azumi等[34]在其研究中指出,miRNA-181a通过抑制RAS结合结构域家族成员1(RASSF1),诱导HCC细胞对索拉非尼耐药。miRNA-34a通过与抗凋亡蛋白Bcl-2 mRNA的3′-UTR结合从而抑制其翻译,miRNA-34a的表达降低了HCC细胞的存活率,促进了细胞的凋亡,并通过抑制Bcl-2的表达增强了索拉非尼诱导的HCC细胞的凋亡和毒性[35]。Xu等[36]发现,在正常肝脏中表达的miRNA-122在HCC中表达显著降低,过表达的miRNA-122可以使耐药细胞对索拉非尼敏感,进一步研究发现,miRNA-122表达减少通过靶向激活胰岛素样生长因子1受体(IGF-1R),激活Ras/RAF/ERK信号通路,导致HCC细胞对索拉非尼耐药。
2.4 ncRNA调节肿瘤微环境介导索拉非尼耐药 恶性肿瘤生长迅速,导致肿瘤微环境缺氧,肿瘤内部缺氧是恶性肿瘤的共同特征,也是产生耐药的重要因素。缺氧诱导转录因子-1(HIF-1)是一种转录因子,通过调节一系列与血管生成、代谢和细胞增殖相关的基因来介导细胞对缺氧的适应性[37]。HIF-1α是其功能亚单位,研究[38-40]表明,HIF-1α与多种肿瘤的化疗耐药有关。在Xu等[41]的研究中发现,miRNA-338-3p通过抑制HIF-1α,下调其下游的血管内皮生长因子、葡萄糖转运蛋白-1及P-gp的表达,减少HCC细胞对索拉非尼的外排,抑制HCC细胞生长以及增强HCC细胞对索拉非尼的敏感性。研究[42]发现lincRNA-VLDLR在HCC中显著高表达,使用索拉非尼后,HCC细胞及其释放的lincRNA-VLDLR表达增加,进一步研究发现,lincRNA-VLDLR通过调控乳腺癌耐药蛋白(ABCG2)的表达,促进HCC细胞药物外排,从而导致HCC出现索拉非尼耐药。总结相关研究报道多种lncRNA和miRNA参与HCC索拉非尼耐药详见表1。

表1 HCC索拉非尼耐药相关ncRNA
3 总结与展望
越来越多的证据证明ncRNA参与了HCC索拉非尼耐药,图1总结了ncRNA在HCC索拉非尼耐药中的作用机制,靶向调控这些ncRNA可能是逆转索拉非尼耐药的一种方法。例如,针对致癌miRNA或肿瘤抑制因子miRNA的合成寡核苷酸进行纳米颗粒递送,或者与调节miRNA的天然药物一起给药,已经被作为HCC治疗的概念验证进行了研究[44-45]。Tang等[46]人工设计了针对多种miRNAs的lncRNA 用于治疗HCC细胞对索拉非尼的耐药, 取得了良好效果。靶向ncRNA联合索拉非尼治疗HCC可能是逆转耐药和改善晚期HCC患者预后的一种有前途的选择。而且同一种ncRNA可以从不同的信号通路或者靶点调节HCC细胞索拉非尼耐药。如miRNA-34a既可以通过抑制Notch-1通路抑制HCC细胞的上皮-间质转化过程也可以通过与抗凋亡蛋白Bcl-3的3’-UTR结合,从而促进耐索拉非尼的HCC细胞凋亡。众多ncRNA之间是否存在协同作用,也许在未来能够成为研究索拉非尼耐药研究的一个方向。可以看到多种ncRNA通过激活PI3K/AKT通路来介导HCC细胞对索拉非尼耐药,该信号通路可能是逆转索拉非尼耐药的关键通路。
另外,联合用药也许是克服索拉非尼耐药的一种途径,目前免疫治疗已经成为肿瘤治疗的新方向,Chen等[47]研究发现,在索拉非尼治疗后的小鼠模型中,其PD-L1表达增加,使用PD-1受体阻滞剂联合CXCR4抑制剂和索拉非尼可延缓HCC的生长,但联合用药的效果仍需要进一步来证实。尽管将ncRNA作为治疗靶标具有良好前景,但基于ncRNA的治疗方式尚未进行临床实践,并且目前已知的ncRNA可能仅代表HCC中功能相关的ncRNA的一小部分。更好的了解ncRNA介导的HCC出现索拉非尼耐药的分子机制将为HCC的治疗带来巨大裨益。在基于ncRNA的治疗方式成为HCC的治疗方法以前,仍有很多挑战亟待解决,如需要更多的研究来进一步了解及证实ncRNA与索拉非尼耐药之间的分子机制,如何靶向治疗效果好,安全性高、长期治疗效果好的ncRNA进行临床试验等。虽然目前关于ncRNA与索拉非尼的研究仍停留在体外阶段,但ncRNA为逆转索拉非尼耐药提供了新的方向,为HCC的治疗提供了新的策略。
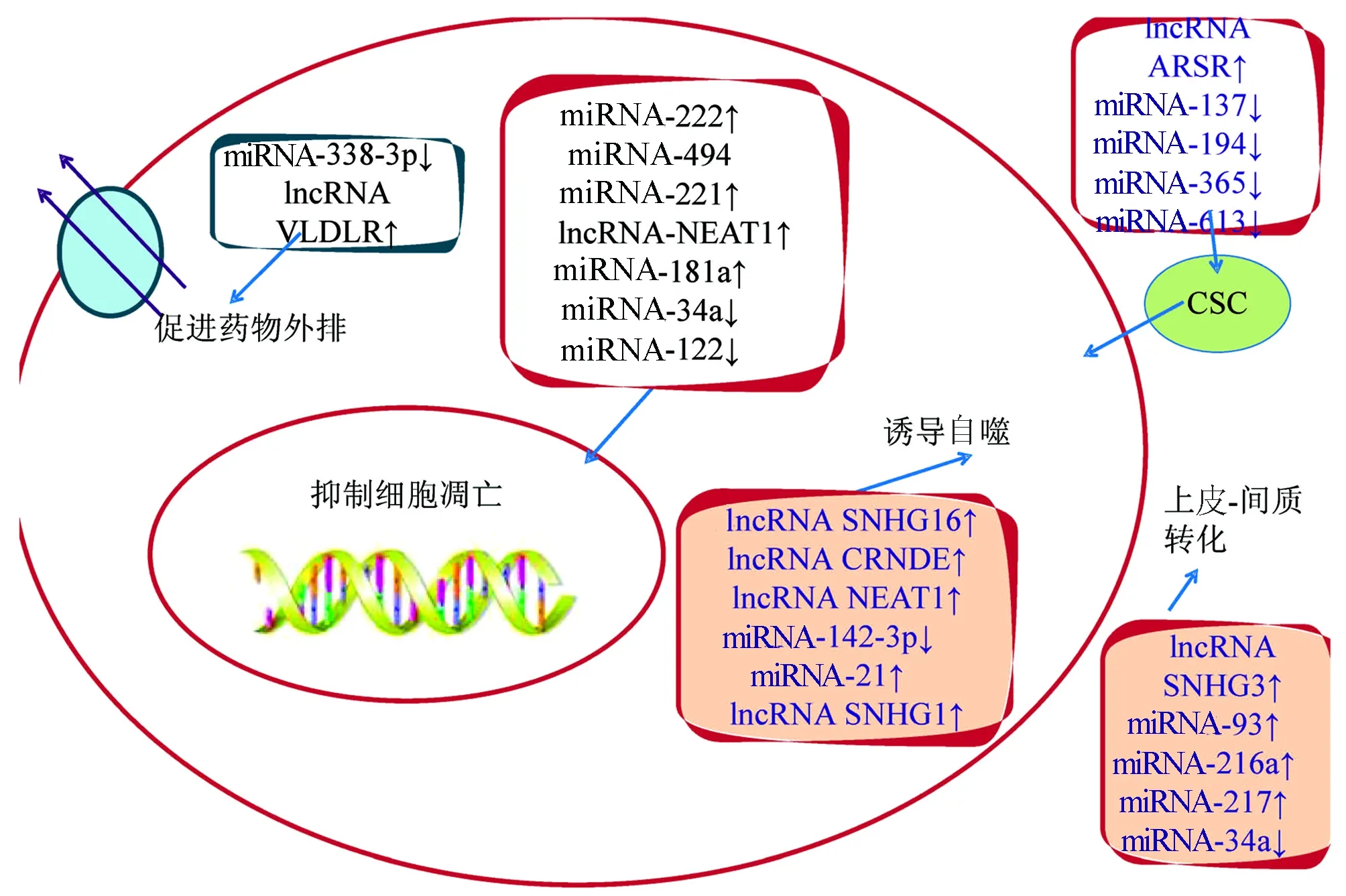
图1 ncRNA在HCC索拉非尼耐药中的效应机制
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:陈国想、周茉负责查找阅读及总结文献,分析资料,撰写论文;陈圣、王元、周元龙负责指导文章撰写;杨季红负责拟定写作思路,指导撰写文章并最后定稿。

