肿瘤组织中细胞间粘附分子-1表达的PET/近红外荧光跨模态靶向成像表征
李 淼,BARNHART Todd E,ENGLE Jonathan W
1西安交通大学第一附属医院医学影像科,陕西 西安710061;2威斯康星大学麦迪逊分校医学物理系,美国麦迪逊53705
细胞间粘附分子-1(ICAM-1)是一种跨膜糖蛋白,可介导肿瘤细胞与内皮细胞、胞外基质之间的识别和粘附,促进肿瘤血管生成和肿瘤转移[1-2]。ICAM-1的生理性表达水平较低,在乳腺癌、甲状腺癌组织中已被证实高表达。基于此表达差异的临床前靶向成像研究已见报道[3-4]。有报道称,胰腺癌组织相对于正常或胰腺炎组织也高表达ICAM-1[5-6]。胰腺癌是一种预后较差的恶性肿瘤。其早期症状隐匿,确诊时分级普遍偏高,病死率接近发病率[7-8]。由于手术是胰腺癌唯一可能的根治手段,而术后常见病灶残留及转移[9],故准确定位病灶显得尤为重要[10]。临床上常用于检测胰腺癌的血清学标志物(糖抗原CA19-9、癌胚抗原CEA等),其灵敏度虽高,但无法给出病灶的解剖定位[11-13];传统影像学手段虽能反映解剖定位,但只能给出物理信息,难以描述细微生物学改变,组织特异性不足[9]。已知分子影像学方法可选择性、全身、无创、实时监测。但临床常用于胰腺癌的葡萄糖代谢类、乏氧靶向类传统分子影像示踪剂属于小分子化合物、配体或底物,其靶组织特异性或浓聚程度尚不理想[14]。胰腺癌组织高表达ICAM-1,提示针对ICAM-1进行胰腺癌靶向成像或治疗不仅具有潜在临床价值,也具有可行性[6,15]。为克服前述传统示踪剂的不足,本研究拟基于具备高度特异性和亲和力的、针对ICAM-1的单克隆抗体(简称单抗)构建靶向示踪剂[16]。通过在单一靶向分子上标记荧光团/核素双标签制备示踪剂,分别用于近红外荧光(NIRF)和正电子发射断层(PET),以期获得较好的靶/非靶组织成像对比度。本研究提出采用跨模态对照成像表征胰腺癌组织中ICAM-1的表达情况这一新策略,旨在为肿瘤病灶的术前全身无创定位,以及为后续术中导航等临床应用提供有价值的跨模态融合成像技术路线,以期有助于改善治疗决策或患者预后。
1 材料与方法
1.1 试剂
小鼠抗人ICAM 1 单抗(克隆号R6-5-D6;BioXCell);1-(4-异硫氰酸苯基)-3-[6,17-二羟基-7,10,18,21-四氧-27-(N-乙酰羟胺)-6,11,17,22-四氮杂七烷二酮]硫脲,即p-SCN-去铁胺(Df);NIRF染料800 CW-N-羟基琥珀酰亚胺基酯(800 CW-NHS);AlexaFluor488标记山羊抗小鼠抗体(BioLegend);Pharmingen大鼠抗小鼠CD31抗体(BD);Cy3标记驴抗大鼠抗体(Jackson Immuno Research);非特异性人源IgG 对照品(Invitrogen);PD-10脱盐柱(GE医疗);超滤膜(相对分子 质 量 阈 值30 000;Life Technologies);基 质 胶(Gemini Bio-products);超纯浓盐酸(Mallinckrodt);溶于Vectashield介质的4',6-二脒基-2-苯基吲哚(DAPI)和其他试剂(ThermoFisher公司)。
1.2 荧光团和配合体耦联
通过抗体赖氨酸残基上的氨基分别与Df上的异硫氰酸酯基、800 CW-NHS 上的酯基进行耦联反应,以及通过放射性配位反应,来制备双标记ICAM-1单抗示踪剂。将Df 的二甲基亚砜溶液(10 μL)加入ICAM-1 单抗的磷酸盐缓冲生理盐水(PBS)1×/碳酸(氢)钠缓冲液(0.1 moL,pH 9.2)混合液(体积比1∶1,合计300 μL),Df与ICAM-1单抗的摩尔比为10∶1;室温振荡反应2 h;以PBS 1×为流动相,过PD-10柱纯化出Df-ICAM-1单抗产物,超滤(13 000×g)浓缩至500 μL;将5 μg 800 CW-NHS溶于无水二甲基亚砜(100 μL)制备储备液;将800 CW-NHS储备液和Df-ICAM-1单抗溶液(3 mg/mL,50 μL)加入PBS 1×/碳酸(氢)钠缓冲液的混合液(体积比1∶1,合计300 μL);Df-ICAM-1单抗与800 CW-NHS的摩尔比为1∶2,室温避光振荡反应2 h;过PD-10柱纯化出产物800 CW/Df-ICAM-1单抗,超滤浓缩至150 μL。
1.3 核素制备
[89Zr]锆采用PETtrace回旋加速器(GE)通过核反应89Y(p,n)89Zr制备。采用能量为16.4 MeV、强度5 mA的质子束流轰击[89Y]钇箔(厚度250 μm,纯度99.9%)2 h;将[89Y]钇箔溶于超纯浓盐酸,溶解液载入羟胺酸修饰树脂色谱柱;6 N盐酸淋洗,产物[89Zr]锆离子采用1 M草酸洗脱,收集草酸[89Zr]锆馏分。
1.4 核素标记
草酸[89Zr]锆溶于HEPES缓冲液(500 μL,0.5 moL,pH 7.0),用1 mol/L碳酸钠溶液调节pH值至7.0~7.5;将800 CW/Df-ICAM-1单抗加入反应体系(100 μg/mCi);37 ℃下恒温震荡(700 r/min)反应1 h;过PD-10柱纯化出800 CW/89Zr-Df-ICAM-1单抗(简称示踪剂)馏分,过0.22 μm滤膜除菌。
1.5 细胞培养
人源胰腺癌细胞系(BxPC-3、MIA PaCa)用RPMI 1640培养基(含高糖、10%胎牛血清),通入5%CO2气体,加湿,37 ℃恒温培养。当细胞铺满培养瓶底80%的面积时,消化收集用于后续测定和接种。
1.6 流式细胞术测定
BxPC-3、MIA PaCa细胞系的ICAM-1表达,采用流式细胞术(简称流式)测定。将细胞悬浮于预冷流式缓冲液均分成多管(约1.5×106个细胞/管);封闭后分别与预冷PBS 1×(作空白对照)、山羊抗小鼠抗体(作二抗对照,终浓度5 μg/mL)、ICAM-1 单抗和800 CW/Df-ICAM-1单抗(分别作一抗,终浓度均为5 μg/mL)在冰上孵育1 h;被ICAM-1单抗和800 CW/Df-ICAM-1单抗染色的细胞用预冷PBS 1×洗涤后,与山羊抗小鼠抗体(终浓度5 μg/mL)在冰上避光反应1 h;每个样品里的细胞分别重悬于预冷PBS 1×(300 μL),采用LSR Fortessa流式细胞仪(BD)测定。数据采用FlowJo软件分析。
1.7 皮下异种移植瘤小鼠模型构建
所有动物操作符合当地官方和所在单位的动物伦理规范。动物模型全部采用4~5周龄雌性无胸腺裸鼠(Envigo)构建。接种前将细胞重悬于预冷PBS 1×并与基质胶混合(体积比1∶1),置于冰上暂存;细胞悬液注射于右后肢皮下(5×106细胞/只)。肿瘤直径达到5~10 mm时用于活体研究。
1.8 活体PET/NIRF成像和离体放射性生物分布
给模型鼠经尾静脉注射5~10 MBq(0.14~0.27 mCi)示踪剂后,在预设时点(4、24、48、72、96、120 h)相继进行跨模态成像。采用Inveon 小动物PET/CT 扫描仪(Siemens)进行PET成像:模型鼠取俯卧位置于PET扫描床上;5~15 min 静态模式采集,无衰减/散射校正;OSEM3D算法重建;各器官感兴趣区(ROI)在Inveon Research Workstation(Siemens)软件上手动勾划;ROI定量摄取值记录为%ID/g。在肿瘤PET ROI摄取值达峰时点,模型鼠完成PET 扫描后,立即移入IVIS Spectrum 成像仪(PerkinElmer)进行NIRF 成像:取俯卧位以更好暴露病灶位置;NIRF 激发/发射波长为745 nm/800 nm;其他参数为IVIS系统默认值。
NIRF成像后立即处死小鼠并解剖。采集血液、主要器官和肿瘤组织,称重;各组织样本放射性计数用Wizard 2480 γ计数器(PerkinElmer)测定,换算为%ID/g值。
1.9 组织器官离体NIRF成像
另取BxPC-3 模型鼠注射示踪剂。在肿瘤PET ROI摄取值达峰时点,将模型鼠窒息处死,取俯卧位,立即进行全身白光明场照相和NIRF成像;剖开右后肢皮肤,暴露瘤体;切除肿瘤前后,再分别进行全身及瘤体的白光明场照相和NIRF成像,参数同上一节。
1.10 免疫组织化学
瘤块采集后立即冷冻切片(厚度5 μm);浸入预冷丙酮中固定10 min;室温放置3 min 风干;室温封闭30 min 后,切片与作为一抗的ICAM-1 单抗(终浓度10 μg/mL)在4 ℃共孵育过夜;切片与作为二抗的AlexaFluor488标记山羊抗小鼠抗体(终浓度5 μg/mL)在室温共孵育1 h;取毗邻切片与作为一抗的大鼠抗小鼠CD31 抗体(终浓度10 μg/mL)在4 ℃孵育过夜,然后切片与作为二抗的Cy3标记驴抗大鼠抗体(终浓度5 μg/mL)在室温孵育1 h;所有切片滴加DAPI浸润后加载盖玻片封片。在A1R共聚焦显微镜(Nikon)上观察。
1.11 统计学分析
定量资料以均数±标准差表示,均值的比较采用Student's t-检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌细胞系ICAM-1表达
BxPC-3与MIA PaCa细胞系的ICAM-1表达水平有显著差异,前者表达水平更高(图1)。经800 CW-和Df-基团修饰的ICAM-1单抗(即800 CW/Df-ICAM-1单抗)作一抗时,在上述2种细胞系中表现出来的荧光信号强度,与采用ICAM-1单抗作一抗时相似。

图1 流式细胞术测定的胰腺癌细胞系细胞间粘附分子-1(ICAM-1)表达Fig.1 Expression of ICAM-1 in pancreatic cancer cell lines detected by flow cytometry.
2.2 荧光团耦联及核素标记产物
在800CW-NHS 与Df-ICAM-1 单抗的耦联反应中,本研究选用了已经过验证的单抗-荧光团分子投料摩尔比(1∶2),以避免荧光团在单抗分子上耦联过于密集诱发自淬灭现象[17]。示踪剂终产物比活度为9.8±1.4 mCi(362.69±51.8 MBq/mg,n=6),未经衰减校正的[89Zr]锆标记反应放射化学产率>70%。
2.3 活体PET/NIRF成像和离体放射性生物分布
PET成像结果(图2)显示,在BxPC-3模型鼠中的肿瘤摄取值在示踪剂注射后24 h达峰(10.9±2.0%ID/g),之后随时间推移缓慢下降。在MIA PaCa模型鼠中,示踪剂注射后,肿瘤摄取值缓慢上升,在24 h到达平台期5.5±1.0%ID/g,并从96 h开始轻微下降。可见在摄取值峰值上,BxPC-3 肿瘤显著高于MIA PaCa 肿瘤(P<0.05)。2种模型鼠的其他器官,摄取值动力学曲线走势相似,其中肝、脾都有较高生理性摄取。离体放射性生物分布研究显示,示踪剂注射后120 h的生物分布摄取值与PET ROI摄取值基本一致(图3)。2种模型鼠在示踪剂注射24 h后的典型PET和NIRF对比成像中(图4)。
纵轴为每克组织注射剂量占比(%ID/g);横轴为示踪剂注射后时点;A:BxPC-3组(n=3);B:MIA PaCa组(n=4);P<0.05。
2.4 组织器官离体NIRF成像
组织器官离体NIRF成像研究结果示,解剖及瘤体切除前后,BxPC-3移植瘤体的位置和边界在白光明场视图和NIRF视图之间能准确匹配(图5)。瘤体移除后,NIRF信号从接种位点完全转移到瘤体,原接种位点几乎无残留信号。
2.5 免疫组织化学研究
荧光共聚焦显微成像显示(图6),BxPC-3肿瘤组织有强ICAM-1信号,而MIA PaCa肿瘤组织的ICAM-1信号弱。ICAM-1信号与肿瘤细胞周围位置重叠,与细胞核(DAPI)或血管(CD31)信号未见重叠。CD31信号分布在2种肿瘤组织中大致相当。

图2 胰腺癌模型鼠正电子发射断层成像感兴趣区摄取值动力学曲线Fig.2 Uptake kinetics of region of interest(ROI)in positron emission tomography (PET) images of mouse models of pancreatic cancer.

图3 示踪剂在胰腺癌模型鼠各组织器官的放射性生物分布(BxPC-3和MIAPaCa)Fig.3 Radioactive bio-distribution of the tracer in tumors and major organs of mouse models of pancreatic cancer (BxPC-3 and MIAPaCa).
3 讨论
ICAM-1可被视为经典胰腺癌成像靶标(整合素αvβ6、CEA、CA19-9等)之外的新型靶标[14,18-20]。已有报道将拉曼光成像、超声成像、磁共振成像和单光子发射断层成像(SPECT)用于胰腺癌ICAM-1成像。尽管这些模态肯定了ICAM-1用作胰腺癌成像靶标的可行性,但其灵敏度和定量能力无法媲美本文所采用的PET[3,21-24]。不论在PET还是NIRF模态,本文中的BxPC-3肿瘤与MIA PaCa肿瘤都显示出强烈视觉差异。免疫组织化学染色结果也确认,不同胰腺癌组织中ICAM-1的表达差异与前述PET/NIRF 成像和生物分布研究结果相吻合。这说明本文所构建的示踪剂,针对胰腺癌组织具有优越的体内靶向性和靶组织亲和力,本文所采用的PET/NIRF跨模态成像策略具备优良性能。
光学成像是最适合术中导航的模态[25],尤其是NIRF(700~900 nm),原因包括:(1)避开生物分子吸收光谱,背景干净;(2)可见光谱内的组织自发荧光比常规染料荧光团低;(3)相比其他波长的光,组织穿透性更好;(4)商品化试剂和成像仪器成本低,无电离辐射,临床转化潜力大;(5)空间/时间分辨率、灵敏度较其他光学模态好[26]。本文的组织器官离体NIRF成像时,在各类组织中可见肿瘤信号最强,与胰腺、脾脏组织视觉对比明显,说明背景组织信号不会干扰肿瘤边界辨识,证实了本文所构建的示踪剂在显示胰腺癌病灶和引导彻底切除肿瘤组织方面的效能。除胰腺癌外,ICAM-1也可作为卒中和动脉粥样硬化的NIRF成像靶标[27],其解剖位置较易区分,理论上不影响对胰腺癌的成像。已知NIRF是应用于胰腺癌的双模态成像共同选用的光学模态[28-31]。由此可知,本文所采用的NIRF的确是最适用于胰腺癌ICAM-1成像的次级模态。
胰腺癌多模态成像的可行性已被涉及其他靶标或模态的多项研究所证实[28-31],其优势在于:可交叉验证病灶定位;可引导内窥镜成像或穿刺;可在术中辅助确定肿瘤组织边界[19]。本文提出的跨模态成像策略,对同一单抗分子的双标记策略,可从信源层面进行模态间解剖定位配准;且相对于分别评价具有不同标记而靶向基团相同的两种示踪剂,本文直接评价双标记示踪剂可减少工作量。
在生物活性方面,800 CW/Df-ICAM-1单抗作一抗时,前述2种细胞系表现出的荧光信号强度与ICAM-1单抗作一抗时相似,说明本文所采用的荧光团和配合体耦联修饰方法并未显著减弱ICAM-1单抗的亲和力。在化学稳定性方面,活体PET成像、组织器官离体NIRF成像中均未见骨摄取,说明在前述示踪剂分子中[89Zr]锆与Df形成稳定配合物,未见体内脱标;在组织器官离体NIRF成像中,肝摄取不如肿瘤明显,说明疏水性荧光团脱落很少;以上现象都说明本文所构建的新型示踪剂稳定性良好。

图4 胰腺癌模型鼠跨模态成像的典型图像Fig.4 Typical intermodal images of mouse models of pancreatic cancer.

图5 BxPC-3胰腺癌模型鼠组织器官原位离体近红外荧光成像的典型图像Fig.5 In situ ex vivo near-infrared fluorescent imaging of typical BxPC-3 mouse model of pancreatic cancer.
本文局限之处在于:(1)采用异种移植瘤模型,故小鼠抗人单抗示踪剂可能并不能反映小鼠的生理性ICAM-1表达;(2)示踪剂在肝、脾都持续高摄取,可能是由于内皮网状系统对抗体的典型非特异性吸附-消除作用;(3)定植于细胞表面的膜型ICAM-1,其胞外结构域可被蛋白酶水解脱落,形成配体结合能力相当的可溶型散播到血液中[9,13],可能消耗部分示踪剂,干扰对肿瘤的靶向性。为抵偿此损失,本文提高了示踪剂注射剂量。故脾中高摄取可能是因为疏水性800 CW荧光团介导上述示踪剂分子自聚集[28];(4)本例采用了裸鼠皮下移植瘤模型。而基因工程或病理组织原位移植瘤模型,将能更好地模拟示踪剂与肿瘤微环境间的相互作用。
综上所述,本文报道了以ICAM-1为标志物,基于NIRF荧光团/[89Zr]锆核素双标记单抗示踪剂,对胰腺癌组织进行临床前靶向PET/NIRF 跨模态成像是可行的。这为同时实现肿瘤活体全身成像和肿瘤组织ICAM-1的原位可视化提供了例证。基于ICAM-1靶向成像进行病灶检测、手术导航、患者分层和预后评估,有望帮助实现更好的肿瘤精准诊疗实践。
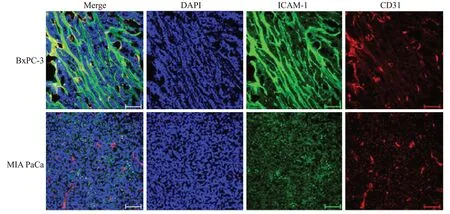
图6 胰腺癌移植瘤切片经免疫组织化学染色后的荧光共聚焦显微成像Fig.6 Confocal imaging of tissue sections from implanted tumors after immuno-fluorescent staining.Scale bar:100 μm.