食管鳞状细胞癌O6-甲基鸟嘌呤-DNA 甲基转移酶表达与CT 影像及病理特征的相关性
张海龙,郑欢欢,周科峰
南京大学医学院附属鼓楼医院医学影像科,江苏 南京210008
食管癌是一种常见上消化道恶性肿瘤,我国主要以食管鳞状细胞癌(ESCC)为临床好发病理类型[1-2]。近年来,我国ESCC的发病率居高不下,其肿瘤的发生和发展与多种DNA修复基因的改变及相应产物的表达密切相关[2-3]。O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)是一种重要的DNA直接修复酶,可通过自身的半胱氨基酸残基结合被转移来的6-氧甲基鸟嘌呤分子,特异性修复DAN损伤。已有研究证实MGMT的异常表达与食管癌的发病机制[4]、转移进展[5]及治疗敏感性[3]密切相关。既往研究显示,食管癌组织中MGMT启动子甲基化显著高于非恶性组织[5],替莫唑胺靶向药物可用于治疗MGMT异常表达的食管癌患者且效果可观[6]。尽早评估肿瘤MGMT的表达状态对临床诊疗显得尤为重要。而目前对于治疗前MGMT的评估,需依赖于内镜下活检肿瘤组织,这种检测手段不仅有创,而且存在抽样误差,是临床实践中的一大难题。指南推荐螺旋CT扫描是评估食管癌的首选常规无创检查,已有文献表明术前高级别胶质瘤CT值可以预测MGMT异常表达状态[7],但对于ESCC的CT影像与MGMT表达关系的研究鲜有报道。本研究收集相关病例,尝试分析比较不同MGMT表达状态下,ESCC的CT影像与临床病理特征的差异,旨在探讨MGMT的表达水平与ESCC的CT影像及临床病理特征之间的关系,为辅助临床评估ESCC的发生发展及选择敏感性的治疗方案提供额外的方法及依据。
1 资料与方法
1.1 一般资料
回顾性分析本院2015年1月~2019年12月经手术切除病理证实为ESCC的病例,收集术前胸部CT影像及临床病理资料。本回顾性研究已获得南京大学医学院附属鼓楼医院医学伦理委员会批准。入组病例纳入标准:手术切除病理证实为ESCC;术前行胸部CT平扫及增强检查;MGMT免疫组化、病理总分期、TN分期及分化程度等病理学资料齐全。排除标准:术前接受放化疗等辅助治疗;术前CT影像学资料不完整;术前CT图像上病灶因呼吸运动伪影等因素而无法清晰显示。本次研究最终纳入142例患者,其中男性112例,女性30例,年龄46~82岁(65±7.4岁)。
1.2 设备与扫描方法
入组患者术前采用16 排或64 排CT 扫描设备(Light Speed Pro 16, VCT, 联 影uCT780 64,或Discovery HD 750, GE Healthcare, Milwaukee, WI,USA)行胸部平扫及增强CT扫描。CT扫描参数如下:管电压120 kV,管电流250~350 mA,层厚5 mm,层间距5 mm,FOV 35~40 cm,矩阵512×512,旋转时间0.7 s/圈,螺距1.375。增强扫描采用高压注射器经肘前静脉注射碘海醇80~120 mL,注射速率为3.0 mL/s。
1.3 免疫组化
MGMT表达采用免疫组化SP法进行检测,若细胞核/质呈棕黄色颗粒,则MGMT表达为阳性。按照免疫组化染色所显示的阳性细胞含量所占比例,进行染色结果判定:阳性细胞含量<5%,(-);5%~25%(+,1+);26%~75%(++,2+);>75%(+++,3+)。其中将-/+(-/1+)定义为低表达组,++/+++(2+/3+)定义为高表达组。

图1 ESCC的典型CT图像及MGMT表达Fig.1 Representative CT images and MGMT expression of ESCC.
1.4 CT图像分析
由本院2名放射科医师基于医学影像PACS工作站对入组病例的术前CT图像进行评估,共同测量病灶平扫期和增强期CT值、轴位肿瘤最大厚度及轴位肿瘤垂直径(轴位上与肿瘤最大厚度相垂直的径长)。肿瘤CT值测量感兴趣区(ROI)选取原则:选取轴位上显示肿瘤的最大层面;测量肿瘤实性成分CT值,放置的圆形ROI应尽量避开肿瘤坏死及囊变部分;采用直线测量轴位肿瘤最大厚度及轴位肿瘤垂直径;计算肿瘤平扫期及增强期CT值的变化(ΔCT=增强CT值-平扫CT值)。
1.5 统计方法
应用SPSS22.0统计学软件处理数据,分类资料(临床病理学特征)采用χ2检验或Fisher精确检验。对CT影像参数(增强CT值、平扫CT值、ΔCT、轴位肿瘤最大厚度及轴位肿瘤垂直径)进行正态分布检验。计量资料若符合正态分布以均数±标准差表示,采用独立样本t检验,比较不同MGMT表达状态间CT影像参数值的差异;非正态分布则以中位数(四分位间距)表示,采用Mann-Whitney U检验。应用受试者工作曲线(ROC)评估各指标在预测MGMT不同表达状态时的效能。采用Spearman分析CT影像及病理特征与MGMT表达间的相关性。ROC曲线分析采用MedCalc软件。以P<0.05为差异有统计学意义。
2 结果
2.1 CT影像特征及术后病理结果
ESCC的CT平扫通常表现为食管壁增厚或形成软组织肿块,相应水平管腔不同程度狭窄,可伴有上方食管管腔的扩张积液。增强扫描后病灶表现为轻中度强化。本次研究纳入的142例ESCC术后病理检测证实,112例MGMT阳性表达,阳性表达率为78.87%。病理总分期中I期(IA、IB)24例,Ⅱ期(ⅡA、ⅡB)67例,Ⅲ期(ⅢA、ⅢB、ⅢC)49例,Ⅳ期(ⅣA)2例。1例MGMT阳性表达的ESCC病例(图1)。
2.2 MGMT不同表达状态与临床病理特征之间的关系
不同病理总分期的ESCC在MGMT低表达及高表达间差异有统计学意义(P=0.015,表1)。MGMT表达状态与年龄、性别、肿瘤分化程度、T分期及N分期差异均无统计学意义(P>0.05)。

表1 不同状态下的MGMT表达与临床病理特征的关系Tab.1 The relationship between different status of MGMT expression and clinicopathological characteristics[n(%)]
2.3 MGMT不同表达状态与CT影像特征之间的关系
MGMT阴性表达组的肿瘤增强CT值以及ΔCT值低于MGMT阳性表达组(P≤0.001,表2)。且在MGMT低表达组中,ESCC的增强CT值、ΔCT值以及轴位肿瘤最大厚度均高于MGMT高表达组(P<0.05)。MGMT的表达状态与肿瘤轴位垂直径无关(P>0.05)。
2.4 CT影像参数对MGMT不同表达状态的诊断效能
ROC曲线分析结果显示,CT影像参数可以区分MGMT不同表达状态,其中术前病灶的增强CT值和ΔCT值诊断价值最高,当增强CT值为70 Hu、ΔCT值为28 Hu 时,鉴别诊断MGMT 低表达与高表达的曲线下面积高达0.810、0.817,敏感度、特异性及准确性分别为85.00%、68.3%、75.37%和71.7%、78.0%、75.34%(表3、图2)。
2.5 CT影像及临床病理特征与MGMT表达的相关性
Spearman 分析结果显示,术前ESCC 的增强CT值、ΔCT值以及轴位肿瘤最大厚度与MGMT表达均具有相关性(r=-0.444、-0.473、-0.224,P<0.05)。术后肿瘤T分期及病理总分期与MGMT表达同样具有相关性(r=-0.193,P=0.021;r=-0.253,P=0.002)。
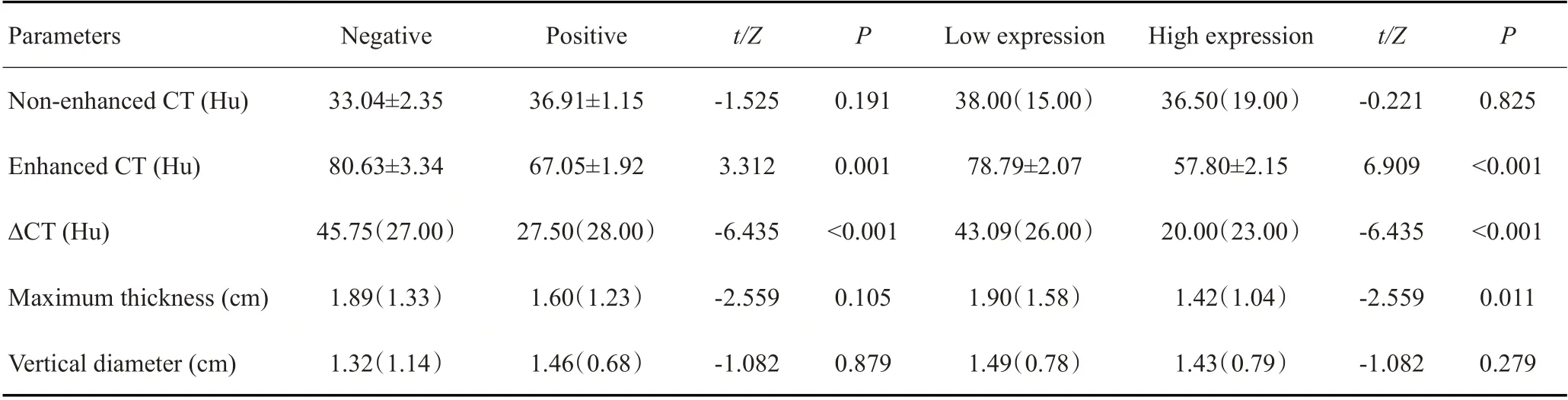
表2 不同状态下的MGMT表达与CT图像特征的关系Tab.2 The relationship between different status of MGMT expression and CT image features
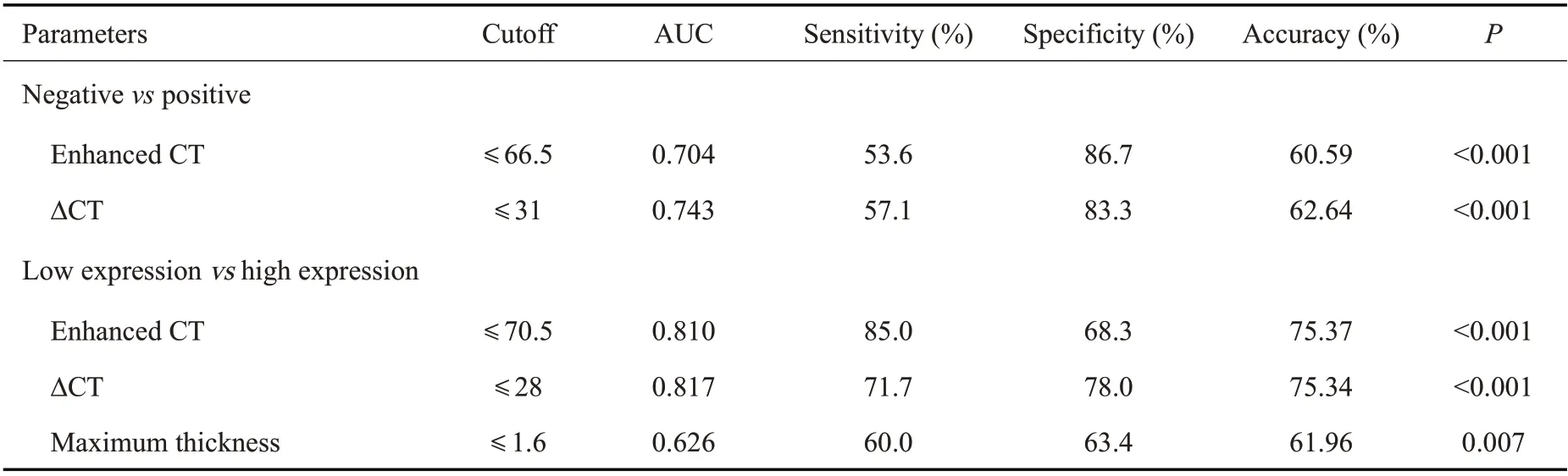
表3 CT成像对MGMT不同表达状态的诊断价值Tab.3 Diagnostic efficacy of CT imaging in differentiating different status of MGMT expression

图2 在高、低MGMT表达的诊断鉴别中的增强CT和△CT值ROC曲线Fig.2 ROC curves of enhanced CT and ΔCT value in the differential diagnosis of high and low MGMT expression.
3 讨论
3.1 MGMT与食管癌的关系
MGMT是一种高效DNA修复蛋白,参与抵御烷化剂所导致的细胞损伤。MGMT异常表达可影响多种肿瘤的进展及预后,例如胸腺瘤[8]、胶质瘤[9]及乳腺癌[10]。不同MGMT的表达状态在肿瘤特征及预后上存在差异[11],尽早获知MGMT的表达状态,不仅可以帮助临床选择合适的治疗方案,还有利于评估患者预后。ESCC是我国主要的食管癌病理类型,患者术前CT影像检查对临床诊疗具有重要意义[12]。既往研究表明食管癌组织中CD34和VEGF与CT强化程度有关[13],术前高级别胶质瘤CT值可以预测MGMT异常表达状态[7],但食管癌MGMT表达与CT特征之间的关系少见报道。本研究主要探讨不同MGMT表达下ESCC的CT影像以及病理特征的差异,结果提示ESCC的MGMT表达与CT影像及病理特征具有相关性,可在一定程度上帮助临床评估ESCC的发生发展及选择合适的治疗方案提供补充依据。
3.2 MGMT与肿瘤CT影像特征的相关性
本研究发现,术前MGMT 阴性及低表达组中ESCC的增强CT值以及ΔCT显著高于MGMT阳性及高表达组,并且与MGMT表达呈显著负相关性。既往研究表明食管癌组织中CD34和VEGF与CT强化幅度呈正相关[13],与本研究结果相反,这可能是由于CD34和VEGF可刺激血管生成,促进微血管通透,使CT增强程度增加;而MGMT是一种高效DNA修复蛋白,可以抵御细胞毒性损伤,当MGMT表达降低,其修复DNA损伤的效率也随之降低,导致细胞损伤加剧。随着癌细胞的增多,肿瘤实性成分也随之增多、密度随之增加,致使肿瘤的平扫CT值增大,强化程度增加,增强CT值增高。既往研究发现,术前高级别胶质瘤CT平扫衰减值可以预测MGMT异常表达状态[7],与本研究结果不同,可能是由于肿瘤本质不同且病例数少。有研究报道MGMT异常表达在食管癌早期阶段即可出现[11],本研究中ROC曲线分析表明,病灶增强CT值及ΔCT值在预测MGMT表达的诊断效能最佳,曲线下面积高达0.810及0.817,这也许能为术前预测MGMT在ESCC中存在异常表达提供依据。
本研究结果显示肿瘤轴位最大厚度在MGMT低表达及高表达组中的差异存在统计学意义。近年来有研究发现ESCC轴位最大厚度与患者的治疗效果和预后相关[14-15]。国内学者发现,在接受放化疗的晚期ESCC中,肿瘤轴位最大厚度<2 cm与≥2 cm患者之间的生存率差异存在统计学意义[15]。也有研究报道,放化疗前病灶最大厚度小于1 cm组的患者总生存率显著优于病灶最大厚度大于或等于1 cm 组的患者[14]。本研究中,MGMT低表达组中的轴位肿瘤最大厚度高于MGMT高表达组。MGMT低表达促进肿瘤细胞增殖,而肿瘤轴位最大厚度处,肿瘤细胞聚集相对较多,肿瘤数目增多,密度增高,与既往研究中最大厚度与患者疗效及预后相关的结果相符合。
3.3 MGMT与肿瘤临床病理特征的相关性
本研究中,MGMT表达与患者性别、年龄及肿瘤淋巴结状态无关,与既往报道一致[16]。既往研究发现,MGMT表达状态在ESCC、腺样结构食管癌及小细胞癌存在显著差异,表明MGMT表达可能与肿瘤的恶性程度相关[17]。研究报道,相较于早期食管癌(I期和II期),MGMT表达缺失更容易出现在晚期食管癌患者中(III期和IV期)[16]。本研究也发现ESCC的病理总分期及T分期与MGMT表达状态呈负相关,与既往研究结果大致相仿。随着肿瘤T分期及病理总分期升高,预示着肿瘤浸润食管组织结构程度的加深,肿瘤的侵袭性增大,肿瘤的恶性程度加剧,结果显示MGMT的表达显著降低,提示MGMT阴性及低表达在ESCC进展过程中起重要作用,可能表明MGMT 异常表达可能成为评估ESCC预后的一种生物学指标。目前已有研究表明,MGMT异常表达与食管癌的发展及临床预后密切相关[11],在其他消化系统肿瘤中也同样被证实其预后价值,如胃癌[18-19]、直肠癌[20-21]以及胰腺神经内分泌肿瘤[22]等。此外,有研究表明ESCC患者MGMT异常表达与肿瘤分化程度之间没有相关性[23],这与我们的研究结果相一致;但早期也有学者认为MGMT表达与食管腺癌的分化程度有关[24]。对比既往研究,主要区别在于我们纳入的均是ESCC,结果显示不同食管癌病理类型的MGMT表达与肿瘤分化程度的关系存在差异,为明确两者之间的关联,需在扩大样本量的同时,还要严格区分不同食管癌病理类型,从而进一步研究验证。
综上所述,MGMT异常表达可能参与ESCC的发生与发展过程,术前CT图像不仅能从形态学上观察病灶大体情况,而且CT值可以定量分析MGMT在肿瘤中的表达状态,尤其术前肿瘤增强CT值及增强前后差值可较好的预测MGMT的不同表达状态,对评估ESCC的发展及选择合适的治疗方案具有一定临床辅助价值。本研究仍存在一些不足:样本量较小,且仅纳入ESCC患者,在今后的研究中将进一步扩大样本量且尽可能的加入其他病理类型的食管肿瘤,验证研究结果的准确性;由于本文为回顾性研究,未将ESCC与正常食管粘膜MGMT表达情况进行分析比较,将在后续研究中完善。