α-唾液淀粉酶胶体金免疫渗滤法的建立及其在中药酶学作用研究中的应用
金旻逸,丁越,陈静雯,兰金帅,李俊松,钟高仁,张彤
1.上海中医药大学教学实验中心,上海201203;2.复旦大学附属妇产科医院,上海200090;3.复旦大学药学院,上海200032
α-唾液淀粉酶(salivary alpha-amylase,sAA)是唾液中最丰富的蛋白质,主要由腮腺、下颌下腺和舌下腺分泌,属于消化酶的一种,可水解α-1,4 糖苷键,将淀粉降解为葡萄糖和麦芽糖[1-2]。sAA 与腮腺炎、糖尿病[3-4]、压力诱导的各种心身疾病,如失眠[5]、焦虑[6]、社会心理应激[7]等的发生密切相关。因此,作为良好的非侵入性生物标志物,常被用于多种疾病的早期诊断和后期疗效评估。
sAA 的传统检测方法包括淀粉-碘化钾比色法、分光光度法[8]、ELISA 法、免疫荧光法[9]等,但这些方法操作费时,需要借助大型仪器和专业人员,较难实现现场快速检测。而生物传感器技术、免疫试纸条技术的不断发展,均为sAA 快速检测方法的研究提供了新的技术支持。如VENTURA 等[10]采用石英晶体微天平结合光化学固定技术实现了人体液中sAA 的快速定量检测;ZHANG 等[11]以淀粉为反应底物,利用sAA 水解作用将淀粉分解为麦芽糖,再通过麦芽糖与铁氰化钾在碱性条件下发生氧化还原反应而引起的电位变化计算酶活性,最终建立起基于电位法的sAA 快速检测方法。
胶体金免疫渗滤法是在ELISA 试验、胶体金标记技术和试纸条快速检测技术的基础上,利用特异性抗原抗体反应,根据渗滤膜上的斑点显色情况对目标物进行定性或半定量检测的方法,该方法操作简便,检测时间短,成本低,无需大型仪器,方便大规模生产,特别适合目标物的现场即时分析。为了进一步提高sAA 在临床诊治及患者自我监测中的检测效率,本研究采用胶体金标记技术,制备金标抗体复合物,并根据竞争抑制原理,在最佳渗滤条件下,建立sAA 胶体金免疫渗滤半定量检测方法。同时,鉴于sAA 与中医脾气虚证疗效评价的相关性,将研制的免疫渗滤试纸应用于中药白术及葛根的酶学作用研究,进一步验证新方法在实际应用中的可行性。
1 材料与方法
1.1 主要试剂及仪器 胶体金(20 nm)、吸水垫、渗滤卡购自上海杰一生物科技有限公司;sAA 多克隆抗体(9.6 mg / mL)、sAA 购自SIGMA-ALDRICH(中国);牛血清白蛋白(BSA)购自碧云天生物技术有限公司;磷酸盐粉剂、PBST 购自上海源叶生物科技有限公司;硝酸纤维素膜(NC 膜,0.45 μm)购自美国GE Healthcare Life science;碳酸钾、Tween 20、甲醇、浓硫酸、pH 试纸(精密)购自国药集团化学试剂有限公司;Goat anti-rabbit IgG-HRP、TMB One Solution(HRPbased ELISA)购自爱必信上海生物科技有限公司;AffiniPure Donkey Anti-Rabbit IgG(H + L)购自Jackson ImmunoResearch Laboratories,INC.;96 孔 酶 标板购自康宁(上海)管理有限公司。
1.2 饮片 生白术饮片、炒白术饮片、葛根饮片购自上海虹桥中药饮片有限公司。
1.3 胶体金质量评定 采用目测法观察胶体金溶液(20 nm)颜色、透明度,再利用紫外-可见分光光度计在200 ~ 1 100 nm 范围内全波长扫描,测定其最大吸收波长,观察最大吸收峰的峰形和峰宽。
1.4 胶体金标记sA A 抗体的最适条件筛选
采用紫外分光光度法和目测法分别筛选最佳pH 值和最佳抗体标记量[12]。
1.4.1 最佳pH 值
1.4.1.1 紫外分光光度法 在5 mL 胶体金溶液中分别加入不等量(0、50、100、200、300、400 μL)0.1 mol / L K2CO3,调pH 值至5.5、6.5、7.0、8.0、8.5、9.0,取1.5 mL 试管,分别加入上述1 mL 不同pH 值的胶体金溶液和同体积抗体(48 μg / mL),静置15 min,4 ℃,447 ×g离心10 min,取上清液,在400 ~ 600 nm 范围内测定其最大吸收波长和吸光度值,将最大吸收峰处所对应的胶体金pH 值作为最佳标记pH 值。
1.4.1.2 目测法 在胶体金标记抗体样品中加入100 μL 10% NaCl 溶液,8 h 后观察颜色变化。
1.4.2 最佳抗体标记量
1.4.2.1 目测法 在1 mL 胶体金溶液(pH 8.5)中分别加入同体积不同稀释比例(1 ∶100、1 ∶150、1 ∶200、1 ∶250、1 ∶500、1 ∶1 000、1 ∶2 000)的抗体溶液,对照管分别加入PBS 缓冲液(0.01 mol / L,pH 7.4)和蒸馏水,充分混匀,静置15 min,再分别加入100 μL 10% NaCl 溶液,混匀后静置2 h,观察混合液颜色变化,将刚好由红变蓝时的抗体浓度再加20%,作为最佳标记量。
1.4.2.2 紫外分光光度法 将胶体金标记抗体样品静置15 min,加入100 μL 10% NaCl 溶液后,静置10 min,4 ℃,447×g离心10 min,取上清液,在400~600 nm 范围内扫描,测定其最大吸收波长和吸光度值,以出现最大吸收峰时所对应的抗体用量为最小保护剂量,在此基础上增加20%,作为稳定的抗体蛋白用量。
1.5 金标抗体复合物的制备 取5 mL 用0.1 mol / L K2CO3溶液调至最佳pH 值的胶体金溶液,不断搅拌下缓慢加入5 mL 最佳稀释比例的sAA 抗体,混匀,磁力搅拌20 min;加入2.5 mL 5% BSA 至终浓度为1%,再缓慢转动20 min,4 ℃过夜;将上述金标抗体复合物4 ℃,447 ×g低速离心15 min,取上清液,11 180 ×g高速离心30 min;弃上清液,保留管底沉淀,用250 μL Tris-HCl 缓冲液溶解,4 ℃保存备用。
1.6 金标抗体复合物的质量分析 采用紫外分光光度法、Mey 氏稳定化试验法、ELISA 法对金标抗体复合物进行质量分析,验证复合物的稳定性及抗体活性。
1.6.1 紫外分光光度法 在400 ~ 800 nm 范围内对胶体金和金标抗体复合物的最大吸收波长进行测定,判断金标抗体复合物是否制备成功。
1.6.2 Mey 氏稳定化试验法 在2 mL 金标抗体复合物、胶体金溶液中分别加入200 μL 10% NaCl 溶液,混匀,室温静置3 h,观察颜色变化,判断金标抗体复合物的稳定性。
1.6.3 ELISA 法 分别加入100 μL 浓度为0.000 5、0.005、0.05、0.5 μg / mL 的sAA 至96 孔酶标板中,4 ℃包被12 h;加入PBST(0.05%),100 μL / 孔,洗涤3 次,每次3 min,加入1% BSA,100 μL / 孔,37 ℃封闭2 h;同上洗涤3 次,加入不同稀释比例(1 ∶6、1 ∶24、1 ∶96、1 ∶384、1∶1 536、1 ∶6 144)的金标抗体复合物,100 μL / 孔,37 ℃孵育1 h;同上洗涤3 次,分别加入Goat anti-rabbit IgG-HRP(1 ∶10 000或1∶100 000 稀释),100 μL / 孔,37 ℃孵育1 h;同上洗涤3 次,加入底物显色液(TMB One Solution),100 μL / 孔,37 ℃避光显色30 min;加入2 mol / L H2SO4,100 μL / 孔,终止反应;用酶标仪测定各孔A450值,以P / N ≥2,即A450值大于2 倍空白对照的最高稀释比例作为抗体的ELISA 终点效价。
1.7 sA A 胶体金免疫渗滤法的建立
1.7.1 实验方法 将硝酸纤维素膜用蒸馏水浸泡8 min,取出晾干,膜上画出直径6 mm 的圆圈,将10 μL 工作浓度的sAA 包被于圆圈中,质控组包被2 μL 1.3 mg / mL Affinipure Donkey Anti-rabbit IgG,分别用50 μL 封闭液渗透全膜,进行封闭,再用100 μL PBST 洗涤NC 膜3 次,室温下自然干燥;将10 μL待测样品与10 μL 金标抗体复合物提前混合反应,一起加至渗滤卡后,竞争性地与膜上的包被抗原结合,洗涤后,根据反应膜圆圈内斑点的显色情况判断待测样品是否呈阳性,质控组斑点应显示红色,否则实验无效[12]。
1.7.2 试验条件的优化 采用单因素试验对包被液种类、包被条件、封闭液种类、封闭条件、洗涤液种类、抗原抗体最佳工作浓度、包被抗原与金标抗体反应条件、待测样品与金标抗体反应条件等8 个影响因素进行优化,得出胶体金免疫渗滤法最佳反应条件[12]。
1.8 胶体金免疫渗滤试纸性能的验证
1.8.1 灵敏度 按胶体金免疫渗滤法最佳反应条件,对不同质量浓度(0、0.25、0.5、1、5、10、20、80、320、640、750、1 000 μg / mL)的sAA 待测样品进行检测,根据试纸的显色结果判断方法灵敏度。其中空白对照组1 加入的样品为20 μL 0.01 mol / L PBS 缓冲液(pH 7.4),空白对照组2 包被含8%甲醇的0.01 mol / L PBS 缓冲液(pH 7.4),加入的样品为10 μL 0.01 mol / L PBS 缓冲液(pH 7.4)与10 μL金标抗体(1 ∶1)的混合液。
1.8.2 初步稳定性 将包被有抗原的渗滤试纸密封保存于4 ℃,每隔7 d 取3 份渗滤试纸检测质量浓度为0.5 μg / mL 的sAA 待测样品,连续考察1 个月,以试纸显色情况,判断试纸的初步稳定性。
1.9 sA A 胶体金免疫渗滤法在中药酶学作用研究中的应用
1.9.1 白术提取液对sAA 活性影响的检测 将10 μL不同浓度(15.625、31.25、62.5 mg / mL)的生白术或炒白术提取液与10 μL 320 μg / mL sAA 溶液,于37 ℃水浴反应15 min;加入10 μL 金标抗体原液,继续37 ℃水浴反应15 min;反应结束后,将混合样品加至免疫渗滤卡内,通过与空白对照组斑点的显色深浅进行对比,判断白术水提液对sAA 与其抗体特异性结合活性的影响。其中,空白对照组以双蒸水代替白术提取液,质控点斑点应显红色,否则试验无效。
1.9.2 葛根提取液对sAA 活性影响的检测 将10 μL不同浓度(25、50、100、1 000 mg / mL)的葛根提取液与10 μL 10 μg / mL sAA 溶液于37 ℃水浴反应15 min;加入10 μL 金标抗体(1 ∶1)溶液,继续37 ℃水浴15 min;反应结束后,将混合样品加至免疫渗滤卡内,通过与空白组斑点的显色深浅进行对比,判断葛根提取液对sAA 与其抗体特异性结合活性的影响,各浓度葛根提取液样品平行检测2 份。其中,空白对照组以双蒸水代替葛根提取液,质控点斑点应显红色,否则实验无效。
2 结 果
2.1 胶体金质量 胶体金溶液(20 nm)呈鲜亮的酒红色,无明显漂浮物和颗粒沉淀。在200 ~ 1 100 nm波长范围内有1 个单吸收峰,最大吸收波长为519 nm,且吸收峰峰宽较小,表明金纳米粒子分布均匀,见图1。

图1 胶体金紫外可见光吸收光谱Fig.1 UV visible absorption spectrum of colloidal gold
2.2 胶体金标记sA A 抗体的最适条件
2.2.1 最佳pH 值 不同pH 条件下的胶体金标记抗体溶液放置8 h 后,仅pH 值为8.5 和9.0 的样品仍保持红色不变,见图2;不同pH 值(5.5、6.5、7.0、8.0、8.5 和9.0)的胶体金标记抗体溶液的吸光度值分别为0.289 3、0.304 5、0.272 6、0.337 7、0.354 6 和0.324 0,当pH 值为8.5 时,胶体金标记抗体溶液的吸光度值最大,确定pH 8.5 为最佳标记pH 值。
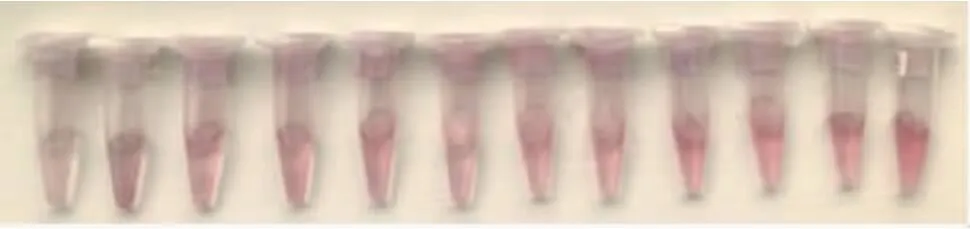
图2 胶体金标记抗体溶液放置8 h 后溶液颜色的变化Fig.2 Change in color of colloidal gold nanoparticle-labeled antibody bioconjugates after storage for 8 h
2.2.2 最佳抗体标记量 胶体金溶液与稀释比例为1 ∶100、1 ∶150、1 ∶200、1∶250 和1 ∶500 的抗体蛋白结合时,溶液的吸光度值分别为0.419 4、0.438 2、0.327 9、0.273 2 和0.199 5,稀释比例为1 ∶1 000和1 ∶2 000 时未检测到吸光度值;与稀释比例为1 ∶100 和1 ∶150 的抗体蛋白结合时,溶液颜色保持不变,稀释比例为1 ∶150 时,溶液吸光度值最大,在此基础上增加20%,即以抗体稀释比例1 ∶125 作为最佳抗体标记量。见图3。
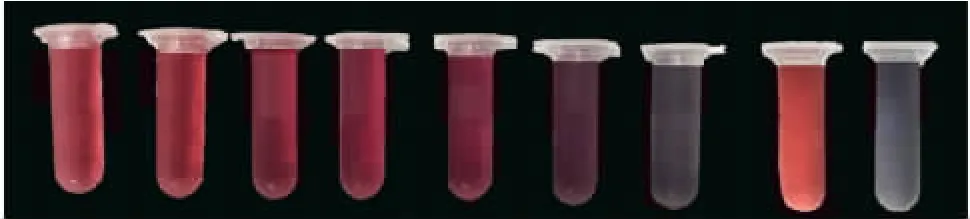
图3 2 h 后胶体金标记抗体溶液的颜色变化Fig.3 Change in color of colloidal gold nanoparticle-labeled antibody bioconjugates after storage for 2 h
2.3 金标抗体复合物的质量分析 根据胶体金标记sAA 抗体的最适条件,确定金标抗体复合物的制备方法:取5 mL 用0.1 mol / L K2CO3调至最佳标记pH 值为8.5 的胶体金溶液,不断搅拌下缓慢加入5 mL 稀释比例为1 ∶125 的sAA 抗体,磁力搅拌20 min;加入2.5 mL 5% BSA 至溶液终浓度为1%,继续缓慢搅拌20 min,4 ℃放置过夜;4 ℃,447 ×g低速离心15 min,收集上清液,4 ℃,11 180 ×g高速离心30 min,弃上清液,留离心管底部沉淀,250 μL Tris-HCl 缓冲液溶解,4 ℃保存备用。
紫外分光光度法检测结果显示,当抗体通过静电吸附结合至胶体金颗粒表面后,胶体金粒径发生变化,最大吸收波长发生红移,吸收峰峰宽增加,金标抗体复合物制备成功,见图4;Mey 氏稳定化试验法观察结果显示,加入10%氯化钠溶液后,胶体金溶液立即变为蓝色,而金标抗体复合物在室温下静置3 h,仍保持红色不变,表明金标抗体复合物稳定性良好,见图5;ELISA 法检测结果显示,抗原包被浓度为0.5 μg / mL,二抗稀释比例为1 ∶100 000 时,抗体稀释比例与A450值线性关系较好,A450值的变化能反映抗体浓度的变化,因此将金标抗体复合物的效价定为1 ∶384,见图6。
2.4 sA A 胶体金免疫渗滤法试验条件的优化
2.4.1 包被缓冲液 空白对照组的渗滤膜上无斑点显色,背景干扰较少,实验组中,使用含8%甲醇的PBS 缓冲液(0.01 mol / L,pH 7.4)稀释抗原进行包被,渗滤膜上斑点最深,最均匀,显色效果最好,因此,选择0.01 mol / L pH 7.4 PBS + 8%甲醇作为包被液,见图7。
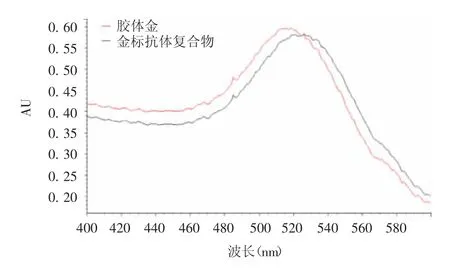
图4 胶体金与金标抗体复合物紫外可见光谱对比图Fig.4 UV-visible spectrum of AuNPs and AuNPs-antibody bioconjugate

图5 金标抗体复合物和胶体金的稳定性观察Fig.5 Stability of AuNPs-antibody and AuNPs
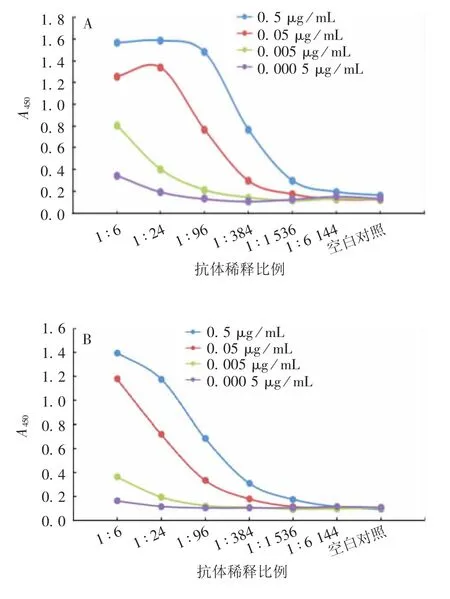
图6 金标抗体复合物效价的ELISA 检测Fig.6 ELISA titer of colloidal gold-labeled antibody bioconjuage

图7 包被缓冲液的选择Fig.7 Optimization of coating buffer
2.4.2 包被条件 37 ℃包被15 或30 min,渗滤膜上斑点颜色均较深,且均匀,考虑到检测时间的长短,确定37 ℃包被15 min 为最佳包被条件,见图8。

图8 包被条件的选择Fig.8 Optimization of condition for coating
2.4.3 封闭液 用0.01 mol/L pH 7.4 PBS+2%BSA作为封闭液时,渗滤膜上斑点显色均匀,颜色最深,为最佳封闭液,见图9。

图9 封闭液的选择Fig.9 Optimization of blocking buffer
2.4.4 封闭条件 渗滤样品在37 ℃下封闭15 min,膜上斑点显色均匀,效果最佳,确定最适封闭条件为37 ℃15 min,见图10。
2.4.5 洗涤液 洗涤液为0.01 mol/L PBS 时,斑点虽然显色最深,但不均匀,部分金标抗体黏附在膜上无法洗涤干净;而洗涤液为0.01 mol /L PBS+0.4%Tween-20 和0.01 mol / L PBS + 0.6% Tween-20时,斑点显色均匀,颜色较深,考虑到节省试剂用量,最终以0.01 mol / L PBS + 0.4% Tween-20 作为最适洗涤液,见图11。
2.4.6 抗原抗体最佳工作浓度 当金标抗体使用原液时,其浓度过高,包被抗原为0 μg / mL 时,仍存在背景干扰,对样品检测会产生较大影响;当金标抗体稀释比例为1 ∶3、1 ∶6、1 ∶12 和1 ∶24 时,斑点颜色太淡或基本无色,无法进行结果判断;只有当金标抗体稀释比例为1 ∶1 时,不仅背景干扰较小,且包被抗原浓度为10 ~ 25 μg / mL 时,斑点显色均匀,颜色较深,考虑到节省试剂用量,最终以10 μg / mL 作为最佳抗原包被浓度,1 ∶1 作为最佳金标抗体稀释比例,见图12。

图10 封闭条件的选择Fig.10 Optimization of condition for blocking

图11 洗涤液的选择Fig.11 Optimization of washing buffer
2.4.7 包被抗原与金标抗体反应条件 将10 μL 稀释比例为1 ∶1 的金标抗体加在包被10 μL 10 μg/mL sAA 的NC 膜上,25 ℃反应10 min,样品斑点淡,无法进行判断,20 min 时,斑点显色均匀;37 ℃反应10 min时,斑点显色与25 ℃20 min 时相似,当时间增加至20、30、60 min 时,斑点颜色加深,但由于温度较高,受热时间较长,导致部分金标抗体黏附在NC 膜上无法洗涤干净,斑点显色不均匀,因此,将25 ℃反应20 min 作为金标抗体与包被抗原的最佳反应条件。见图13。

图12 金标抗体稀释比例为1 ∶1 时的抗原最佳包被浓度选择Fig.12 Optimization of antigen concentration for coating at a dilution ratio of colloidal gold-labeled antibody of 1 ∶1

图13 包被抗原与金标抗体最适反应条件的选择Fig.13 Optimization of condition for reaction of coated antigen with colloidal gold-labeled antibody
2.4.8 待测样品与金标抗体反应条件 37 ℃条件下,待测样品中的酶与金标抗体结合较多,相应NC膜上的斑点显色较浅,为了使待测样品中的酶能与金标抗体结合完全,将37 ℃作为最佳反应温度,并继续考察反应时间,见图14;在37 ℃条件下,分别预先反应15 和20 min,渗滤样品的斑点显色效果无明显差异,为缩短反应时间,提高检测效率,将37 ℃反应15 min 作为待测样品与金标抗体预先反应的最适条件,见图15。

图14 待测样品与金标抗体最适反应温度Fig.14 Optimization of temperature for reaction of test samples with colloidal gold-labeled antibody
2.5 sA A 胶体金免疫渗滤法的建立 通过实验条件优化,确定sAA 胶体金免疫渗滤法的操作步骤。①包被:将10 μL 10 μg / mL sAA(用含8%甲醇的0.01 mol / L pH 7.4 PBS 稀释)包被于NC 膜中央的圆圈中;质控点包被2 μL 1.3 mg / mL Affinipure Donkey Anti-rabbit IgG;37 ℃包被15 min;②封闭:以50 μL 含2% BSA 的0.01 mol / L pH 7.4 PBS为封闭液,渗透全膜,37 ℃封闭15 min;③洗涤:用100 μL 含0.4% Tween-20 的0.01 mol / L PBS 洗膜3 次;④待测样品与金标抗体反应:将10 μL 待测样品与10 μL 稀释比例为1 ∶1 的金标抗体在37 ℃条件下反应15 min;⑤样品检测:将20 μL 待测样品与金标抗体预反应液加至渗滤膜,25 ℃反应20 min,再用100 μL 含0.4% Tween-20 的0.01 mol / L PBS洗膜3 次,观察斑点显色情况;⑥结果判断:根据NC膜上的斑点显色情况判断待测样品是否呈阳性,质控点斑点应显红色,否则实验无效。

图15 待测样品与金标抗体最适反应时间Fig.15 Optimization of time for reaction of test samples with colloidal gold-labeled antibody
2.6 胶体金免疫渗滤试纸的性能验证
2.6.1 灵敏度 当sAA 浓度低于5 μg / mL 时,斑点显色与0 μg / mL 样品无明显差异,因此将酶浓度低于5 μg / mL 样品判为阴性;当sAA 浓度为5 ~1 000 μg / mL 时,试纸检测区斑点颜色逐渐变浅,且明显浅于0 μg / mL 的斑点颜色,因此免疫试纸的检测灵敏度为5 μg/mL;当sAA 浓度高于1 000 μg/mL时,斑点显色趋于空白对照组,因此将酶浓度高于1 000 μg / mL 样品判为阳性。见图16。

图16 胶体金渗滤试纸灵敏度考察结果Fig.16 Test for sensitivity of colloidal gold filtration test paper
2.6.2 初步稳定性 4 ℃条件下每隔7 d 取3 个试纸检测sAA 样品,结果显示,28 d 内试纸稳定性和重复性均良好,见图17。
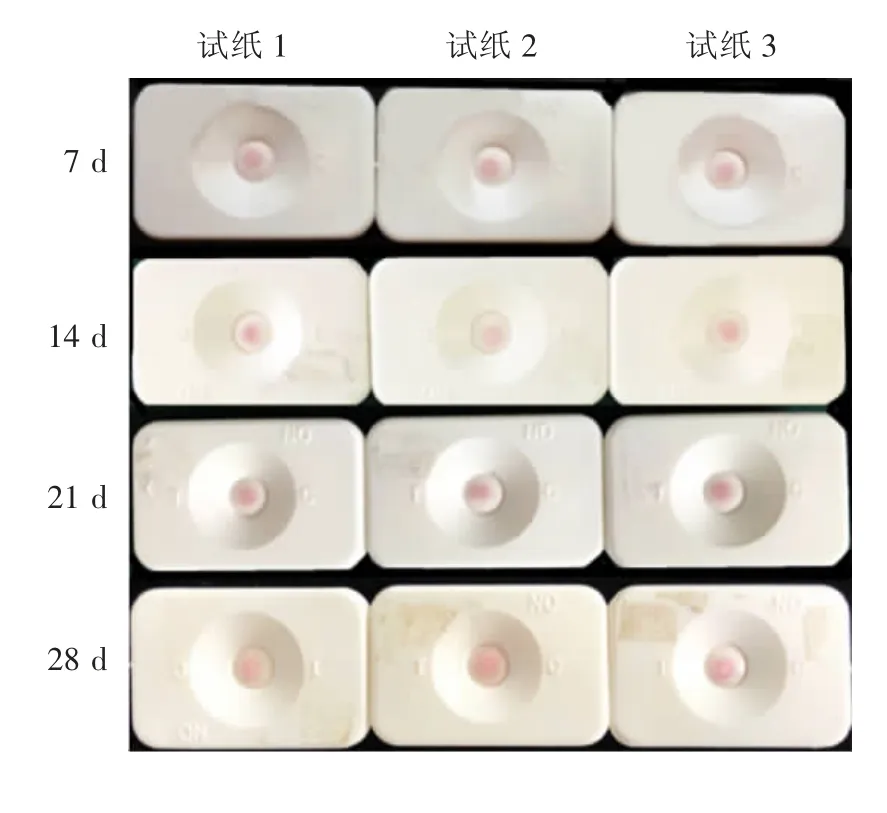
图17 胶体金免疫渗滤试纸的稳定性考察结果Fig.17 Test for stability of colloidal gold filtration test paper
2.7 sA A 胶体金免疫渗滤法在中药酶学作用研究中的应用
2.7.1 白术提取液对sAA 与其抗体特异性结合的影响 白术提取液对sAA 与其抗体的特异性结合活性有一定的促进作用,样品组斑点随白术提取液浓度的增加变浅,表明促进作用与浓度呈正相关,见图18。

图18 白术水提液对酶-抗体特异性结合的影响Fig.18 Effect of Atractylodes macrocephala water extracts on specific binding of sAA to antibody
2.7.2 葛根提取液对sAA 与其抗体特异性结合的影响 葛根提取液对sAA 与其抗体的特异性结合活性有一定的抑制作用,会减少酶与金标抗体的结合,样品组斑点随提取液浓度的增加变深,表明抑制作用与浓度呈正相关,见图19。
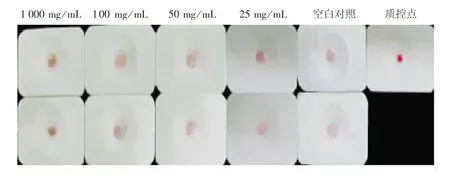
图19 葛根水提液对酶-抗体特异性结合的影响Fig.19 Effect of Pueraria lobata water extracts on specific binding of sAA to antibody
3 讨 论
sAA 是唾液蛋白的主要成分,占唾液总蛋白的40% ~50%,常作为反映消化道疾病的主要指标[13]。鉴于唾液生物标志物采集、存取的方便,建立一种简便、快速、低成本的sAA 快速检测方法对相关疾病的临床诊治及患者自我监测具有重要意义。
本研究采用胶体金标记技术制备金标抗体复合物,为sAA 免疫渗滤法的构建提供了参考。pH 值和抗体标记量是影响胶体金标记技术的两大因素,经紫外分光光度法和目测法判断,pH 值为8.5 的胶体金溶液标记稀释比例为1 ∶125 的sAA 抗体(原浓度为9.6 mg / mL),可获得稳定性、活性均良好的金标抗体复合物。
在此基础上,利用纸基免疫渗滤技术,通过包被液种类、包被条件、封闭液种类、封闭条件等8 个影响因素的考察,优化免疫渗滤实验条件,对研制的快速检测试纸进行灵敏度和稳定性评价,结果显示,免疫渗滤试纸的灵敏度为5 μg / mL,1 个月内初步稳定性良好,可实现sAA 在实验室及现场的快速半定量检测。
此外,有文献报道,白术对sAA 活性有促进作用[14],而葛根有抑制作用[15],本文酶学作用研究结果与其相似,但两者是否具有关联性,尚有待进一步验证。
本研究建立的胶体金免疫渗滤法与传统检测方法相比,具有操作简便、快速、成本低、易于实现大批量检测的优点,可为sAA 的快速检测提供更多选择,同时,该方法在相关疾病的诊断及疗效评估中也具有潜在的应用价值。

