化学反应原理综合题考点剖析及复习建议
林增辉
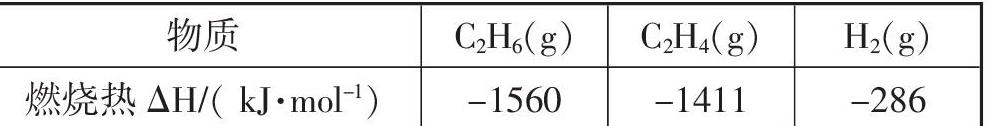
化学反应原理综合题是高考的基本题型,分值占15%左右,主要考查化学反应过程中能量、速率、限度和方向的问题,是化学核心概念和核心理论考查的重要载体。从近几年的高考得分率来看,该题的得分率是比较低的,这应引我们的重视,应多思考复习备考的方向性和有效性。笔者对比分析了近年来全国卷的高考真题,探求其考查方式,统计和剖析高频考点,力图能帮助同学们提高复习的有效性。
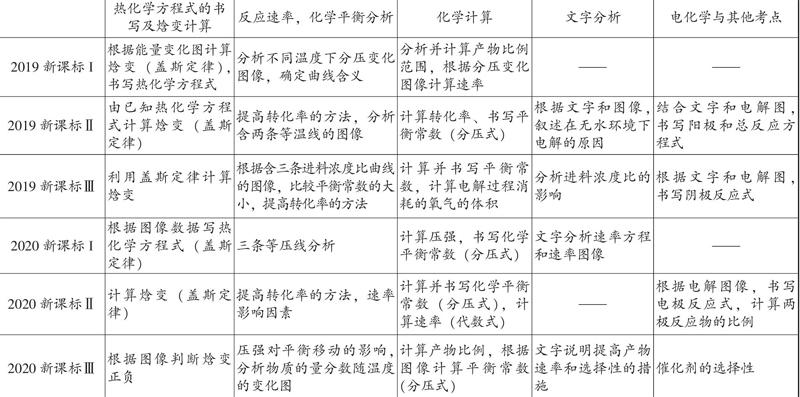
一、2019~2020年全国卷真题考点统计
2019~2020年全国卷化学反应原理综合题核心考点统计如下:
统计显示,2019~2020年的全国卷化学反应原理综合题的考点是比较集中的,也比较相似,基本上都考查了热化学方程式的书写或焓变的计算、化学反应速率及化学平衡移动的分析和化学计算,有部分试题还考查了文字分析和电解的内容。其中,运用盖斯定律计算焓变、分析平衡曲线(等温线、等压线、原料比曲线等)及书写平衡常数是热门考点,而转化率的控制、速率的计算、电极反应式的书写是出现频率较高的考点,此外,在有些题目中还涉及催化剂选择性的考点。此外,和2018年之前的全国卷化学反应原理综合题相比,也有一些大的变化,例如题目的图表信息有所增加,文字信息则相对减少,更加注重考查同学们的读图能力;又如,在题目的难度上,也有所增加,例如在计算焓变时,需要同学们通过读图获取信息或者进行方程式筛选,才能写出目标方程式;又如在书写化学平衡常数时,除了2019年全国?芋卷外,其他试题均要求写成同学们比较陌生的分压式平衡常数……总体上来讲,对同学们捕捉信息和处理信息的能力提出了较高的要求,但由于其考点相对稳定,只要我们对各考点熟练掌握,一定能顺利攻克这类题目。下面,笔者将各核心考点进行梳理剖析,希望对同学们有所帮助。
二、核心考点剖析
结合化学反应原理综合题考点的频率和难度,选取并剖析以下核心考点。
考点一:热化学方程式的书写及焓变的计算
在以往的题目中,这一考点的难度是比较低的,通常是要求通过组合已知方程式求算目标方程式的焓变,本质上只是一种简单的数学计算。但近两年来发生了一些变化,例如2020年新课标?域卷以燃烧热数据表格呈现信息,2020年新课标I卷以能量图的形式呈现信息,加强了图表信息处理能力的考查。
【例1】(2020新课标Ⅱ卷节选)乙烷在一定条件可发生如下反应: C2H6(g)=C2H4(g)+H2(g);ΔH,相关物质的燃烧热数据如下表所示:
ΔH=_________ kJ·mol-1。
分析:这一道题,用烧然热代替了常规的热化学方程式,在考查运用盖斯定律计算反应热的同时,也考查了燃烧热的概念。由表格中的数据可写出以下热化学方程式:①C2H6(g)+7/2 O2(g)=2CO2(g)+3H2O(l);ΔH1=-1560kJ·mol-1;②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);ΔH2=-1411kJ·mol-1;③H2(g)+1/2 O2(g)=H2O(l);ΔH3=-286kJ·mol-1;根据盖斯定律,①-②-③得C2H6(g)=C2H4(g)+H2(g),则ΔH=ΔH1-ΔH2-ΔH3=(-1560kJ·mol-1)-(-1411kJ·mol-1)-286kJ·mol-1)=+137kJ·mol-1。
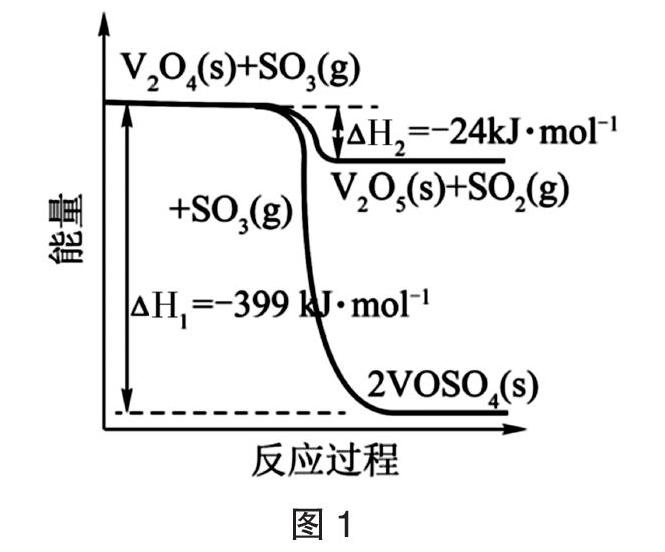
【例2】(2020新课标Ⅰ卷节选)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+1/2 O2(g)■ SO3(g)ΔH=-98 kJ·mol-1。回答下列问题:(1)钒催化剂参与反应的能量变化如图1所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________________。
分析:题目要求写出热化学方程式2V2O5(s)+2SO2(g)?葑2VOSO4(s)+V2O4(s),并计算ΔH3,根据题干和图表信息,可以写出以下三个方程式:①SO2(g)+1/2O2(g)?葑SO3(g);ΔH=-98kJ·mol-1;②V2O4(s)+SO3(g)?葑V2O5(s)+SO2(g);ΔH2=-24kJ·mol-1;③V2O4(s)+2SO3(g)?葑2VOSO4(s);ΔH1=-399kJ·mol-1。根据盖斯定律,③-②×2得2V2O5(s)+2SO2(g)?葑2VOSO4(s)+V2O4(s),则ΔH3=ΔH1-2ΔH2=(-399kJ·mol-1)-(-24kJ·mol-1)×2=-351kJ·mol-1,所以该反应的热化学方程式为:2V2O5(s)+2SO2(g)?葑2VOSO4(s)+V2O4(s);ΔH3=-351 kJ·mol-1。
这一考点的核心知识点是运用盖斯定律计算焓变,但其信息的呈现方式在传统的文字信息基础上,增加了图表信息的考查,除了2020年新课标Ⅰ卷,2020年7月的浙江省选考化学反应原理综合题的焓变计算,也是以图表的形式呈现信息,这可能是一种考查方式的趋势,同学们也应给予足够的重视。
考点二:速率、平衡图像分析
化学反应速率、平衡图像的分析,是近年来化学反应原理综合题的考查难点,也是考查重点。常见的曲线有等压线、等温线和投料比曲线等,同学们需要借助题干的文字信息和图表的信息综合分析判断。
【例3】(2020新课标Ⅰ卷节选)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+1/2 O2(g)?葑SO3(g)ΔH=-98 kJ·mol-1。回答下列问题:(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa壓强下,SO2平衡转化率α随温度的变化如图2所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(■-1)0.8(1-nα′),式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α′为某时刻SO2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图3所示。
问题(2)考查了温度和压强对转化率的影响,审题时,先要明确纵坐标和横坐标的意义,分析等压线的变化趋势,对于含有多个物理量的图像,要学会利用控制变量的方法进行分析。结合题干信息可知,SO2的催化氧化是放热反应,而且气体分子数减少,增大压强,平衡向右移动。因此,在相同温度下,压强越大,SO2的平衡转化率越大。由此可知,p1>p2>p3,由图可知,当p1=5.0MPa,α=0.975。转化率与平衡的移动密切相关,而对于SO2催化氧化的反应来说,氧气的浓度、反应体系的温度和压强,都能影响SO2的平衡转化率α。
问题(4)是根据速率方程和速率图像分析问题,同学们对速率方程是比较陌生的,但题目中已经提供了充足的信息,即反应速率常数k随温度t升高而增大,而SO2平衡转化率α随温度t升高而降低(放热反应),α′和n均可视为常数,因此在温度变化过程中,反应速率方程v=k(■-1)0.8(1-nα′)中事实上只有k和α为变量。由此可知,当升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t
【参考答案】(2)0.975 该反应气体分子数减少,增大压强,α提高,5.0MPa>2.5MPa=p2,所以p1=5.0MPa 反应物(N2和O2)的起始浓度(组成)、温度、压强(4)升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。t<tm时,k增大对v的提高大于α引起的降低;t>tm后,k增大对v的提高小于α引起的降低
【例4】(2019新课标Ⅲ卷节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。如图为刚性容器中,进料浓度比c(HCl)∶ c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(300 ℃)________K(400 ℃)(填“大于”或“小于”)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶ c(O2)过低、过高的不利影响分别是_________________________、________________。
分析:这一道题考查了温度和投料比对转化率的影响,横坐标表示温度的变化,纵坐标表示HCl平衡转化率,图中三条曲线表示不同投料比下HCl转化率随温度的变化情况。根据曲线的变化趋势,可知随温度升高,HCl平衡转化率降低,则此反应为放热反应,温度越高,平衡常数越小,即K(300 ℃)大于K(400 ℃)。题目提示“按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗”,可推知,进料浓度比c(HCl)∶ c(O2)过低,O2过剩,会使O2和Cl2分離的能耗较高,进料浓度比过高,HCl过剩,则会造成HCl转化率较低。
【参考答案】大于;O2和Cl2分离能耗较高;HCl转化率较低
【例5】(2019新课标Ⅱ卷节选)环戊二烯(■)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
A. T1>T2
B. a点的反应速率小于c点的反应速率
C. a点的正反应速率大于b点的逆反应速率
D. b点时二聚体的浓度为0.45 mol·L-1
分析:这一道题考查了温度对反应速率和平衡移动的影响。题干信息显示,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。而图像显示,在相同时间内,T2条件下,环戊二烯浓度减少量较大,反应速率较快,可知T1<T2,A项错误;温度越高化学反应速率越快,因此a点反应速率大于c点反应速率,B项错误;a点和b点温度相同,且均未达到平衡状态,故两点v(正)均大于v(逆),而a点反应物浓度大于b点,故a点正反应速率大于b点,则a点的正反应速率大于b点的逆反应速率,C项正确;b点时,环戊二烯的浓度减少0.9 mol·L-1,结合生成的二聚体浓度为环戊二烯浓度变化量的一半,可知二聚体的浓度为0.45 mol·L-1,D项正确。
在此列举几种典型的图例,是希望同学们能达到举一反三的目的。虽然题目的图像信息呈现方式是不断变化的,但还是有一些基本的解题方法可依,首先,要准确捕捉图像中的信息,要明确横坐标、纵坐标的意义,明确图中曲线的意义和变化趋势,重点关注特殊点(如有具体数值的点);其次,要熟悉运用控制变量的方法,对变量各个击破;最后,明确物理量的对应关系,如温度对应着焓变,而压强对应着系数和。熟练掌握处理信息的方法,才能快速寻找解题的突破口。
考点三:化学计算
在化学反应原理综合题中,化学计算主要涉及反应速率、转化率及平衡常数的计算,从这两年的考题来看,主要是书写化学平衡常数或进行相关计算,而且多数题目要求利用分压式表达平衡常数,有一定的难度,值得重点关注,而速率和转化率的计算相对比较简单,不作过多的讨论。
【例6】(2020新课标I卷)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+1/2 O2(g)■ SO3(g)ΔH=-98 kJ·mol-1。回答下列问题:(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
分析:这道题主要考查化学平衡常数的书写,但同学们对分压式的平衡常数并不熟悉,因此要充分利用题目的信息“分压=总压×物质的量分数”,书写正确的表达式。同时,用字母代替具体数字,也在一定程度上增大了难度,同学们在计算的时候,需要冷静谨慎,书写工整,才能保证计算和书写的准确性。根据题目的信息,假设原气体的物质的量为100mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
SO2(g)+■O2(g)■ SO3(g)
起始時各物质的量(mol)2m m 0
各物质的变化量(mol) 2ma ma 2ma
平衡时各物质的量(mol) 2m(1-a) m(1-a) 2ma
平衡时气体的总物质的量为n(总)= 2m(1-α)mol+m(1-α)mol+2mαmol+qmol=(100-ma)mol,则SO3的物质的量分数为■×100%。该反应在恒压p中进行,因此,SO3的分压p(SO3)=■,p(SO2)=■,p(O2)=■,因此SO2的催化氧化的Kp=■=■=■。
本题是以文字信息的形式提供各物质的数量,除了这种方式,有的题目是以图像的形式提供数据的,例如2020年新课标III卷的28题,该题需要同学们先对图像进行分析,得出各种物质的百分比,再计算平衡常数。因此,在复习过程中,同学们不但要加强计算能力的训练,还应加强图表分析能力的培养。
考点四:电化学及其他考点
电化学在反应原理综合题中也是比较常见的,近两年来以电解为主,主要考查电极反应式、总反应方程式的书写,或进行简单的计算。
【例7】(2020新课标Ⅱ节选)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。
分析:由图表信息,可知上述装置属于电解装置,图中标明了阴阳极、O2-可在电解质中传递,也标明了CH4和CO2的电解产物,因此可以写出阴极的电极反应式:CO2+2e-=CO+O2-;若生成的乙烯和乙烷的体积比为2∶1,根据阿伏加德罗定律,同温同压下,气体体积比等于物质的量之比,则乙烯和乙烷的物质的量之比也为2∶1,再根据得失电子守恒,写出总反应方程式:6CH4+5CO2=2C2H4+C2H6+5H2O+5CO,可知CH4和CO2的体积比为6∶5。纵观历年来的化学反应原理综合题中的电化学考点,一般都侧重于考查电化学原理的基本应用,书写比较简单的陌生电极反应式,其重点还是落在捕捉和分析题目的信息上。
从近两年统计情况来看,化学反应原理综合题的主要考点有反应热的计算、化学平衡移动分析、化学计算和电化学等,偶尔也出现一些工业的前沿技术,例如催化剂的选择性(2020新课标Ⅲ卷:提高反应速率和乙烯选择性)、分子筛(2020天津卷:其中分子筛膜能选择性分离出H2O)、选择性膜技术(2020浙江7月选考:可选择性地让某气体通过而离开体系)等,这些内容虽然难度不大,但既能考查同学们的信息处理能力,又能让同学们了解化学工业的前沿技术,一举多得。所以同学们在复习过程中,应做有心人,开拓自己的视野,丰富自己的思想。此外,在化学反应原理模块中占有重要地位的水溶液的离子平衡和化学电源等考点,近年来主要出现在选择题中。
三、复习建议
1. 夯实基础,以不变应万变。高考试题考查方式虽然一直都在发生变化,但其考查的核心知识是不变的,同学们切不可好高骛远,忽视基础知识的巩固。例如焓变的计算,常见的方法是盖斯定律,只是信息的呈现方式发生了变化,而平衡图像的分析,核心知识则是化学平衡移动的影响因素。只有巩固好基础知识,在备考过程中运用知识分析问题,解决问题,能力才能得以提高。
2. 知已知彼,百战不殆。了解高考的考查方式和考查内容,才能提高复习的针对性和有效性。例如用分压式书写平衡常数,对很多同学来说是很陌生的,如果平时没有进行这方面的训练,考试时可能会手足无措。又如考题中也常要求同学们用文字描述的方式分析反应原理,这方面的训练我们平时是否也落实了呢?还有,从信息呈现方式来看,图表分析是一种高频方式,也应引起我们足够的重视。总之,了解考题,明确方向,也是备考的重点。
责任编辑 李平安

