糠醛渣复合材料固定果胶酶的制备
毕淑娴,郝红英,汪明圆,詹海鹃,刘万毅
(省部共建煤炭高效利用与绿色化工国家重点实验室,化学国家级实验教学示范中心,宁夏大学化学化工学院,宁夏银川 750021)
伴随着生活品质的提高,人们对果品质量要求也越来越高[1]。作为世界四大酶制剂之一的果胶酶在一定程度上解决了果汁和果酒的澄清,脱除果胶,加工过程中营养物质损耗等难题,降低了水果等榨汁的粘度,提高了过滤效率,同时化学澄清剂用量的减少也改善了果汁的质量。果胶酶也广泛的应用于医药领域、食品行业、生物传感器、环境保护及能源利用、生物脱胶、纺织等领域[1-4]。果胶酶主要来源于多种微生物体内,也可以通过液体深层培养或固体培养法获得。游离的果胶酶有反应后不能回收,不能实现重复利用的缺点。而固定化酶在一定程度上弥补了这些缺点,还能防止外源物质对果品的污染,提高酶的使用效率[5-9]。
糠醛渣是玉米芯、稻壳、等农副产品加工剩余物中聚戊糖成分高温水解生产呋喃甲醛后得到的固体废渣,含有大量的纤维素、半纤维素和木质素,具有良好的在利用价值[10-12]。本实验糠醛渣复合材料和磺化糠醛渣复合材料采用戊二醛交联法固定果胶酶,操作简单,易于实现糠醛渣的主要成分是纤维素、木质素和半纤维素,含有大量的羟基、羧基等官能团,经磺化后的糠醛渣,在其组分分子中引入磺酸基,赋予其很好的化学反应活性,此外,糠醛渣来源广,价格低廉,有较好的化学稳定性,无毒。利用糠醛渣固定果胶酶不仅可以实现资源化利用,又可为糠醛渣在固酶方面的实际应用提供一定的理论基础和参考依据。
本文以糠醛渣复合材料作为酶的固定化载体,对果胶酶的催化性能进行了研究。
1 实验部分
1.1 材料与试剂
糠醛渣:宁夏共享化工集团;乙酸:烟台市双双化工有限公司;壳聚糖:国药集团化学试剂有限公司;戊二醛:上海中秦化学试剂有限公司;苯胺:天津市凯通化学试剂有限公司;98%的3-氨基苯硼酸盐酸盐:上海麦克林生物科技有限公司;聚乙烯醇:天津市凯通化学试剂有限公司;过硫酸铵:烟台市双双化工有限公司;盐酸:天津市北联精细化学品开发有限公司;98%的硫酸:天津市科密欧化学试剂有限公司;柠檬酸:徐州天鸿化工有限公司;柠檬酸钠:上海广诺化学科技有限公司;3,5-二硝基水杨酸、酒石酸钠:上海中秦化学试剂有限公司;苯酚:烟台市双双化工有限公司;无水亚硫酸钠:上海广诺化学科技有限公司;氢氧化钠:天津市风船化学试剂科技有限公司;97%D-(+)-半乳糖醛酸:阿拉丁;果胶、果胶酶:上海瑞永生物科技有限公司。
1.2 仪器
HJ-6 多头磁力加热搅拌器:常州国华电器有限公司;JD200-4 电子分析天平:沈阳龙腾电子有限公司;DHG-9053A 型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;KQ-250E 医用数控超声波清洗器:昆山市超声仪器有限公司;KA-1000 低速台式离心机:上海安亭科学仪器厂;Nicolet IS10 傅立叶变换红外光谱仪:赛默飞世尔科技公司;S-4800 场发射扫描电子显微镜:日本日立公司;SHA-C 水浴恒温振荡器:金坛市杰瑞尔电器有限公司;SX723 型便携式pH/mV/电导率测量仪:上海三信仪表厂;集热式恒温加热磁力搅拌器:郑州长城科工贸有限公司;冰箱:青岛市海尔集团有限公司;UV-1800PC 紫外可见分光光度计:上海美谱达仪器有限公司。
1.3 糠醛渣复合材料的制备
先用大量的自来水反复冲洗掉糠醛渣表面的杂质和水溶物,80 ℃烘干24 h,在粉煤机上破碎,过筛,得60~80 目颗粒备用。再用大量的自来水反复冲洗掉糠醛渣表面的杂质和水溶物,80 ℃烘干24 h,破碎过筛得60~80 目颗粒备用。最后将4%戊二醛(GA)和1.0 g 糠醛渣-CTS 复合材料超声20 min,磁力搅拌交联10 h后离心洗涤,80 ℃烘干12 h,制得糠醛渣-CTS-GA复合材料。将上述材料逐滴加入3 mL 浓H2SO4,磁力搅拌30 min,室温放置48 h 后150 ℃反应4 h,自然冷却,洗涤至滤液pH 为中性,80 ℃烘干12 h,研磨制得磺化糠醛渣材料。然后与2%壳聚糖,超声20 min 混合均匀后,磁力搅拌12 h 离心洗涤,80 ℃烘干12 h,制得磺化糠醛渣-CTS 复合材料。最后与4%戊二醛交联10 h 后,80 ℃烘干12 h,制得磺化糠醛渣-CTS-GA 复合材料。
1.4 固定化果胶酶的制备
分别称取0.05 g 糠醛渣-CTS-GA 复合材料,0.05 g磺化糠醛渣-CTS-GA 复合材料于10 mL 离心管中,依次加入1%果胶酶2 mL、2 mL、4 mL,在水温为37 ℃的恒温振荡器上震荡4 h 后取出离心,上清液保留,将上清液与固定酶放置于4 ℃冰箱保存。
1.5 果胶酶酶活力及载酶量测定
1.5.1 游离酶及固定化果胶酶酶活力测定
将游离酶及固定化果胶酶与果胶迅速摇匀,在40 ℃水浴中反应30 min 后,分别加入2 mol/L NaOH溶液5 mL,DNS 试剂1.5 mL,沸水煮沸5 min。分别取2 mL 反应液于10 mL 比色管后稀释至刻度线,2号试管中溶液为参比,测吸光度。
1.5.2 固定化果胶酶载酶量的测定
25 mL 比色管中分别加入糠醛渣复合材料固定化果胶酶0.05 g(磺化糠醛渣复合材料固定化果胶酶0.05 g)未固定果胶酶(上清液)1 mL,5%果胶酶1 mL;分别加入pH=3.5 缓冲溶液和1%果胶,在40 ℃水浴中反应30 min 后,分别加入2 mol/L NaOH 溶液5 mL,DNS 试剂1.5 mL,沸水煮沸5 min,稀释至刻度线后测吸光度。两种固定化酶的比酶活分别为106.32 和128.79 u/mg,其中糠醛渣复合材料固定化果胶酶载酶量为197.2 mg/g。
1.6 数据处理
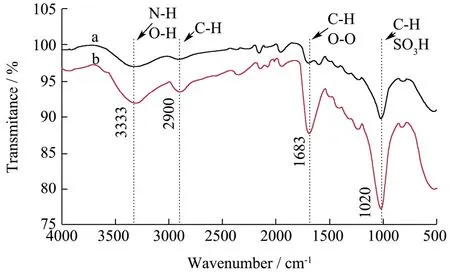
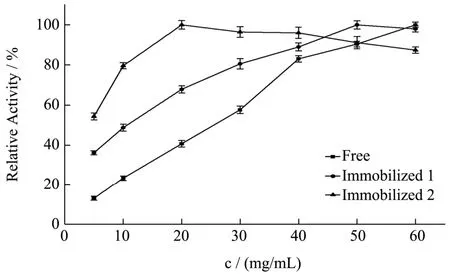
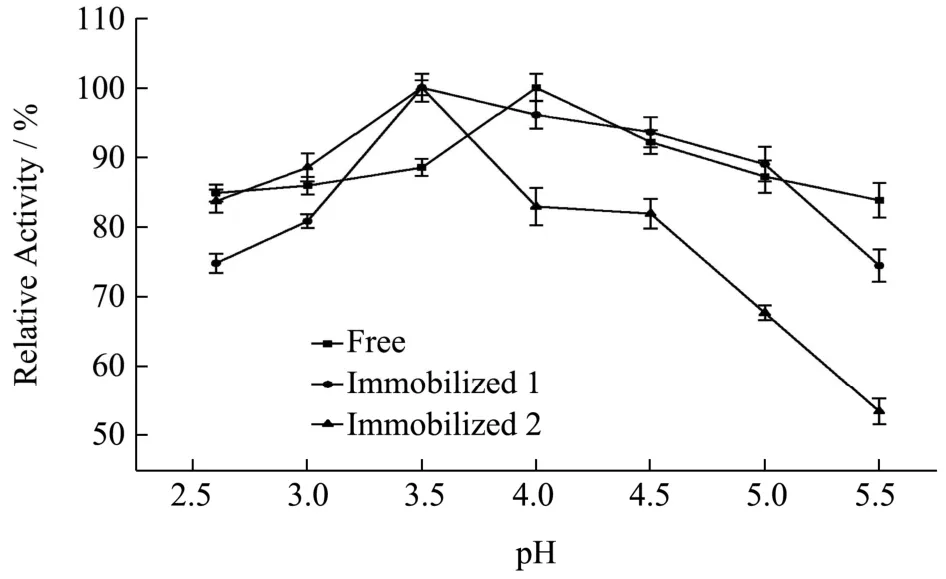
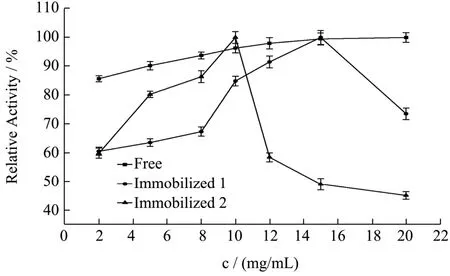
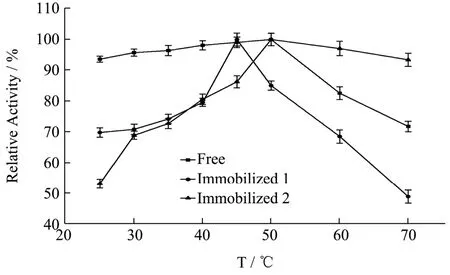
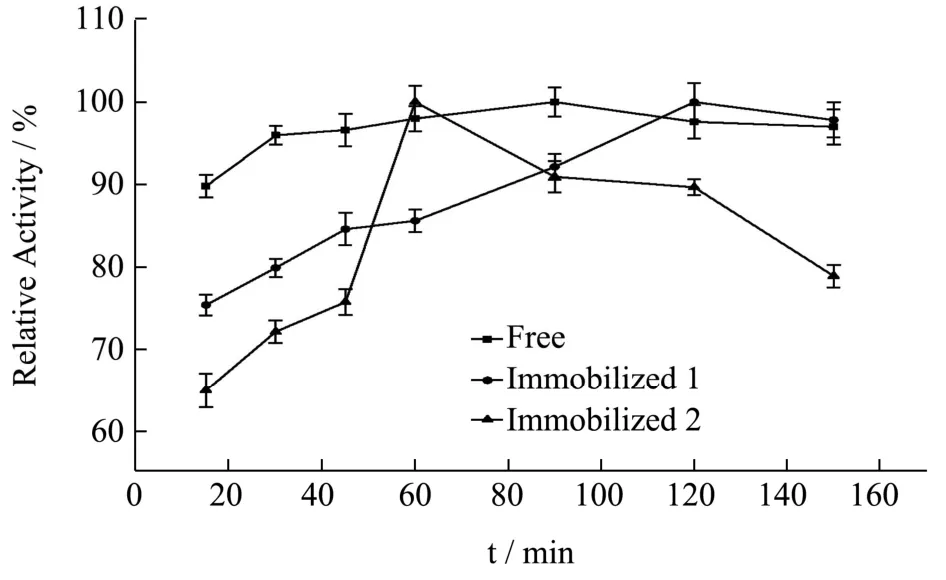
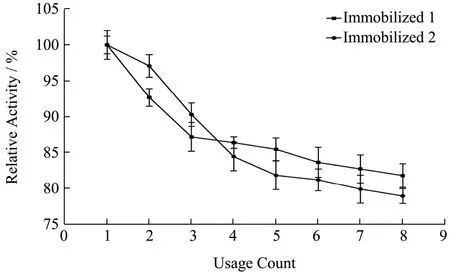
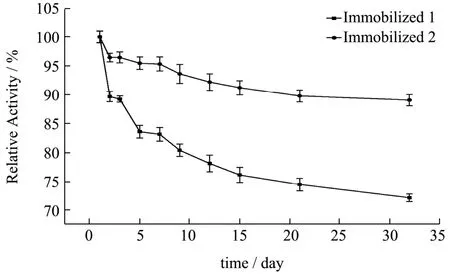
实验数据以平均值±标准差(±s)表示,其中通过5 组平行实验所得。数据稳定性用变异系数CV(CV=s/)表示,其中CV>100%为强变异;10% 糠醛渣在反应釜中经浓H2SO4高温磺化后制得磺化糠醛渣,与未经处理的糠醛渣利用静电自组装技术包裹2%壳聚糖后交联4%戊二醛,制备出两种具有多醛基的固定酶载体。从FT-IR 谱图1 可得:①在3339 cm-1处为纤维素、木质素和半纤维素O-H 键伸缩振动吸收峰,2900 cm-1处为C-H 键的伸缩振动;②在1696和1594 cm-1还出现了C=O 和C=C 的伸缩振动峰,并且峰向低波数方向偏移,这表明糠醛渣经磺化后,碳骨架发生了一定程度的改变;③1155 cm-1处出现了新的振动吸收峰,是由于糠醛渣经过H2SO4磺化后产生的SO3H 所造成的。 图1 糠醛渣(a)和磺化糠醛渣(b)红外光谱图Fig.1 Infrared spectra of furfural residue (a) and sulfonated furfural residue (b) 图2 糠醛渣(a)和糠醛渣-CTS-GA(b)红外光谱图Fig.2 FT-IR spectra of furfural residue (a) and furfural residue CTS GA (b) 由糠醛渣和糠醛渣-CTS-GA的红外光谱图2可得到以下结论:①在1683 cm-1处出现了新的吸收峰,并且峰强度很大,是壳聚糖的氨基与戊二醛的醛基发生Schiff 反应而形成的Schiff 碱键(C=N)的吸收峰和戊二醛没有参与反应的另一个C=O 伸缩振动所产生的;②1020 cm-1处的吸收峰也明显增强,是由N-H和N-C 的弯曲振动以及没有完全反应完的SO3H 引起的;③壳聚糖中的O-H 和N-H 的伸缩振动使得3333 cm-1处的吸收峰明显增强,2900 cm-1处的C-H 的伸缩振动吸收峰也有一定程度的增强。 图3 为糠醛渣(a)、磺化糠醛渣(b)的SEM 图,从图a 和图b 的对比可知,不经过任何处理的糠醛渣表面较平整,几乎没有孔道结构,经磺化后表面变得粗糙,出现沟壑和明显缺陷。在包裹壳聚糖交联戊二醛后,表面变得疏松,出现了层状结构。 图3 糠醛渣复合材料和磺化糠醛渣复合材料SEM 图Fig.3 SEM of furfural residue composite and sulfonated furfural residue composite 图4 不同酶浓度对酶活的影响Fig.4 Effect of different enzyme concentration on enzyme activity 对于纯酶来说,一般认为在pH、反应温度和反映底物浓度相同时,酶的催化能力与酶的浓度成正比关系,由图4 可见,果胶酶自由酶几乎符合上述理论。对于两种固定酶都有共同的趋势,当给酶量达到一定程度后固定酶的催化能力都开始下降。由于载体的结合位点有限,给酶量过大时,造成载体的空间位阻过大,底物与产物不能够在第一时间分散,从而使得固定酶的催化能力降低。固定酶-1,固定酶-2 的最佳酶浓度依次为50 mg/mL,20 mg/mL。在达到最佳酶浓度之前,固定酶-1 的酶活力受酶浓度的影响较大,固酶酶浓度为5 mg/mL时的酶活力为最佳酶浓度固定酶的81.33%。 酶是一种蛋白质,反应体系的pH 影响酶分子活性部位中催化基团与结合基团的解离状态,同时也影响着底物的解离状态,对酶分子的空间结构和专一性也有一定的影响。由图5 可见,反应体系的pH 对自由酶和固定酶的酶活力影响很大,两种固定酶的最佳pH 均为3.5,自由酶的最佳pH 为4.0。自由酶的pH-酶活力曲线呈钟形,而固定酶受微环境表面电荷的影响,曲线发生偏移。反应体系pH 为2.6 时,相对酶活力仍为95.50%。由于酶蛋白质中的-NH2与戊二醛的醛基之间的加成反应,也需要在酸性环境中进行;偏离最适pH 也会引起酶蛋白的部分失活。两种固定酶在超过最佳pH 后酶活力都有明显的下降,可能是由于果胶酶与载体材料相互作用,使得酶分子的空间构象发生较大改变。固定化果胶酶与游离酶相比,在偏酸条件下能保持更高的酶活力。 图5 pH 对固定化果胶酶酶活力的影响Fig.5 Effect of pH on the activity of immobilized pectinase 图6 果胶浓度对固定化果胶酶酶活力的影响Fig.6 Effect of pectin concentration on activity of immobilized pectinase 由图6 可见,对于自由酶,当果胶浓度达到10 mg/mL 时,继续增大果胶溶液浓度自由酶酶活力几乎不变,并且在4 mg/mL~20 mg/mL 果胶浓度范围内,酶活力所受影响并不明显,酶已被底物饱和;对于固定酶-1 和固定酶-2,当果胶浓度分别达到15 mg/mL、10 mg/mL 时,达到相对酶活的100%。超过相应的最佳果胶浓度时,酶活力显著下降,当果胶浓度分别达到20 mg/mL、12 mg/mL 时,相对酶活分别为73%、55%。总体来说,两种固定酶受果胶浓度的影响较大。当果胶浓度达到一定程度时,还原糖含量不再增加,这时出现了底物过饱和现象,当底物浓度低时,固定化酶分子的活性位点未被底物饱和,但当底物的分子数目增加时,固定化酶分子活性位点和底物结合直至过饱和,固定化酶不再有活性位点可以结合[13]。 图7 反应温度对固定化果胶酶酶活力的影响Fig.7 Effect of reaction temperature on the activity of immobilized pectinase 同于一般化学反应,当温度升高,酶解反应速率会加快,同时酶的活性也会随之降低。由图7 可见,自由酶,固定酶-2 的最适反应温度均为50 ℃,固定酶-1 的最适反应温度为45 ℃。自由酶在25 ℃~50 ℃,受温度影响较小,25 ℃时相对酶活仍为93.62%,但耐高温能力不强。固定酶-1 和固定酶-2 的酶活力受温度的影响,酶活力波动较大。固定酶-2 耐高温性能更强,70 ℃时相对酶活为92.54%。与利用Fe3O4磁核与海藻酸钠明胶制备磁性复合载体固定化果胶酶具有相同的热稳定性[14]。 由图8 可见,自由酶的最佳反应时间为90 min,固定酶-1 的最佳反应时间均为120 min,固定酶-2 的最佳反应时间为60 min,且反应时间对其相对酶活影响较大。四种酶在达到最佳反应时间酶活力都有所下降,可能是由于产物分解为其他物质的原因。 图8 反应时间对固定化果胶酶酶活力的影响Fig.8 Effect of reaction time on the activity of immobilized pectinase 图9 固定化果胶酶的操作稳定性Fig.9 Operational stability of immobilized pectinase 能够回收,重复循环使用是固定化酶的一个重要优点,由图9 可见,固定酶-1,固定酶-2 这两种固定酶在循环使用8 次后,仍然保持着较高的相对酶活,分别为81.78%、78.90%。这说明以糠醛渣复合材料,磺化糠醛渣复合材料为载体制备的固定化果胶酶有较好的重复使用性。而用磁性壳聚糖微载体固定的果胶酶,重复使用6 次后,酶活力只剩余4%[15]。 如图10 所示,在4 ℃的环境下,两种固定酶随着储存时间的延长,相对酶活都有所下降,固定酶-1和固定酶-2 在储存32 d 后,相对酶活分别下降了27.98%和11.02%,均具有较好的储存稳定性,其中固定酶-2 尤为突出。固定化果胶酶的存储稳定性明显优于HPD-750 大孔树脂为载体材料固定化果胶酶[16]。 图10 固定化果胶酶的储存稳定性Fig.10 Storage stability of immobilized pectinase 以洗净、干燥、粉碎后的糠醛渣为原材料,在高温条件下,于反应釜中经98%浓H2SO4磺化后制得磺化糠醛渣,磺化糠醛渣与未经处理的糠醛渣利用静电自组装技术将壳聚糖包覆到原材料上,制备出具有多醛基、表面粗糙的糠醛渣和磺化糠醛渣复合材料,两种复合材料通过和戊二醛交联均能有效的固定果胶酶。与游离酶相比,固定化果胶酶的最佳pH 值低0.5,更耐酸性;固定化酶的热稳定性也有了很大提升,特别是磺化糠醛渣复合材料固定化果胶酶耐高温性能更强,70 ℃时相对酶活为92.54%。两种固定酶的相对酶活可达95.52%和95.03%,在最佳反应条件下两种固定酶的最大载酶量分别为197.20 mg/g,60.40 mg/g。其中糠醛渣复合材料的固定化果胶酶在重复循环使用8 次后剩余相对酶活可达81.78%,磺化糠醛渣复合材料的固定化果胶酶在4 ℃下储存32 d后仍剩余88.98%的相对酶活。两种固定酶都表现出较好的操作稳定性和储存稳定性,有较好的经济价值和应用前景。2 结果与分析
2.1 载体的制备及表征


2.2 酶浓度对固定化果胶酶酶活力的影响
2.3 pH 对固定化果胶酶酶活力的影响
2.4 果胶浓度对固定化果胶酶酶活力的影响
2.5 反应温度对固定化果胶酶酶活力的影响
2.6 反应时间对固定化果胶酶酶活力的影响
2.7 固定化果胶酶的操作稳定性
2.8 固定化果胶酶的储存稳定性
3 结论

