特殊医学用途婴儿配方食品中生物素含量的测定
卢兰香,薛霞,魏莉莉,赵慧男,武传香,丁一,公丕学,王骏,刘艳明,祝建华
(山东省食品药品检验研究院,山东省特殊医学用途配方食品质量控制工程技术研究中心,山东济南 250101)
特殊医学用途婴儿配方食品是指针对患有特殊紊乱、疾病或医疗状况等特殊医学状况婴儿的营养需求而设计制成的粉状或液态配方食品[1],是这些婴儿生命早期或出生后相当长时间内赖以生存的主要食物来源。常见特殊医学用途婴儿配方食品包括无乳糖或低乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解或氨基酸配方、早产/低出生体质量婴儿配方、母乳营养补充剂和氨基酸代谢障碍配方。
生物素(Biotin)又称维生素H,属于水溶性B族维生素。生物素的化学结构是一个脲基环含有一个硫原子和一条戊酸的侧链,可能有八种同分异构体,天然存在的D-生物素具有活性[2];生物素是参与机体蛋白质、脂肪和糖类三大代谢的重要物质[3]。食物中的生物素主要以游离形式或与蛋白质结合的形式存在,婴幼儿缺乏生物素,会出现食欲不振、烦躁或嗜睡、湿疹、皮炎、发育迟缓等一系列症状[4]。食品安全国家标准GB 14880-2012[5]和GB 25596-2010[1]明确规定了特殊医学用途婴儿配方食品中生物素的添加形式和添加量,因此生物素也成为该类食品中的必检项目。
目前,现有生物素的测定方法主要有微生物法[6]、酶联免疫法[7]、荧光免疫层析法[8]、生物传感器法[9]、毛细管电泳法[10]、液相色谱法[11-14]、液相色谱质谱联用法[15-17]。其中,酶联免疫法基于生物素和亲和素的特定反应,专一性强,但所用试剂价格昂贵,生物传感器法重现性差;分光光度法灵敏度低;荧光法可靠性存在缺陷;生物素无典型的紫外和荧光发色团,液相色谱法采用紫外检测器直接测定灵敏度比较低,不适合含量比较低的样品,而荧光检测器需要衍生过程比较繁琐。微生物法也是食品安全国家标准GB 5009.259-2016[6]所采用的方法,灵敏度较高,但由于大多数菌株不是专一性的,因此会带来较大的检测误差,且方法检测周期长,仅接种和培养就需要19 h~20 h;操作复杂,需要在无菌条件下操作,对实验环境要求苛刻;样本间平行性不好;菌种保存困难等问题。特殊医学用途婴儿配方食品较普通婴幼儿食品配方复杂、涉及的工艺类型较多,产品形态多样,普通配方乳粉的检测技术不适用于该类食品,而且特医婴配食品中生物素的检测未见报道。
针对特殊医学用途婴儿配方食品配方复杂、形态多样,所添加生物素含量低的特点,本研究拟以免疫亲和柱进行净化,同时结合超高效液相色谱的分离能力和质谱的高灵敏度、高选择性对该类食品中的生物素进行测定,以期建立特殊医学用途婴儿配方食品中生物素的超高效液相色谱-质谱分析方法。为特殊医学用途婴儿配方食品中生物素的检测提供技术参考,指导生产企业对产品的质量控制,为政府监管提供有力的技术支持。
1 材料与方法
1.1 材料与试剂
D-生物素(纯度≥99.0%),德国Dr. Ehrenstorfer公司;生物素-d2(纯度≥97.0%),上海ISOREAG 公司;生物素免疫亲和柱(3 mL),德国拜发公司;甲醇、乙腈(色谱纯),美国Fisher 公司;甲酸(色谱纯),美国Sigma-Aldrich 公司;硫酸、磷酸、乙酸(优级纯),国药集团化学试剂有限公司;二水合磷酸二氢钠、十二水合磷酸氢二钠、氢氧化钠(分析纯),国药集团化学试剂有限公司;有机微孔滤膜(0.22 µm),上海安谱科学仪器有限公司。
实验用特殊医学用途婴儿配方食品(文中相关配方用字母代替):无乳糖配方(A)、乳蛋白部分水解配方(B)、乳蛋白深度水解配方(C1)、氨基酸配方(C2)、早产/低出生体质量婴儿配方(D)、氨基酸代谢障碍配方(E)、母乳营养补充剂(F)均为市售。
1.2 仪器与设备
ACQUITYTM超高效液相色谱仪、Xevo TQ-S 质谱仪配备电喷雾(ESI)电离源和MasslynxTM色谱工作站,美国Waters 公司;Milli-Q 超纯水制备器,美国Millipore 公司;超声波清洗器,宁波新芝生物科技有限公司;MS3 涡旋混合器,IKA 公司;N-EVAP-45位氮吹仪,美国Organomation 公司;SQP-电子天平,塞多利斯科学仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
D-生物素标准储备液(100 μg/mL):准确称取5 mg(精确至0.1 mg)生物素标准品于50 mL 容量瓶中,用甲醇-水(1:1,V/V)定容至刻度,-18 ℃避光保存。
生物素-d2 标准储备液(100 μg/mL):准确称取5 mg(精确至0.1 mg)生物素-d2 于50 mL 容量瓶中,用甲醇-水(1:1,V/V)定容至刻度,-18 ℃避光保存。
将D-生物素标准储备溶液用初始流动相逐级稀释为0.50、1.00、2.00、5.00、10.00、15.00、20.00、25.00、50.00 ng/mL(均含生物素-d2 内标15 ng/mL)的系列标准工作液。
1.3.2 样品处理
1.3.2.1 提取
样品混匀后称取1 g(精确到0.001 g)至50 mL比色管中,加入750 ng 生物素-d2 内标,加入25 mL的0.2 mol/L 磷酸溶液充分摇匀,在121 ℃下水解30 min,冷却至室温后,用1 mol/L 氢氧化钠溶液调pH值至4.5±0.2 后,超声约10 min。将试样溶液转移至50 mL 容量瓶中,用水冲洗比色管,洗液合并于50 mL容量瓶中,用水定容至50 mL,经滤纸过滤。
1.3.2.2 净化
将生物素免疫亲和柱连接到固相萃取装置上,取1 mL 上述样品提取溶液于50 mL 离心管中,加入10 mL 磷酸盐缓冲溶液(0.15 mol/L pH 值7.0),混匀,调pH 值至7 左右,上样,控制流速为2 mL/min,然后分别用20 mL 磷酸盐缓冲溶液(0.15 mol/L pH 值7.0)和10 mL 水淋洗,抽干柱中液体,最后用2 mL甲醇洗脱,收集全部洗脱液,45 ℃氮吹至干,用1 mL初始流动相复溶,经0.22 μm 有机相滤膜过滤后上机。
1.3.3 色谱质谱条件
1.3.3.1 色谱条件
Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);流速:0.3 mL/min;流动相:0.1%甲酸溶液(A)和乙腈(B);柱温:40 ℃;进样量:5 μL。梯度洗脱程序见表1 所示。
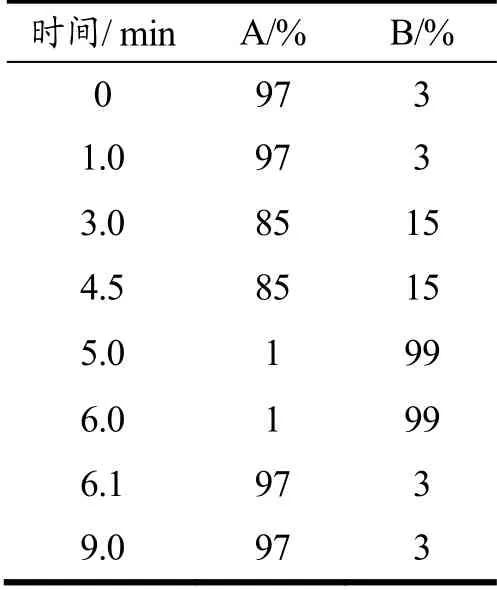
表1 流动相梯度洗脱程序Table 1 Gradient program for mobile phase
1.3.3.2 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:正离子扫描,多反应监测(MRM);毛细管电压:3.0 kV;锥孔电压:30 V;脱溶剂气温度450 ℃;离子源温度:150 ℃;脱溶剂气流速:850 L/h:锥孔反吹气流速:150 L/h;碰撞气流速:0.12 mL/min;生物素及内标的定性离子定量离子对及质谱参数见表2。
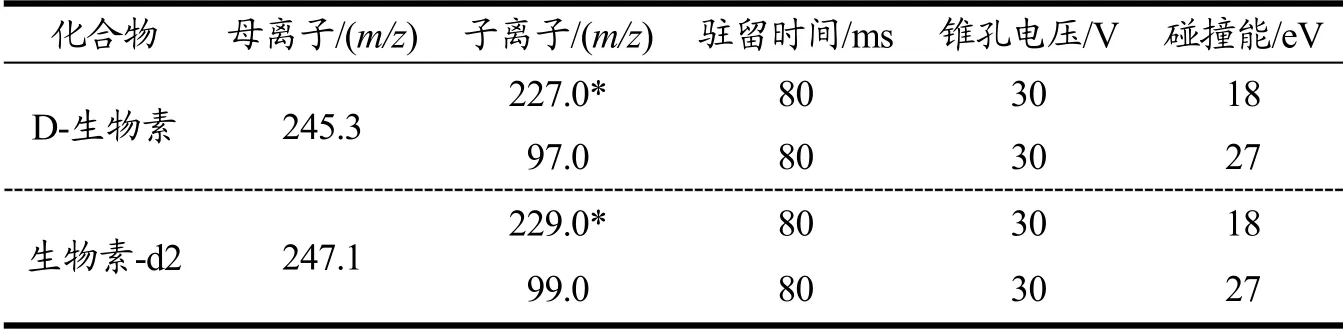
表2 生物素的质谱参数Table 2 The optimized MS parameters of biotin
1.4 基质效应评价
实验通过在纯溶剂与样品中添加同水平同位素内标,测定二者的峰面积响应值,评价基质效应[18](Matrix effect)。
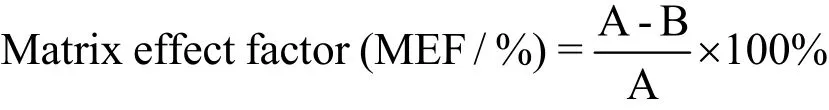
其中:MEF 为基质效应因子,A 为纯溶剂中内标的峰面积响应值,B 为样品提取液中内标的峰面积响应值。
MEF 为0 表示无基质效应,绝对值越大基质效应越强,在-15%~15%之间,表示基质效应影响不明显。
1.5 数据处理
通过与仪器配套的MasslynxTM色谱数据处理系统完成数据采集与处理,以及Origin 8.0 进行绘图。
2 结果与讨论
2.1 分析条件的优化
2.1.1 色谱条件的选择
由于生物素的化学结构中包括两个五元杂环和一条戊酸的侧链,所以实验比较了Waters Acquity UPLC HSS T3(2.1×100 mm,1.7 μm)和Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm)两种色谱柱的分离效果、峰面积响应值的影响。结果表明,两种色谱柱分离效果都比较好,但生物素在BEH C18 色谱柱上峰面积响应值更好。所以实验选择BEH C18 色谱柱。
分别比较了乙腈-0.1%甲酸、乙腈-10 mmol/L 甲酸铵(含0.1%甲酸)、乙腈-10 mmol/L 甲酸铵、甲醇-0.1%甲酸对目标物分离效果、灵敏度、峰形的影响。实验表明,甲酸铵保留较弱,甲醇-0.1%甲酸响应值低且分离效果不好,甲酸和甲酸铵(含0.1%甲酸)响应值、分离和峰形无明显差异。所以实验选择乙腈-0.1%甲酸为流动相。
2.1.2 质谱条件的优化
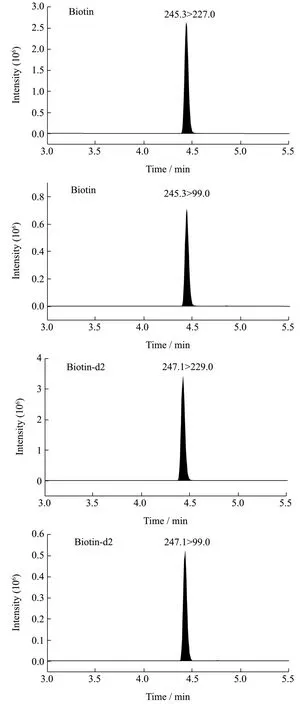
图1 生物素及生物素-d2 标准溶液的MRM 色谱图Fig.1 MRM chromatograms of the biotin and biotin-d2
生物素采用电喷雾电离源正离子扫描模式,将浓度为100 ng/mL 的D-生物素和生物素-d2 标准溶液标准溶液,分别通过蠕动泵注入质谱仪,调谐并优化锥孔电压、碰撞能量等参数,最终确定D-生物素和生物素-d2 的定性定量离子对,具体质谱参数见表2。在优化的HPLC-MS/MS 条件下,生物素(10 ng/mL)及内标(15 ng/mL)标准溶液的MRM 色谱图见图1。
2.2 前处理条件的优化
2.2.1 提取方式的优化
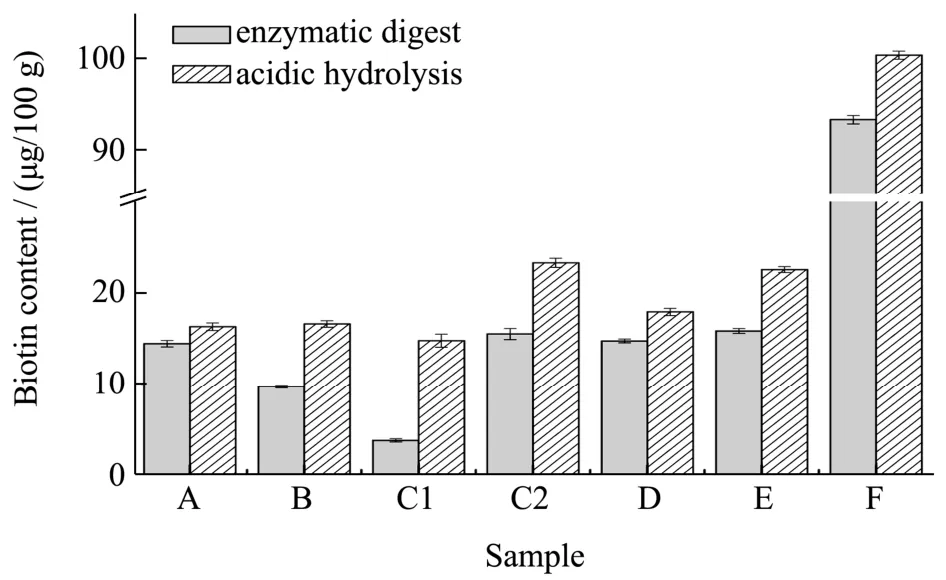
图2 不同提取方式对生物素提取的影响Fig.2 Effect on the extraction of biotin with different extractive methods
对于强化类食品中生物素多采用直接提取、酶解、酸水解方式提取。而特殊医学用途婴儿配方食品配方复杂、涉及的工艺类型较多,产品形态多样;直接提取方式样品难以过滤,所以实验考察了酶解和酸水解两种方式对生物素提取效果的影响(图2)。实验条件如下:
(1)样品中加入45 ℃~50 ℃的水溶解混匀后,加入0.1 g 淀粉酶,在55 ℃下酶解30 min 后冷却至室温,调节试样溶液的pH 值至1.7±0.1,放置约1 min后,调节pH 值至4.5±0.1;
(2)样品用0.2 mol/L 磷酸溶解后在121 ℃下水解30 min,调节试样溶液的pH 值至4.5±0.1;
实验表明(图2),两种提取方式对于不同配方的特殊医学用途婴儿配方食品中生物素的提取效率影响不同,但酸水解均高于酶解。原因可能是食物品的生物素主要以游离形式或与蛋白质结合的形式存在,对于结合态的生物素酶解不能使生物素完全释放,高温酸水解才可以使生物素从蛋白质复合物中释放出来;不同配方的特殊医学用途婴儿配方食品中生物素的两种存在形态比例不同,导致结果差异。所以实验选择用磷酸水解提取。
2.2.2 磷酸浓度的优化
由于实验拟采用免疫亲和柱净化,而用磷酸盐缓冲溶液更适合于生物素在免疫亲和柱上保留和净化,所以实验采用磷酸水解提取。由于磷酸浓度是影响生物素提取的重要因素之一,实验分别考察了磷酸浓度为0.05、0.1、0.2、0.5 mol/L 对提取效率的影响(图3)。结果表明,随着磷酸浓度的增加,生物素的含量逐渐增加,超过0.2 mol/L 有所下降。可能是因为磷酸浓度较低时不能使结合态生物素完全释放出来,而磷酸浓度较高时会导致生物素部分降解,使结果偏低。因此,实验选取磷酸浓度为0.2 mol/L。
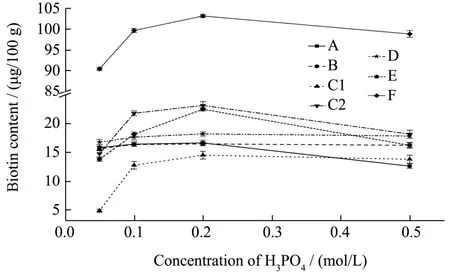
图3 磷酸浓度对生物素提取的影响Fig.3 Effect on the extraction of biotin with different phosphoric acid concentrations
2.2.3 沉淀方式的优化
为防止蛋白质等物质对净化过程产生干扰,实验在磷酸水解后,考察了乙腈、亚铁氰化钾-乙酸锌和调pH 值4.5 三种沉淀方式对生物素提取的影响(图4)。
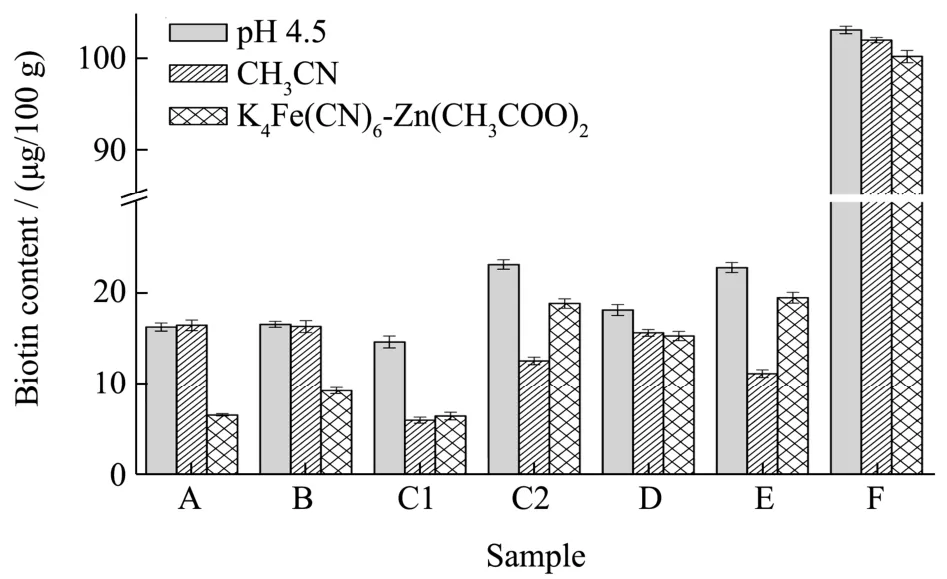
图4 沉淀方式对生物素提取的影响Fig.4 Effect on the extraction of biotin with different precipitation methods
实验表明,乙腈和亚铁氰化钾-乙酸锌两种沉淀方式沉淀效果良好,滤液澄清透明,但生物素含量均偏低;而调pH 值至4.5 后,除蛋白深度水解配方和氨基酸配方滤液出现轻微浑浊外,剩余其他配方特殊医学用途婴儿配方食品的滤液均为澄清透明溶液,沉淀效果良好。原因可能是因为乙腈在沉淀蛋白等物质时同时沉淀了目标物,亚铁氰化钾-乙酸锌是通过生成氰化亚铁酸锌络合物与蛋白质等物质共沉淀,吸附或包裹了部分目标物。由于特殊医学用途婴儿配方食品配方的复杂性和工艺类型的多样性,导致调pH 值至4.5后,蛋白深度水解配方和氨基酸配方仍显轻微浑浊,但不影响样品的净化过程,所以实验选择调pH 值至4.5 沉淀蛋白等物质。
2.2.4 固相萃取柱的选择
特殊医学用途婴儿配方食品配方及其多样复杂,样品中含有的碳水化合物、氨基酸、蛋白质、麦芽糊精等共提取物均会干扰生物素的测定,影响分析的准确性。所以实验考察了可以有效去除样品中盐、磷脂和脂肪的新型的固相萃取柱Prime HLB 和高特异性的免疫亲和柱净化,对生物素基质效应的影响。
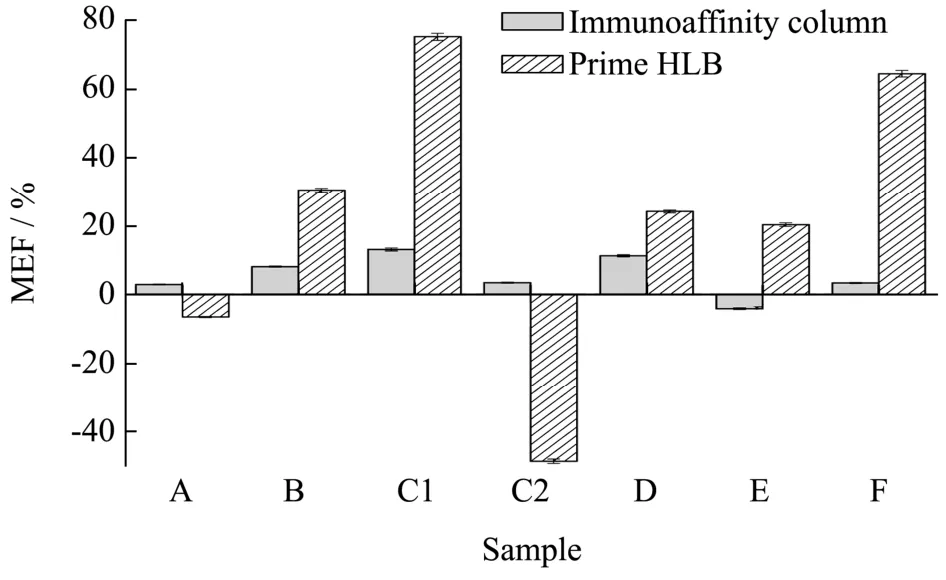
图5 不同固相萃取柱对生物素基质效应的影响Fig.5 Effect of different elution volumes on the matrix effect of biotin
结果表明:特殊医学用途婴儿配方食品配方经免疫亲和柱净化后基质效应明显小于Prime HLB。样品经Prime HLB 净化后,无乳糖配方基质效应绝对值小于15%,基质效应影响较小;其它配方均大于15%,会存在严重的基质效应。由于特殊医学用途婴儿配方食品种类繁多、复杂,难以净化,从而干扰生物素的测定;而免疫亲和柱是基于抗原和抗体反应,除去没有被结合的其他无关物质,专一性强,净化效果良好,基质效应的影响不明显。因此,根据特殊医学用途婴儿配方食品的基质特点,实验选择免疫亲和柱净化。
2.3 方法学考察
2.3.1 线性范围、检出限和定量限
将1.3.1 步骤配制的标准系列工作液按浓度由低到高的顺序依次经超高效液相色谱-串联质谱进行分析测定,以D-生物素标准工作溶液的质量浓度(X)为横坐标,以D-生物素定量离子标准溶液响应峰面积与内标生物素-d2 定量离子溶液响应峰面积之比和生物素-d2 质量浓度的乘积(Y)为纵坐标,绘制标准曲线。在0.50~50.00 ng/mL 范围内线性关系良好,线性回归方程为 Y=0.917333 X +0.43483,其线性相关系数均大于0.9986。按1.3.2 前处理方法处理后,测试其信噪比,以信噪比S/N≥3 得到生物素的检出限(LOD)为0.75 μg/100 g,以信噪比S/N≥10 得到生物素的定量限(LOQ)为2.50 μg/100 g,适合特殊医学用途婴儿配方食品中生物素定性定量分析。
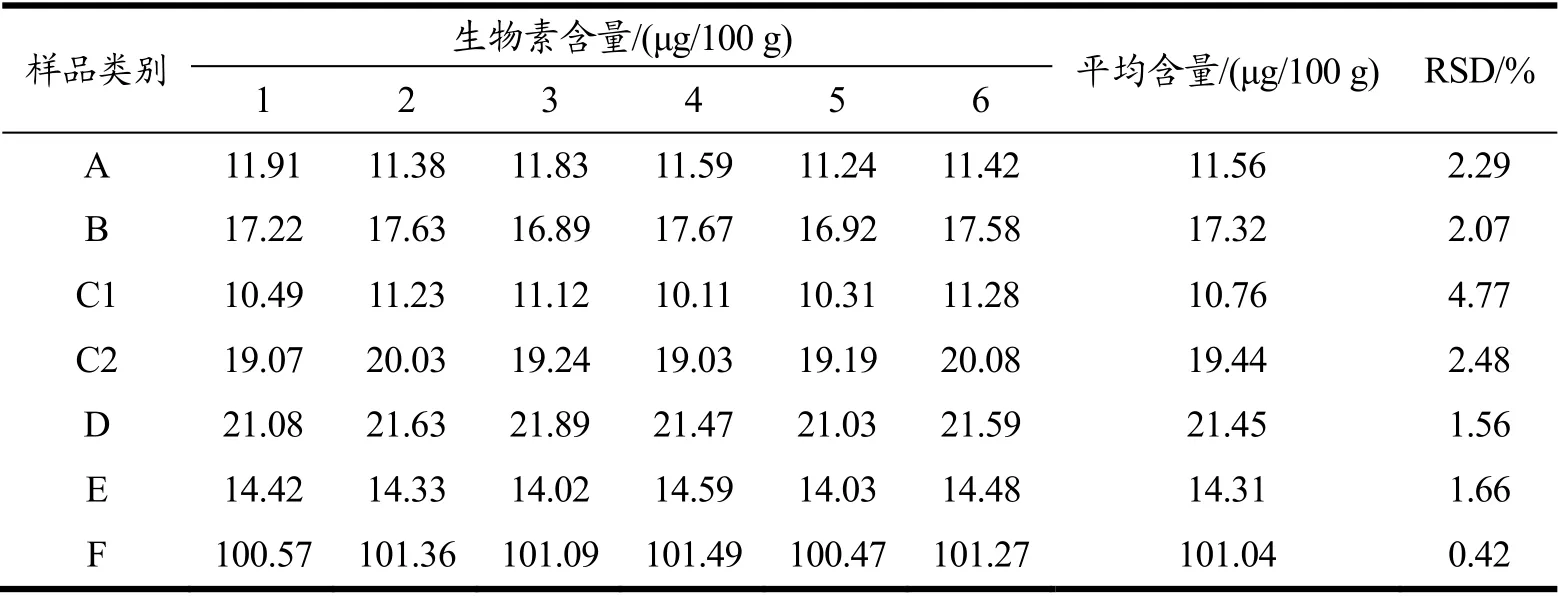
表3 特殊医学用途婴儿配方食品生物素的含量及精密度Table 3 The content and precision of biotin in infant formulas for special medical purposes

表4 方法的回收率和精密度Table 4 Recovery and RSD for the method (n=6)
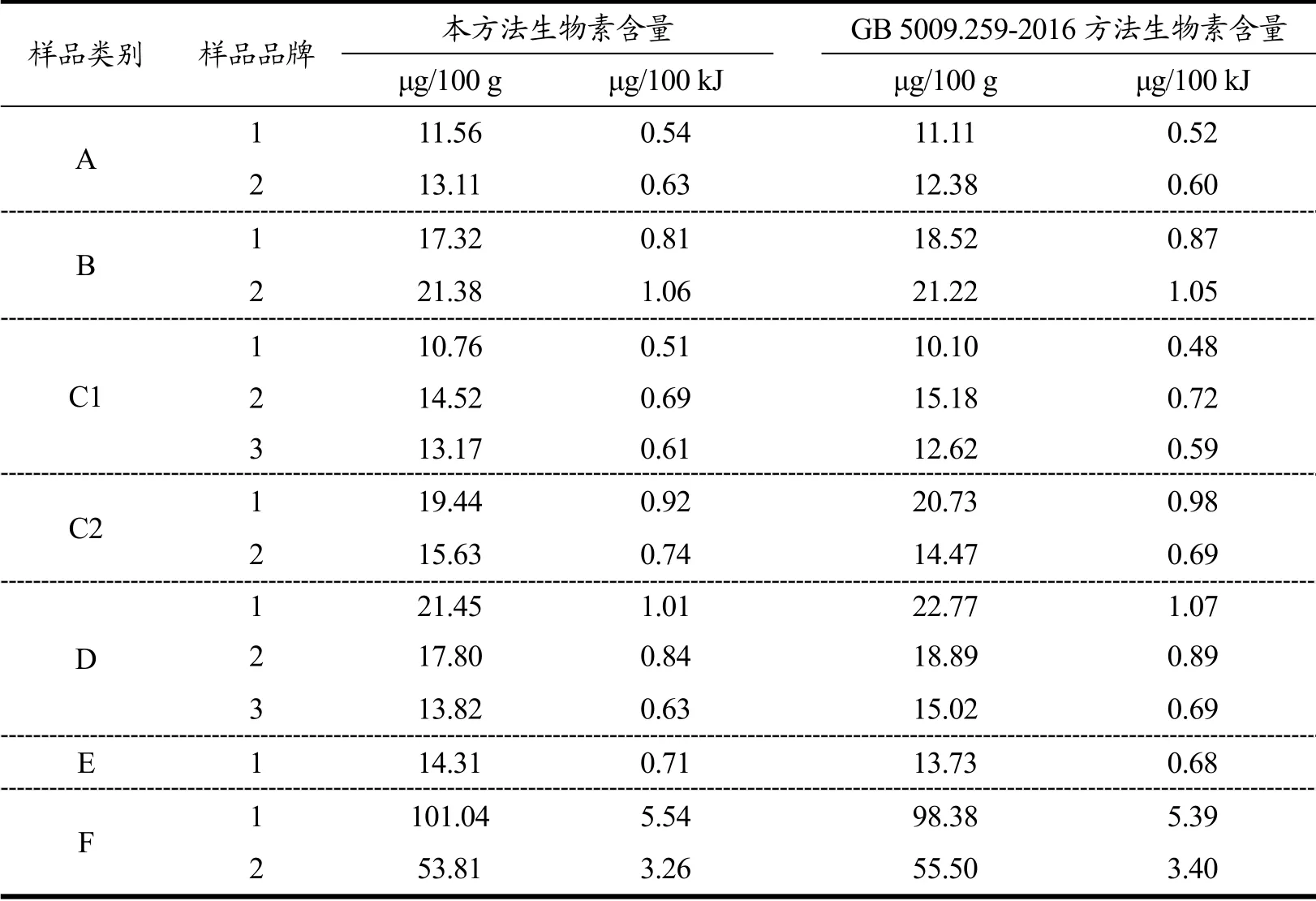
表5 本方法与GB 5009.259-2016 方法在特殊医学用途婴儿配方食品中生物素含量的分析结果比较Table 5 Comparison of results of biotin obtained by GB 5009.259-2016 and the method in this paper in infant formulas for special medical purposes
2.3.2 精密度
特殊医学用途婴儿配方食品:无乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方、氨基酸配方、早产/低出生体质量婴儿配方、氨基酸代谢障碍配方、母乳营养补充剂分别平行取样6 组,按1.3.2 前处理方法处理,进行测定。样品中生物素含量及精密度见表3。结果显示,精密度小于4.77%,实验数据稳定。
2.3.3 回收率
选取深度水解配方奶粉(C1)为代表进行特殊医学用途婴儿配方食品回收率试验,分别添加5.00 μg/100 g、10.00 μg/100 g、20.00 μg/100 g,3 个不同质量浓度的标准溶液进行回收率实验,各个水平平行测定6 次(表4)。由表4 可知,加标回收率在97.27%~102.06%之间,相对标准偏差在3.16%~5.64%之间。深度水解配方奶粉为特殊医学用途婴儿配方食品中最复杂的基质,说明该方法对特殊医学用途婴儿配方食品中不同浓度生物素的测定具有较高的准确度。
2.3.4 基质效应评价
同位素稀释质谱内标法是液相色谱串联质谱技术中消除基质干扰、提高定量准确度最有效的方法[19,20],因此本方法采用同位素稀释质谱法来校正前处理、检测中目标物的损失与干扰,同时采用高特异性的免疫亲和柱对样品进行净化,以最大限度地去除基质干扰成分。研究表明,本方法基质效应均在-15%~15%之间,基质效应不明显。
2.3.5 实际样品的测定
应用本方法和食品安全国家标准方法 GB 5009.259-2016 对市售不同品牌的特殊医学用途婴儿配方食品:无乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方、氨基酸配方、早产/低出生体质量婴儿配方、氨基酸代谢障碍配方、母乳营养补充剂进行分析,比较两种方法之间的差异来验证所建立方法的准确性(表5)。结果表明,两种方法测定结果无明显差异,因此实验建立的方法可以用于特殊医学用途婴儿配方食品中生物素的检测。
根据《GB 25596-2010 特殊医学用途婴儿配方食品通则》及《特殊医学用途婴儿配方食品通则》(GB 25596-2010)问答中生物素含量的参照范围为0.4 μg/100 kJ~2.4 μg/100 kJ,其中乳蛋白深度水解配方或氨基酸配方可调整范围为0.4 μg/100 kJ~5 μg/100 kJ,早产/低出生体重婴儿配方和母乳营养补充剂(均适合于早产/低体重出生儿)可调整范围为≤8.8 μg/100 kJ。由表5 可知,所购特殊医学用途婴儿配方食品中生物素含量均符合国家标准要求。
3 结论
3.1 实验针对特殊医学用途婴儿配方食品配方复杂、形态多样,采用免疫亲和柱进行净化,有效降低了基质干扰成分的影响;采用同位素内标法定量,降低基质效应的影响和校正前处理过程损失带来的偏差,提高了分析方法的准确性及稳定性。
3.2 本方法采用酸水解提取生物素和超高效液相色谱-串联质谱法进行测定,有效缩短了检测周期,提高了分析效率。与国标所采用的微生物方法相比测定结果无明显差异,但操作简单、检验周期短、灵敏度高、重现性好,适用于特殊医学用途婴儿配方食品中生物素的分析检测。可以为特殊医学用途婴儿配方食品中生物素的测定提供科学依据,为产品质量控制或监管提供有力的技术支持。

