GI/GII 型诺如病毒两联装甲RNA 标准样品的研制
王鸣秋,杨俊,常雨桐,张涛,刘丽娟
(1.湖北省食品质量安全监督检验研究院,湖北武汉 430075)(2.中国检验检疫科学研究院,北京 100176)
诺如病毒(Norovirus,NoV)属于杯状病毒科(Caliciviridae),为单股正链无包膜RNA 病毒,直径约为27~40 nm,全长7.5~7.7 kb。诺如病毒是引起人类食源性急性胃肠炎的最重要的病原体之一,在全球范围内广泛分布,诺如病毒引起的食物中毒占食源性疾病暴发的50%以上,在非菌性胃肠炎暴发中占90%以上[1]。我国作为全球15 个腹泻高负担国家之一,腹泻病例中有11.6%检出诺如病毒[2],且病例数量呈现出逐年增长的态势[3]。
诺如病毒目前无法进行体外培养,根据基因组特征分类,可将其分为7 组,GI 和GII 是引起人类感染的两个主要基因组。食品中诺如病毒的检测方法主要基于分子生物学,其中实时荧光逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)方法相对较灵敏、特异性高,应用广泛。由于食品基质复杂,病毒载量低,加之PCR 检测中操作人员随机误差、模板质量和试剂扩增效率等问题可能会造成结果的偏差,因此通常需要加入阳性质控样品保证检测结果的可靠性和准确性[4]。目前主要采用冻干病毒颗粒或裸露的DNA/RNA 作为质控品[5,6],但两种方法均有其缺陷,由于诺如病毒无法进行体外培养,无法大量获取冻干的阳性颗粒,且具有感染可能性;而裸露的DNA/RNA 作为质控品则无法监测核酸提取过程,没有蛋白保护也容易降解。装甲RNA 技术[7]是将噬菌体衣壳蛋白自行包装形成病毒粒子结构,将特定的病毒RNA 片段包裹到衣壳蛋白内,这样制成的病毒样颗粒(virus like particles,VLPs)既无生物危险性,又能和阳性病毒样本一样,监控整个检测过程,耐受RNase 的降解,易于保存和运输。目前装甲RNA 技术已成功应用于RNA 病毒核酸检测标准样品的研究,包括肠道病毒[8]、人体免疫缺陷病毒[9]、戊肝病毒[10]等。然而,适配多项检测标准且同时含有GI和GII 两种基因组的诺如病毒装甲RNA 标准样品制备研究鲜有报道。
本研究基于MS2 噬菌体装甲RNA 技术,研制了内含GI、GII 型诺如病毒两联检测靶标的病毒样颗粒标准品,并开展均匀性、稳定性和定值研究,可作为食品检测、医疗卫生等机构诺如病毒检测的阳性质控品,符合GB 4789.42-2016、SN/T 4784-2017、SN/T 4055-2014 等检测标准,为保障食品安全和控制公共卫生事件的发生提供技术支撑。
1 材料与方法
1.1 仪器与试剂
7500Fast 实时荧光定量PCR 仪,美国Life Technologies 公司;Qubit 荧光定量仪,美国Life Technologies 公司;HT7700 透射电子显微镜,日本日立公司;Gel DocTM XR+凝胶成像仪,美国Bio-Rad公司;AKTA 蛋白纯化系统,美国GE 公司。
大肠杆菌BL21 为本实验室保存;引物和探针由上海生工合成,序列信息见表1;Takara Premix Ex Taq;PrimeScript One Step RT-PCR kit,大连宝生物工程有限公司;Qubit® RNA BR Assay Kit,美国Life technologies 公司;RNAsimple 总RNA 提取试剂盒,北京天根生化科技有限公司;High capacity cDNA reverse transcription kit,美国Thermo Fisher Scientific公司。
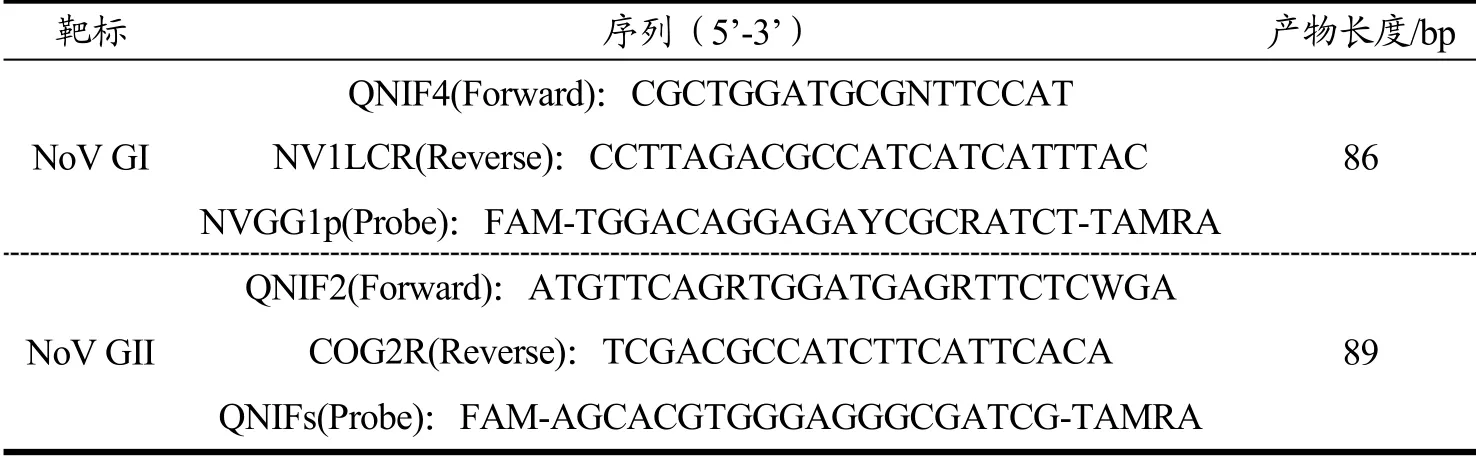
表1 诺如病毒RT-PCR 引物探针序列[11]Table 1 Primers and probes of RT-PCR for Norovirus
1.2 试验方法
1.2.1 重组质粒构建
参考 GenBank 数据库中的 MS2 噬菌体(NC_001417.2)基因组序列以及GB 4789.42-2016、SN/T 4784-2017 和SN/T 4055-2014 中规定的GI/GII型检测靶标所对应的cDNA 序列,委托苏州泓迅生物科技股份有限公司人工合成包含MS2 噬菌体成熟酶蛋白、衣壳蛋白、包装位点和检测靶标(GI、GII 串联)的核酸片段,并克隆到pET-28a(+)载体中,构建重组质粒,命名为pET-MS2-NoV(见图1)。用NotΙ单酶切和SacΙ/NotΙ 双酶切鉴定阳性重组质粒,并进行测序验证。
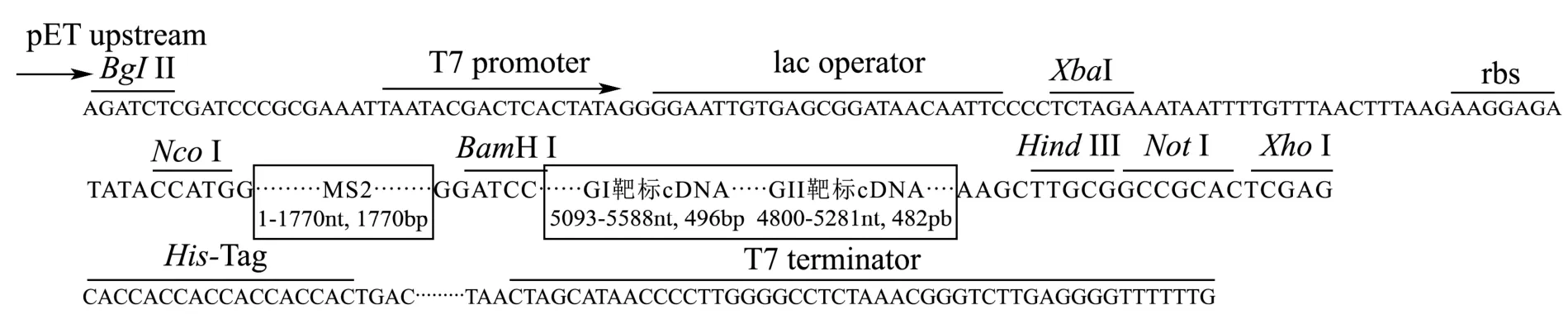
图1 重组质粒pET-MS2-NoV 构建示意图Fig.1 Schematic diagram of the construction of pET-MS2-NoV plasmid
1.2.2 病毒样颗粒的诱导表达
将重组质粒pET-MS2-NoV 转入大肠杆菌BL21感受态细胞,取转化产物50 μL 涂布于Kana 抗性(50 μg/mL)LB 平板上,37 ℃培养过夜。挑取单菌落到含有Kana 抗性的LB 液体培养基中,37 ℃、200 r/min振荡培养过夜。按1:100 比例将过夜培养菌液接入500 mL 培养基中,37 ℃培养至OD600 约为0.5,加入异丙基硫代-β-D-半乳糖苷(IPTG)10 μmol/L 诱导培养12 h,离心5 min 收集菌体沉淀,加入PBS 缓冲液溶解,SDS-PAGE 分析蛋白表达情况。
1.2.3 病毒样颗粒的纯化
将1.2.2 收集的菌体沉淀加入PBS 缓冲液重悬,超声破碎,10000 r/min 离心15 min 收取上清,按照0.25 g/mL 的比例加入NaCl 粉末,在加入等体积20%PEG6000,4 ℃放置过夜充分沉淀,11000 r/min 离心20 min 去上清,沉淀于PBS 中重悬,4 ℃放置5 h 后11000 r/min 离心20 min,收集上清为初步纯化产物。纯化后的上清加入高浓度DNaseI 和RNase,37 ℃反应4 h。降解产物通过丙烯葡聚糖凝胶(Sephacryl S-200 HR)柱层析进一步纯化,柱压0.15 MPa,流速0.5 mL/min,使用样品自动收集器收集A280>50 mmol/L范围的样品峰,并进行SDS-PAGE 电泳检测鉴定。由此获得纯化后含GI-GII 诺如病毒两联装甲RNA,命名为AR-NoV。
1.2.4 病毒样颗粒的鉴定
1.2.4.1 电镜观察
将AR-NoV 稀释到合适浓度,2%磷钨酸负染,透射电镜观察病毒样颗粒的形态,测量其直径。
1.2.4.2 AR-NoV 中残留质粒的检测
RNAsimple RNA 试剂盒提取AR-NoV 中RNA,将其设置为两组,一组进行反转录,另一组不进行反转录,之后两组均以QNIF2、COG2R、QNIFs 为引物探针,同时进行荧光定量PCR 检测,验证是否含有残留质粒DNA。反转录反应条件为:10×RT buffer 2.0 μL,25×dNTP Mix 0.8 μL,10×RT Random Primers 2.0 μL,Multiscribe reverse transcriptase 1.0 μL,RNase Inhibitor 1.0 μL,模板10 μL,补水至20 μL;25 ℃ 10 min,37 ℃ 120 min,85 ℃ 5 min。荧光定量PCR 反应条件为:Premix taq 预混液12.5 μL,上下游引物(10 μM)各1 μL,探针(10 μM)0.5 μL,模板1 μL,补水至25 μL;95 ℃ 20 s;95 ℃ 3 s ,60 ℃ 30 s,收集荧光信号;40 个循环。
1.2.5 初步定值
1.2.5.1 标准曲线的建立
提取AR-NoV 中的RNA,用Qubit® RNA BR Assay Kit 测定RNA 浓度,参照公式:RNA 拷贝数/copies/μL=6.02×1023copies/mol×RNA 浓 度/ng/μL×10-9/(片段长度/bp×340)计算其对应的拷贝数。10 倍梯度稀释提取的RNA,用表1 中引物与探针分别对两种型别靶标进行一步法RT-PCR 检测,每个样品设置3 个平行。反应条件为:2×One step RT-PCR buffer III 10 μL,Takara Ex Taq HS 0.4 μL,PrimeScript RT Enzyme MixII 0.4 μL,上下游引物(10 μM)各0.5 μL,探针(10 μM)0.25 μL,模板1 μL,补水至20 μL;42 ℃ 5 min; 95 ℃ 10 s;95 ℃ 5 s,60 ℃ 30 s,收集荧光信号;40 个循环。以拷贝数对数为横坐标,Ct值为纵坐标绘制标准曲线。
1.2.5.2 定值及不确定度分析
根据初步计算的拷贝数将纯化的AR-NoV用PBS稀释到浓度约为107copies/μL,加入保护剂,每瓶300 μL,分装到2 mL 西林瓶中进行真空冷冻干燥。随机选取15 管,RNAsimple RNA 试剂盒提取RNA,按1.2.5.1 反应条件进行RT-PCR 分别测定两个靶标的Ct值,根据标准曲线计算其拷贝数,计算平均值,得到诺如病毒GI/GII 型VLPs 初步定值结果。定值过程产生的不确定度分析参考JJF 1059.1-2012《测量不确定度评定与表示》[12],采用A 类不确定度公式进行不确定度分析。
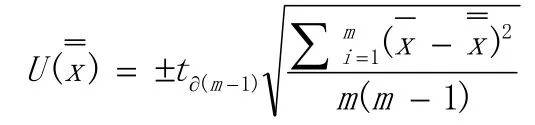
其中tα(m-1)表示显著性水平α,自由度为m-1 的t 值;为单次测量的平均值;为测量的总平均值;m 为测量次数。
1.2.6 均匀性测定
参照GB/T 15000.3-2008[13]要求,随机抽取26 瓶冻干AR-NoV,每瓶设置3 个子样,共52 个子样。按1.2.5 方法检测2 个靶标的有无,并根据标准曲线计算拷贝数,采用SPSS 23.0 软件单因素方差分析法检验样本均匀性。
1.2.7 短期稳定性测定
参照GB/T 15000.3-2008[13]要求,将冻干AR-NoV分别放置在37 ℃、25 ℃保存不同天数后置于-80 ℃保存,统一按1.2.5 方法测定,每个时间点设置3 个平行,采用SPSS 23.0 软件单因素方差和线性回归方法统计样本的稳定性。
2 结果与分析
2.1 重组质粒pET-MS2-NoV 的构建
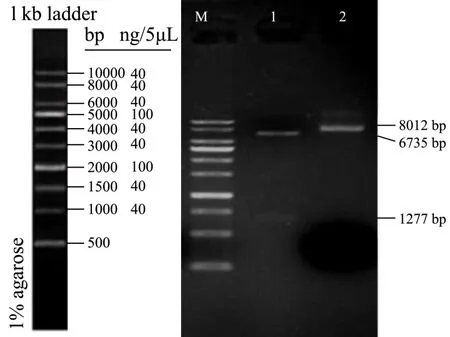
图2 pET-MS2-NoV 的酶切鉴定电泳图Fig.2 Enzyme digestion of pET-MS2-NoV
本研究中病毒样颗粒的表达体系,是利用MS2噬菌体蛋白质和基因组RNA 相互作用的机制及噬菌体衣壳蛋白空间构象的特点构建的。MS2 噬菌体复制酶编码基因5’端存在一个由19 个碱基组成的茎环结构(ACAUGAGGAUUACCCAUGU),该茎环结构实际上是个包装位点,衣壳蛋白二聚体与其结合形成复合物后可启动噬菌体自我包装[14]。若将外源cDNA 序列融合至包装位点后,经转录翻译即可将外源RNA包装到衣壳蛋白内组装成MS2 噬菌体样颗粒,从而有效保护外源RNA 不被RNase 降解[7]。分别用Sac I/Not I 双酶切和Not I 单酶切鉴定构建的重组质粒,琼脂糖凝胶电泳检测条带大小与预期一致,如图2 所示,同时测序结果表明人工合成片段正确克隆到载体pET-28a(+)中,证实重组质粒构建成功,命名为pET-MS2-NoV。
2.2 pET-MS2-NoV 在原核细胞中的诱导表达
将重组质粒pET-MS2-NoV 转入BL21 感受态细胞中,加入IPTG 诱导表达,噬菌体MS2 衣壳蛋白自主装配形成病毒样颗粒,并将诺如病毒RNA 片段包装到粒子内部。经SDS-PAGE 检测,在10~15 ku 之间可观察到一条明显的重组蛋白表达条带,如图3 箭头所示,大小与预期一致,表明MS2 噬菌体衣壳蛋白表达成功。
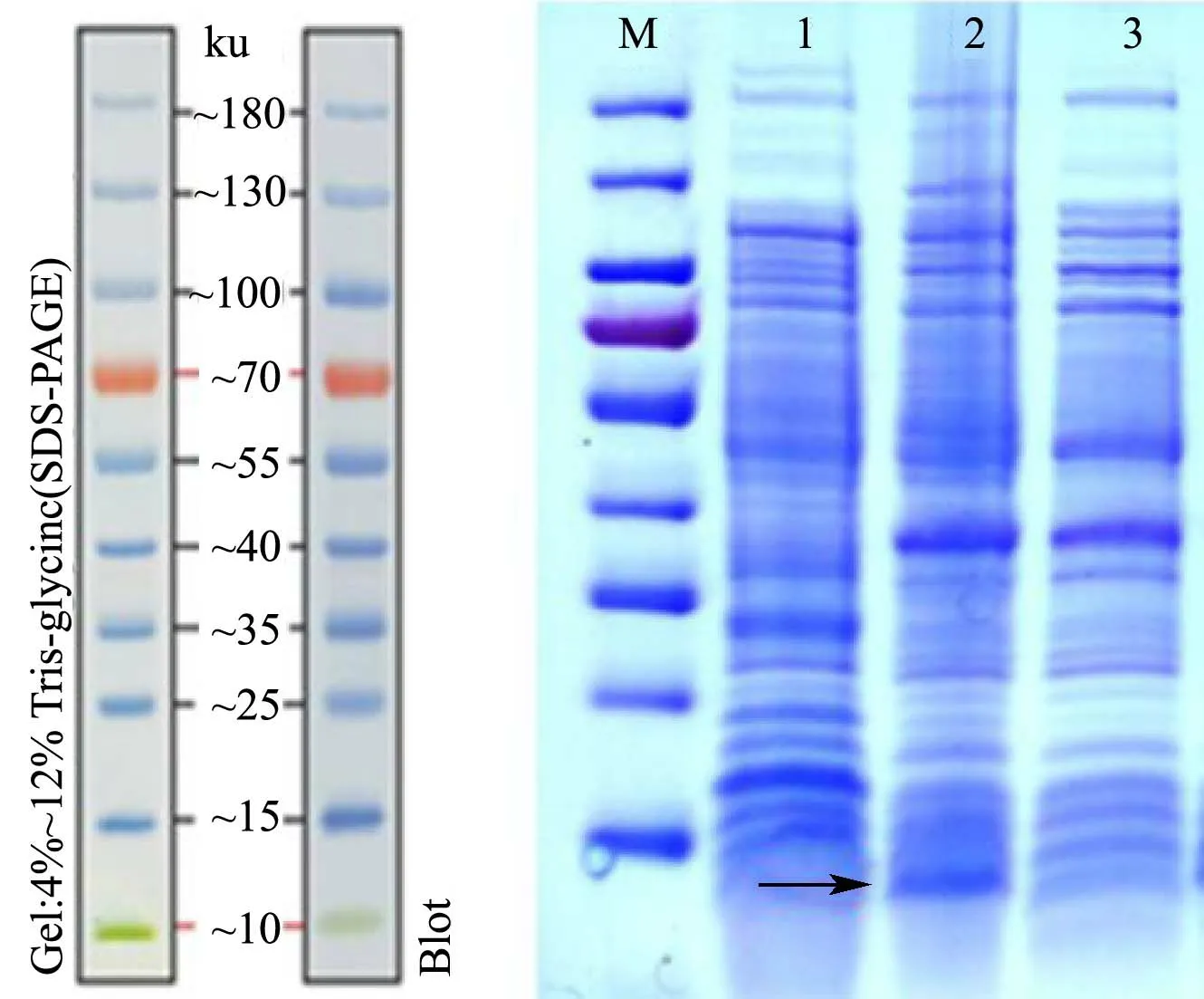
图3 蛋白表达产物的SDS-PAGE 结果Fig.3 SDS-PAGE analysis of expression product
2.3 病毒样颗粒的纯化
在病毒样颗粒纯化过程中,我们发现原核表达蛋白中混有大量的质粒DNA 和杂蛋白,常规DNase 酶消化根本不能完全去除残留质粒DNA。残留的质粒DNA 不经RNA 提取和反转录即可呈现阳性结果,失去了装甲RNA 全过程监测的优势,对标准样品质量影响很大。PEG 沉淀和超速离心法是经典的蛋白质/病毒纯化方式,可有效去除杂蛋白和残留核酸,在RNA 病毒标准品的制备研究中多有报道[15-18],但PEG沉淀后会使终产物残留大量化学试剂,而超速离心效率低仅适合小量制备[19]。Wang S[10]和刘莹等[20]在戊肝病毒装甲RNA 制备中使用超滤离心管可有效去除杂蛋白,时间短、操作简单。而凝胶色谱是利用分子筛效应分离分子量大小不同的蛋白,根据目的蛋白的分子量选择孔径合适的凝胶色谱柱,纯化简单易行、适合规模化操作[21],在多篇文献中均有报道[15-17]。在实际应用中往往会联合使用以上两种或多种不同的病毒样颗粒的纯化方法,相互弥补不足从而达到纯化目的。本研究经预实验发现凝胶色谱的纯化效果与超速离心相当,但如果将表达产物直接上柱可能会因杂蛋白过多而造成堵塞。因此最终采用PEG6000 沉淀大量杂蛋白,高浓度DNase 消化残留DNA 和Sephacryl S-200 HR 凝胶过滤再次纯化的组合方式。
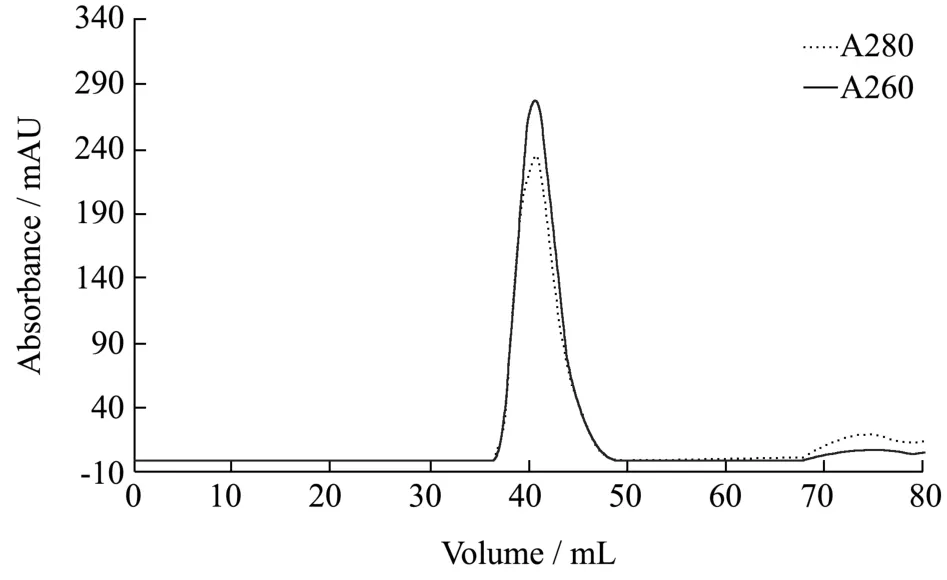
图4 Sephacryl S-200 HR 柱纯化吸光度分析Fig.4 Absorbance of samples during purification by Sephacryl S-200 HR gel chromatography
2.2 中表达产物经PEG6000、高浓度DNase 和RNase 处理初步纯化后,再通过分子筛凝胶柱纯化,图4 显示了目的产物峰出现在洗脱体积40 mL 左右,此时260 nm 和280 nm 吸光值均达到最大,说明此处靶标RNA 和蛋白外壳含量最高,因此收集该处洗脱液进行琼脂糖凝胶电泳和SDS-PAGE 鉴定。图5 显示了纯化后的表达产物,在10~15 ku 处有一明显条带,无杂带干扰,说明病毒样颗粒的纯化效果较好,命名为AR-NoV。

图5 VLPs 纯化后SDS-PAGE 结果Fig.5 SDS-PAGE analysis of VLPs after purification
2.4 病毒样颗粒的鉴定
2.4.1 电镜形态鉴定
应用HT7700 透射电镜,100 kV 加速电压下观察AR-NoV 形态,如图6 所示可见大量结构完整,大小均一的球形颗粒,直径为25 nm 左右,表明该蛋白已自组装形成病毒样颗粒,而且纯化过程中没有造成VLPs 结构破坏,仍保持天然状态。
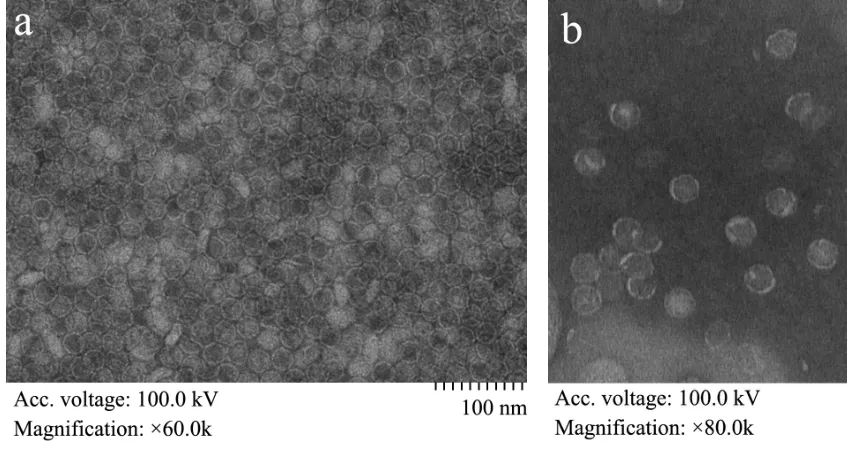
图6 AR-NoV 电镜图Fig.6 The transmission electron microscopy of AR-NoV
2.4.2 AR-NoV 中残留质粒的检测

图7 AR-NoV 残留核酸荧光定量PCR 检测结果Fig.7 Real-time PCR for residual DNA detection in the AR-NoV
以AR-NoV 提取的RNA 为模板,经反转录或不经反转录后同时进行荧光定量PCR,设置重组质粒为阳性对照,ddH2O 为空白对照,如图7 所示,AR-NoV经RT-PCR 后Ct 值为21.71,而直接进行荧光定量PCR的Ct 为35.63(可视为阴性),说明AR-NoV 中无质粒DNA 残留。
2.5 AR-NoV 初步定值
将提取的RNA 用Qubit RNA BR Assay Kits 测定浓度为12.3 ng/μL,根据拷贝数计算公式,计算其拷贝数为2.19×1010copies/μL。10 倍梯度稀释RNA,一步法RT-PCR 分别测定GI 型和GII 型各浓度模板Ct值,扩增曲线如图8 所示。以RNA 各稀释度拷贝数对数为横坐标,以Ct 值为纵坐标绘制标准曲线。GI型NoV 标准曲线为y=-0.241x+12.036,R2=0.994;GII型NoV 标准曲线为y=-0.2333x+11.643,R2=0.999。
将随机选取的15 管冻干AR-NoV 用PBS 稀释后提取RNA,采用RT-qPCR 测定Ct 值,带入上述标准曲线公式计算得到GI 和GII 型AR-NoV 的拷贝数分别为4.04×107copies/μL 和6.16×107copies/μL。采用A类不确定度公式计算得到GI和GII由定值过程引入的不确定度为0.62×107copies/μL 和0.30×107copies/μL,详情见表2。因此本次制备的诺如病毒标准品AR-NoV中GI 型NoV 定值结果为(4.04±0.62)×107copies/μL,GII 型NoV 定值结果为(6.16±0.30)×107copies/μL。

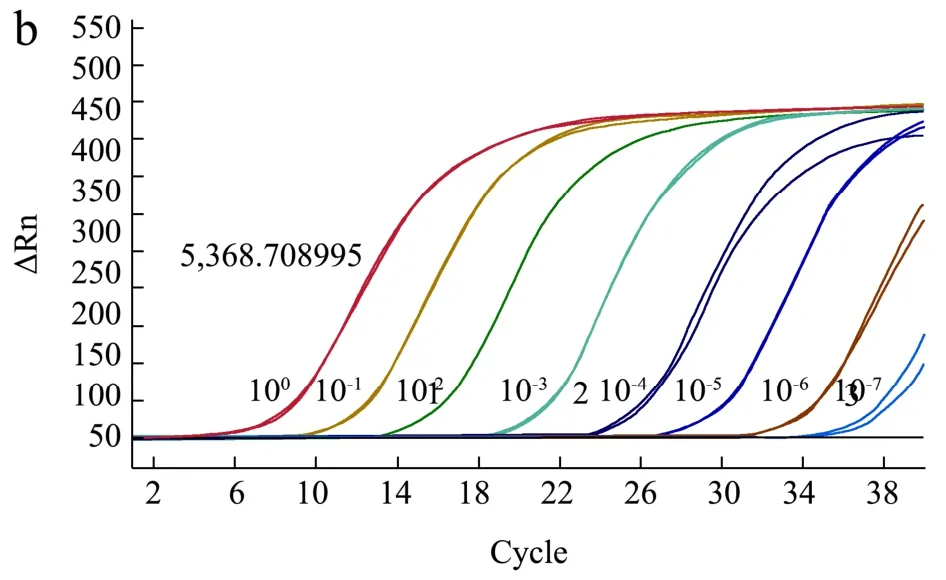
图8 AR-NoV 标准曲线制备RT-PCR 扩增图Fig.8 Standard curve preparation RT-PCR of AR-NoV
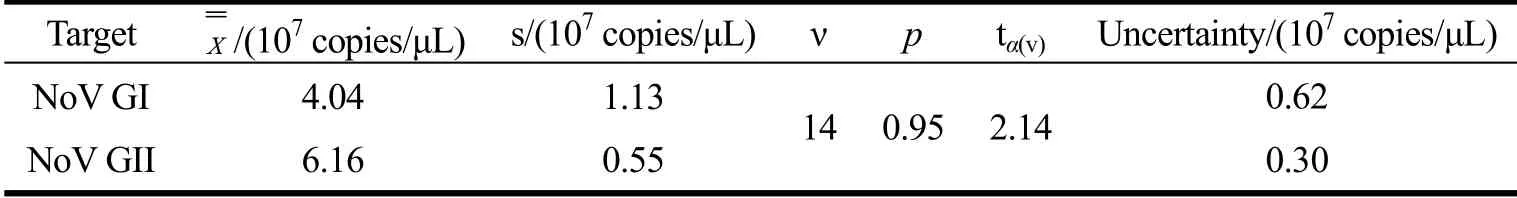
表2 AR-NoV 中GI/GII 型靶标定值不确定度结果Table 2 Quantification uncertainty of AR-NoV for type GI/GII Norovirus

表3 均匀性检测方差分析Table 3 Variance analysis of homogeneity test
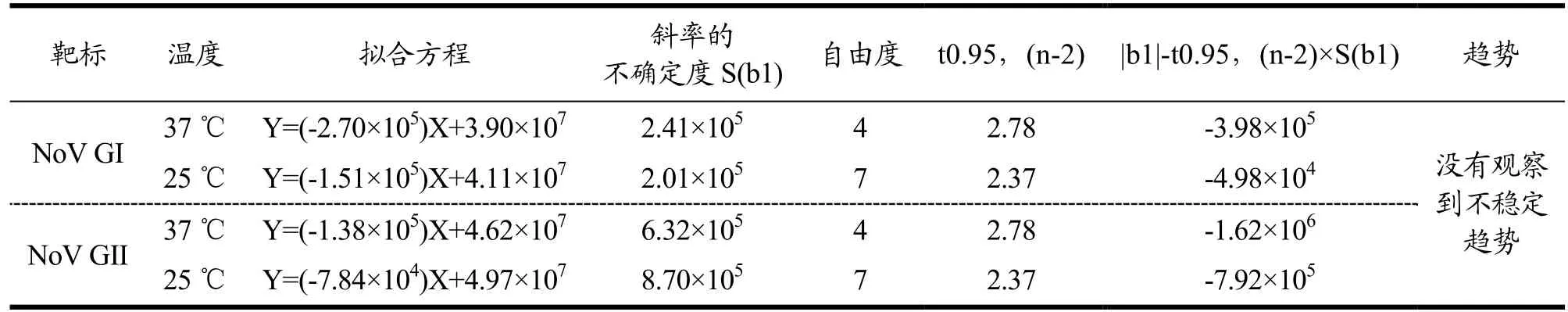
表4 短期稳定性结果分析Table 4 Trend test for short-term stability
2.6 均匀性检验
为考察特征量值的均匀性,随机选取26 管冻干AR-NoV 提取RNA 后进行RT-PCR 检测,根据2.5 得到的标准曲线定量AR-NoV 中GI/GII 元件拷贝数浓度,采用单因素方差分析法进行均匀性检验(表3)。根据显著性水平α=0.05 和自由度(25,52)可得临界值F0.05(25,52)=1.72,统计结果表明GI 和GII 所得F 均小于F0.05(25,52),组内与组间无明显差异,本批标准样品的拷贝数浓度量值在瓶间具有良好的均匀性。
2.7 短期稳定性检验
短期稳定性检验旨在考察标准样品的运输稳定性,本研究选择了37 ℃和25 ℃两个运输中可能出现的温度点考察标准样品拷贝数浓度短期稳定性。采用RT-PCR 标准曲线定量37 ℃/25 ℃在不同时间点抽取样品的拷贝数浓度,通过样品拷贝数浓度随时间变化情况,采用线性回归模型Y=b0+b1X 进行趋势分析(b0,b1为回归系数,X 为保存时间,Y 为标准物质特征量值)。通过数据分析显示,|b1|均小于t0.95,(n-2)×S(b1),表明斜率不显著,没有观察到不稳定(表4)。因此,本研究制备的AR-NoV 标样在37 ℃至少可稳定保存15 d;25 ℃至少可稳定保存24 d,结果见表4。与传统方法制备的RNA 病毒标准品相比,如原霖等[22]研制的PRRSV 冻干病毒颗粒标准品25 ℃和37 ℃可稳定7 d和1 d,刘志玲等[23]研制的病毒性出血性败血症病毒cDNA 标准物质室温可稳定7 d,该装甲RNA 标样短期稳定性远高于冻干病毒颗粒和cDNA,有效解决了RNA 质控品保存和运输稳定性问题。
3 结论
3.1 诺如病毒的传播途径主要为人与人之间的接触传播、食源性传播和水源性传播,不同基因型的诺如病毒的传播途径存在一定的差异[24]。GII 型诺如病毒是全球所有年龄段人群中大部分诺如病毒爆发的原因,而在食源性和水源性暴发中更常检测到GI 型[25]。由于诺如病毒仅有一小段足够保守的基因组序列可用来设计RT-PCR 检测引物和探针[26],大部分研究报道的检测靶标均集中在ORF1-ORF2 连接区域[27,28]。本研究对现有食品中诺如病毒检测标准中靶标序列进行梳理,将GI 和GII 型检测靶标对应的cDNA 序列串联合成,表达出同时含有GI 和GII 型靶标的两联装甲RNA,可适用于GB 4789.42-2016、SN/T 4784-2017和、SN/T 4055-2014 三个检测标准的阳性参考物质,同时两联装甲RNA 能够满足多重检测对阳性标准样品的需求,减少质控样品提取、加样、扩增等步骤,提高检测的时效性和经济性,与现有标准品相比具有一定优势。
3.2 从理论上讲,MS2 衣壳蛋白的包装长度应与其基因组大小3569 nt 相近,但研究人员通过改变包装策略、增加或修饰包装位点等方法大幅度提升了外源片段包装长度。Zhan S 等[29]采用单质粒双表达系统在大肠杆菌中成功包装3024 nt 的HIV 病毒;Lin GG 等[15]通过增加pac 位点的数目和亲和力构建了包含4942 nt的寨卡病毒装甲RNA 表达系统;Zhang L 等[30]首次实现了MS2 噬菌体衣壳蛋白对双链DNA 的包装,包装长度达到6.5 kb。包装长度的增加意味着MS2 噬菌体可包容多种病毒或单种病毒多重靶标,使得标准样品的制备更加经济、高效。另外,Yao L 等[25]通过对噬菌体MS2 和Qβ装甲RNA 在-20 ℃、4 ℃、45 ℃三种保存条件下的对比试验,发现由噬菌体Qβ制备的装甲RNA 具有更高的稳定性,为标准品提供了一条新的制备策略。
3.3 综上所述,本研究制备的内含GI 和GII 型诺如病毒检测靶标的两联装甲RNA 纯度高,拷贝数高,均匀性和稳定性良好,可作为GB 4789.42-2016、SN/T 4784-2017 和、SN/T 4055-2014 三项检测标准的阳性质控品,同时满足多重检测需求,实现了对诺如病毒检测全过程质控,有望申报为国家标准样品,并为其他病原体核酸标准样品制备提供了思路。

