高危型HPV感染与宫颈上皮组织中P53、CyclinD1基因表达的关系
欧阳良良 袁育珺 汪红
【摘要】 目的:觀察P53、细胞周期蛋白D1(CyclinD1)基因在高危型人乳头瘤病毒(HR-HPV)感染宫颈上皮组织中表达情况,并分析P53、CyclinD1与HR-HPV感染的关系。方法:收集2019年1月-2020年12月于本院完成宫颈活检的100例宫颈上皮组织标本的实验室资料进行回顾性分析。将其根据病变程度分为子宫颈癌组(n=47)、宫颈上皮内瘤变组(n=27)及正常组(n=26)。比较三组P53、CyclinD1蛋白阳性表达率与HR-HPV阳性检出率,分析P53、CyclinD1与HR-HPV的关系。结果:子宫颈癌组与宫颈上皮内瘤变组P53、CyclinD1蛋白阳性表达率、HR-HPV阳性检出率均高于正常组,且子宫颈癌组中P53、CyclinD1蛋白阳性表达率、HR-HPV阳性检出率均高于宫颈上皮内瘤变组(P<0.05)。HR-HPV阳性宫颈上皮组织中P53、CyclinD1蛋白阳性表达率均高于HR-HPV阴性的宫颈上皮组织(P<0.05)。HR-HPV感染与宫颈上皮组织中P53、CyclinD1蛋白阳性表达均呈正相关(τ=0.459、0.565,P<0.05)。结论:HR-HPV感染与宫颈上皮组织中P53、CyclinD1基因阳性表达存在一定联系。
【关键词】 高危型人乳头瘤病毒 P53 细胞周期蛋白D1 宫颈上皮组织
[Abstract] Objective: To observe the expression of P53 and CyclinD1 genes in high-risk human papillomavirus (HR-HPV) infection cervical epithelial tissues, and analyze the relationship between P53, CyclinD1 and HR-HPV infection. Method: The laboratory data of 100 cervical epithelial tissue specimens completed cervical biopsy in our hospital from January 2019 to December 2020 were collected for retrospective analysis. According to the lesion degree, they were divided into cervical cancer group (n=47), cervical intraepithelial neoplasia group (n=27) and normal group (n=26). The positive expression rates of P53 and CyclinD1 protein and the positive detection rates of HR-HPV were compared among the three groups, and the relationship between P53, CyclinD1 and HR-HPV was analyzed. Result: The positive expression rates of P53, CyclinD1 and positive detection rates of HR-HPV in cervical cancer group and cervical intraepithelial neoplasia group were higher than those in normal group, and the positive expression rates of P53, CyclinD1 and positive detection rate of HR-HPV in cervical cancer group were higher than those in cervical intraepithelial neoplasia group (P<0.05). The positive expression rates of P53 and CyclinD1 protein in HR-HPV positive cervical epithelial tissues were higher than those in HR-HPV negative cervical epithelial tissues (P<0.05). HR-HPV infection was positively correlated with P53 and CyclinD1 protein in cervical epithelial tissue (τ=0.459, 0.565, P<0.05). Conclusion: HR-HPV infection has a certain relationship with the positive expression of P53 and CyclinD1 genes in cervical epithelial tissues.
[Key words] High-risk human papillomavirus P53 CyclinD1 Cervical epithelial tissues
First-author’s address: Eastern Hospital of Jiujiang University Affiliated Hospital, Jiujiang 332000, China
doi:10.3969/j.issn.1674-4985.2021.22.006
人乳头瘤病毒(human papillomavirus,HPV)感染是引发宫颈癌的重要原因,特别是高危型HPV(high-risk HPV,HR-HPV)感染是宫颈癌病变最为重要因素,威胁女性生命安全[1]。研究显示,宫颈上皮感染HR-HPV后可通过多种生物学途径引起细胞生物学行为改变,进而造成细胞癌变[2]。宫颈上皮内瘤变发展过程中,HPV可长期在宫颈相关细胞内繁殖,促进病变发展,导致病情加重,且HPV含量越高,感染越重,HR-HPV阳性者宫颈病变程度较阴性者重[3]。可见,HR-HPV感染在宫颈癌发生及发展中发挥重要作用,寻求HR-HPV感染在子宫颈癌病情变化中可能的分子机制十分必要。P53是一种重要的抑癌基因,可抑制DNA聚合酶功能,阻碍多核苷酸延伸,突变型P53基因可与细胞周期蛋白相结合,促进细胞转化及增生,加速肿瘤发生、发展[4]。细胞周期蛋白D1(CyclinD1)是一种原癌基因,通过与细胞周期素依赖性激酶(CDK)4或CDK6相结合形成复合物,增强DNA转录,缩短细胞周期,加速细胞增殖速度,在肿瘤发展中具有一定作用[5-6]。推测CyclinD1、P53可能与HR-HPV有一定关系,相互作用促进子宫颈癌的发生及发展,但目前关于两者与HR-HPV感染的关系鲜见报道。基于此,本研究主要观察P53、CyclinD1与HR-HPV感染的关系,现报道如下。
1 资料与方法
1.1 一般资料 收集2019年1月-2020年12月于本院完成宫颈活检的100例宫颈上皮组织标本的实验室资料进行回顾性分析。纳入标准:(1)子宫颈癌、宫颈上皮内瘤病变符合文献[7]中诊断标准,且均经病理学检查确诊;(2)患者入院前未经化疗或放疗干预;(3)病历资料、本次研究所需实验室相关资料完整。排除标准:(1)合并乳腺癌、胃癌等其他恶性肿瘤者;(2)合并肝肾功能不全者;(3)既往存在宫颈手术史或宫颈病变史者;(4)伴血液系統疾病者;(5)凝血功能障碍者。根据病变程度将组织标本分为子宫颈癌组(n=47)、宫颈上皮内瘤变组(n=27)及正常组(正常炎症,n=26)。本研究已经医院伦理委员会批准。
1.2 方法
1.2.1 HR-HPV检测方法 用凯普无菌细胞采集刷取患者宫颈脱落细胞,液氮冷冻后保存在-80 ℃冰箱备用;取液氮冷冻的宫颈组织标本,采用HPV-DNA分型检测试剂盒(山东达安公司)测定宫颈组织标本中HR-HPV DNA的含量,方法为第2代杂交捕获法,首先采用分离法抽提DNA,而后进行聚合酶链反应(PCR)扩增,最后进行杂交检测并判断HR-HPV分型,共测定HPV16、18、31、33、35、39、45、51、52、56、58、59、68,13种HR-HPV,操作严格遵照试剂盒说明书进行;以标本表达值相对光单位(RLU)/阳性标准品阈值(CO)作为病毒负荷量,RLU/CO值越高,病毒负荷量越大;RLU/CO≥1.0则判定为HR-HPV阳性,反之为阴性。
1.2.2 P53、CyclinD1蛋白表达检测方法 常规石蜡包埋宫颈上皮组织,4 μm切片;90℃烤箱烤片15 min;常规脱蜡,进行梯度乙醇脱水(100%、95%、80%、75%),冲洗酒精,置于蒸馏水中清洗,枸橼酸盐抗原修复,过氧化氢去除内源性过氧化物酶,加入P53、CyclinD1一抗4 ℃过夜;进行二氨基联苯胺(DAB)显色(试剂盒均购自北京梦怡美生物科技公司),镜下观察可见黄色颗粒显色,终止染色;苏木精复染3 min,碳酸锂返蓝10 s;脱水及透明处理后,中性树胶封片,以磷酸盐缓冲溶液(PBS)代替一抗作为阴性对照,PBS为0.01 mol/L,pH=7.4。结果判定:P53、CyclinD1蛋白均表达于细胞核,呈棕黄色染色,每张切片于高倍(×400)镜下选择5个视野观察100个细胞,取阳性细胞占比的平均值。P53以阳性细胞占比<10%为阴性(-);阳性细胞占比10%~25%为弱阳性(+);阳性细胞占比26%~50%为中度阳性(++);阳性细胞占比超过50%为强阳性(+++)。CyclinD1以无阳性细胞为阴性(-);阳性细胞占比低于10%为弱阳性(+);阳性细胞占比为10%~25%为中度阳性(++);阳性细胞占比超过25%为强阳性(+++)。
1.3 统计学处理 采用SPSS 23.0软件对所得数据进行统计分析,计量资料用(x±s)表示,三组比较采用方差分析,两组比较采用t检验;计数资料以率(%)表示,比较采用字2检验,若期望值<5,采用连续校正字2检验;等级资料采用秩和检验;宫颈上皮组织中P53、CyclinD1基因表达与HR-HPV的关系采用Kendall’s tau-b等级相关系数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较 正常组年龄35~65岁,平均(50.36±2.45)岁;身体质量指数(BMI)17.6~26.9 kg/m2,平均(22.36±1.21)kg/m2。宫颈上皮内瘤变组年龄34~64岁,平均(50.48±2.41)岁;BMI 17.9~26.7 kg/m2,平均(22.45±1.17)kg/m2。子宫颈癌组年龄32~64岁,平均(50.12±2.50)岁;BMI 18.1~26.8 kg/m2,平均(22.33±1.18)kg/m2。三组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
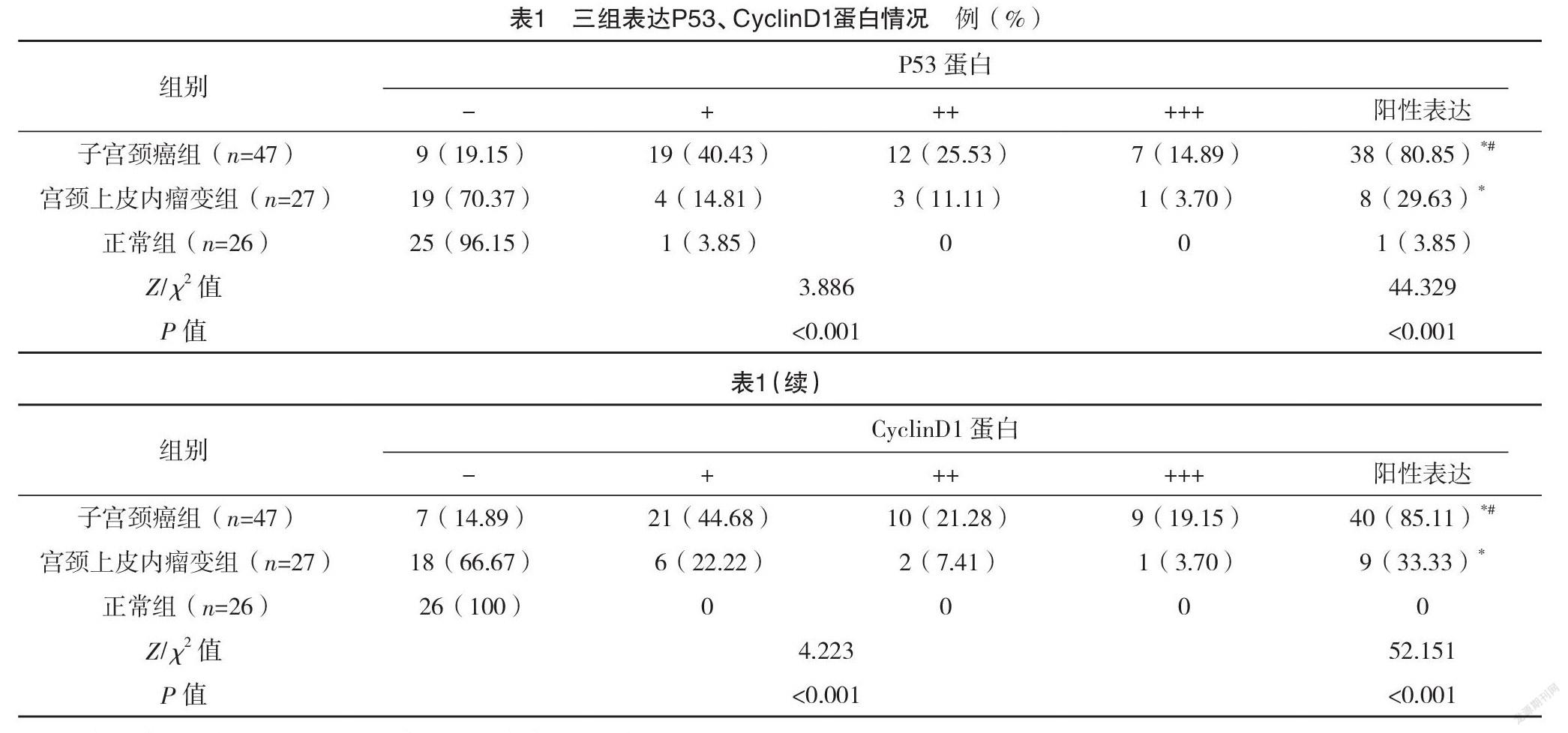
2.2 三组P53、CyclinD1蛋白表达情况比较 子宫颈癌组与宫颈上皮内瘤变组P53、CyclinD1蛋白阳性表达率均高于正常组,且子宫颈癌组中P53、CyclinD1蛋白阳性表达率均高于宫颈上皮内瘤变组,差异均有统计学意义(P<0.05),见表1。
2.3 三组HR-HPV阳性检出率比较 子宫颈癌组、宫颈上皮内瘤变组、正常组患者HR-HPV阳性检出率分别为93.62%(44/47)、40.74%(11/27)、15.38%(4/26);子宫颈癌组与宫颈上皮内瘤变组HR-HPV阳性检出率均高于正常组,差异均有统计学意义(字2=45.497、4.197,P<0.001);且子宫颈癌组HR-HPV阳性检出率高于宫颈上皮内瘤变组,差异有统计学意义(字2=25.125,P<0.001)。
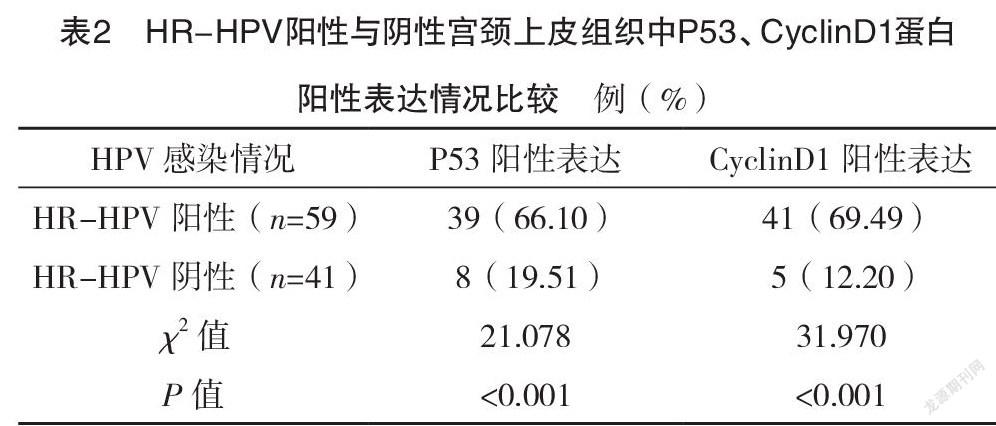
2.4 HR-HPV阳性与阴性宫颈上皮组织中P53、CyclinD1蛋白阳性表达情况比较 HR-HPV阳性宫颈上皮组织中P53、CyclinD1蛋白阳性表达率均高于HR-HPV阴性宫颈上皮组织,差异均有统计学意义(P<0.05),见表2。
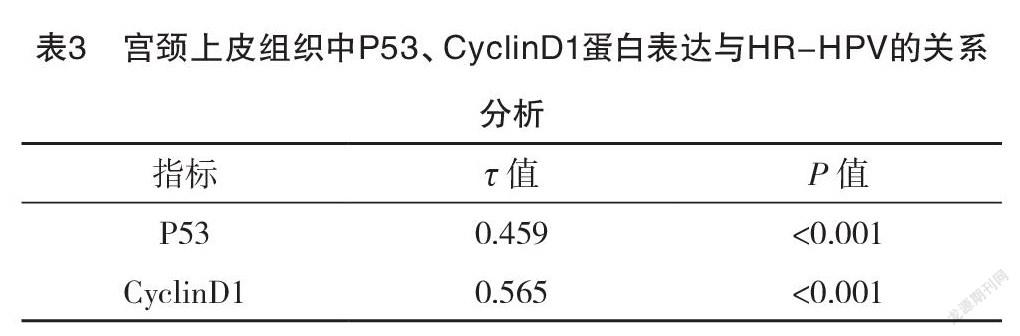
2.5 宫颈上皮组织中P53、CyclinD1蛋白表达与HR-HPV的关系分析 经Kendall’s tau-b相关系数检验,结果显示,HR-HPV感染与宫颈上皮组织中P53、CyclinD1蛋白阳性表达均呈正相关(P<0.05),见表3。
3 讨论
尽管近年宫颈癌筛查及防治工作不断进展,但其发病率及病死率仍处于较高水平,且发病年龄趋于年轻化趋势[8]。研究显示,HR-HPV感染是宫颈癌发生重要原因,且抑癌基因失活、癌基因激活、DNA转录失控、细胞周期调控紊乱等均与宫颈癌发生发展密切相关[9-10]。宫颈上皮内瘤变中HR-HPV感染不直接影响细胞生物学行为,常通过改变宿主细胞基因表达产生相应作用,细胞中的原癌、抑癌基因均受到HR-HPV调控[11]。
P53是目前常见的抑癌基因,正常情况下,P53基因不稳定,半衰期短,一旦细胞内DNA受到异常刺激或损伤时,P53被激活,蛋白表达增加,半衰期延长,参与致癌作用[12]。P53基因活化不仅使细胞停止在G1或者G2期,修复损伤细胞,还可诱发细胞凋亡,促进细胞转化及增生,导致肿瘤的发生[13]。但P53抑癌功能常因突变而消失,当P53功能失活,会使得受损DNA进入细胞周期,促进细胞增殖,导致肿瘤发生[14]。CyclinD1是原癌基因,在细胞周期中具有正调节作用,可与相应的激酶结合形成复合物后,促进DNA转录,使得细胞发生分裂及增殖,增强细胞生长活力[15-16]。据报道,当CyclinD1表达异常时,细胞发生分裂及增殖紊乱,导致肿瘤发生及发展[17]。综上推测P53、CyclinD1基因表达可能与HR-HPV感染有关,相互作用共同促进宫颈癌发生及发展。
本研究结果显示,子宫颈癌组、宫颈上皮内瘤变组的P53、CyclinD1蛋白阳性表达率、HR-HPV阳性检出率均高于正常组,且以子宫颈癌组最高,其次是宫颈上皮内瘤变组;HR-HPV阳性宫颈组织中的P53、CyclinD1蛋白阳性表达率高于HR-HPV阴性宫颈组织,说明随着子宫颈癌病变发展及HR-HPV的持续感染,P53、CyclinD1蛋白表达升高,推测HR-HPV感染与P53、CyclinD1蛋白表达有关。分析其原因可能为,HR-HPV的遗传物质可整合进入宫颈上皮细胞的基因组DNA,引起多种基因表达异常,HR-HPV通过调控原癌、抑癌基因表达影响细胞生物学行为,促进宫颈癌发展[18]。CyclinD1蛋白表达升高或基因扩增时,CyclinD1-CDK复合物增加,促使细胞异常增殖,抑制细胞凋亡,促进肿瘤发生及发展[19]。P53过表达时,受损的DNA常进入细胞周期,促进细胞增殖,导致肿瘤发生[20]。为验证假说,本研究进一步做相关性检验发现,HR-HPV与宫颈上皮组织中P53、CyclinD1蛋白阳性表达呈正相关(P<0.05),证实上述假说,提示HR-HPV感染可能与宫颈上皮组织中P53、CyclinD1蛋白表达有关,HR-HPV感染可能通过原癌及抑癌基因异常表达造成生物学行为改变,最终引发宫颈癌。未来可考虑通过阻断P53、CyclinD1蛋白表达诱导HR-HPV感染细胞凋亡。但目前关于P53、CyclinD1基因表达与HR-HPV感染关系的具体作用机制尚未明确,未来仍需进一步探究。
综上所述,子宫颈癌组织中P53、CyclinD1蛋白高度表达,且P53、CyclinD1蛋白阳性表达与HR-HPV感染存在一定联系,P53、CyclinD1有望成为子宫颈癌基因治疗的潜在靶点。
参考文献
[1] Zhang L,Xie F,Wang X,et al.Previous cervical cytology and high-risk human papillomavirus testing in a cohort of patients with invasive cervical carcinoma in Shandong Province, China[J/OL].PLoS One,2017,12(6):e0180618.
[2] Zhang L,Bi Q,Deng H,et al.Human papillomavirus infections among women with cervical lesions and cervical cancer in Eastern China: genotype-specific prevalence and attribution[J].BMC Infect Dis,2017,17(1):107.
[3] Lu Z,Chen H,Zheng X M,et al.Expression and clinical significance of high-risk human papillomavirus and invasive gene in cervical carcinoma[J].Asian Pac J Trop Med,2017,10(2):195-200.
[4]趙子骞,梁新苗,张飞跃,等.基于生物信息学技术探讨宫颈癌肿瘤组织中P53突变、共表达网络及临床转归分析[J].中国医药生物技术,2019,14(1):27-32.
[5]周密,罗祥力,冯露.Beclin1,EGFR,cyclinD1在新辅助化疗宫颈癌组织中的表达及临床意义[J].标记免疫分析与临床,2020,27(2):61-67.
[6] Wang P,Liu S,Cheng B,et al.Promoting effect of cyclin D1 overexpression on proliferation and epithelial mesenchymal transition of cervical squamous cell carcinoma SiHa cells[J].Chin J Pathol,2017,46(3):187-192.
[7]谢幸,孔北华,段涛.妇产科学[M].9版.北京:人民卫生出版社,2018:295-298.
[8] Zhou J,Wu S G,Sun J Y,et al.Clinicopathological features of small cell carcinoma of the uterine cervix in the surveillance,epidemiology,and end results database[J].Oncotarget,2017,8(25):40425-40433.
[9] Brebi P,Ili C G,Andana A,et al.Frequency of Human papillomavirus in women attending cervical cancer screening program in Chile[J].Bmc Cancer,2017,17(1):518.
[10]朱若熙,赵卫红,郝敏.细胞因子IL-2、IL-10与高危型HPV感染和宫颈癌关系的研究进展[J].国际妇产科学杂志,2019,46(2):125-128.
[11]陈佳佳,陆晓媛,经莉.宫颈癌组织中CAC1的表达变化及其与宫颈HR-HPV感染的关系[J].标记免疫分析与临床,2020,27(2):215-218.
[12]赵若晗,史嘉翊,刘馨璥,等.CDK1,CENPT和P53在乳腺癌中的表达及意义[J].中国医学创新,2020,17(9):28-31.
[13] Zhang Y,Na R,Wang X.LncRNA WT1-AS up-regulates P53 to inhibit the proliferation of cervical squamous carcinoma cells[J].BMC Cancer,2019,19(1):1052.
[14]张桂芳,余静容,陈小青.卵巢癌患者P53蛋白,COX-2,Bcl-2,GST-π表达情况及其与预后的关系研究[J].中国医学创新,2019,16(34):120-123.
[15] Cao L,Liu Y,Wang D,et al.MiR-760 suppresses human colorectal cancer growth by targeting BATF3/AP-1/cyclinD1 signaling[J].J Exp Clin Cancer Res,2018,37(1):83.
[16] Benard O,Qian X,Qian X,et al.p21CIP1 Promotes Mammary Cancer-Initiating Cells via Activation of Wnt/TCF1/CyclinD1 Signaling[J].Mol Cancer Res,2019,17(7):1571-1581.
[17] Ramos-García P,González-Moles M Á,Ayén Á,et al.
Asymmetrical proliferative pattern loss linked to cyclin D1 overexpression in adjacent non-tumour epithelium in oral squamous cell carcinoma[J].Arch Oral Biol,2019,97(9):12-17.
[18]石麗萍,生秀杰.宫颈癌前病变组织中高危型HPV感染与原癌基因、抑癌基因表达的相关性分析[J].海南医学院学报,2017,23(1):14-17.
[19]侯玉朱,王蓁,袁芳.宫颈癌组织P53和CyclinD1蛋白表达及意义[J].齐鲁医学杂志,2016,31(2):130-132.
[20]康连杰,郭胜香,董昂.宫颈上皮病变中高危型HPV感染与病变分级及P53、p16INK4a和细胞周期蛋白表达的关系[J].临床和实验医学杂志,2020,19(4):391-394.
(收稿日期:2021-03-10) (本文编辑:田婧)

