不同色谱柱检测植物油中脂肪酸组成条件优化*
周 洲 张颖霞 杜 娟 杨晓磊 李 红
(1 中储粮油脂有限公司 100043) (2 中储粮镇江粮油质量检测中心有限公司 224100) (3 中央储备粮镇江直属库有限公司 224100)
脂肪酸组成是油脂的特征指标之一,是植物油常见的检测项目[1]。目前主要检测依据是GB5009.168-2016《食品安全国家标准食品中脂肪酸的测定》,该标准有3种方法,油脂脂肪酸组成检测一般采用第三法——归一化法。该标准给出了色谱参考条件,参考条件中规定了所用的毛细管色谱柱为:柱长100 m,内径0.25 mm,膜厚0.2 μm,固定相为聚二丙基硅氧烷,但没有规定强极性固定相的比例,实验室现有的3根强极性色谱柱的固定相与标准要求略有差异,使用这3种色谱柱分离37种脂肪酸甲酯混标,并以相邻2个脂肪酸甲酯色谱峰能完全分离(分离度大于1.5)为目标[2],优化色谱柱温条件,得到的色谱柱温条件使用已知脂肪酸含量的油脂对其进行结果准确性验证,以期为不同强极性色谱柱检测脂肪酸条件选择提供优化的思路,供相关人员参考。
1 材料与方法
1.1 试剂、材料与仪器
试剂:异辛烷、甲醇:色谱纯(默克),硫酸氢钠、氢氧化钾、无水硫酸钠:分析纯;37种脂肪酸甲酯混标(安谱),菜籽油脂肪酸质控样品(FATACID-JTZK-01),三种不同固定相的强极性色谱柱:①色谱柱HP-88:(88%-氰丙基)芳基-聚硅氧烷固定相,柱长100 m,内径0.25 mm,膜厚0.2 μm(美国产);②色谱柱CP-SIL 88:高取代氰丙基固定相,柱长100 m,内径0.25 mm,膜厚0.2 μm(美国产);③色谱柱MEGA-10:100%氰丙基聚硅氧烷固定相,柱长100 m,内径0.25 mm,膜厚0.2 μm(意大利产)。
仪器:具有氢火焰离子检测器气相色谱仪(美国产)。
1.2 方法
1.2.1 油脂样品甲酯化 2 mol/L氢氧化钾甲醇溶液:称取13.1 g氢氧化钾溶于100 mL无水甲醇中,加入无水硫酸钠过滤。
称取60 mg油脂样品,加入4 mL异辛烷涡旋30 s溶解,加入200 μL上述氢氧化钾甲醇溶液涡旋1 min后静置至澄清,加入1 g硫酸氢钠涡旋30 s中和氢氧化钾,静置澄清,取上清液过0.22 μm有机相滤膜过滤后进气相色谱[3]。
1.2.2 色谱条件 进样口温度:270℃;分流比:100∶1;进样体积:1 μL;检测器温度:280℃;检测器辅助气氢气流速:30 mL/min,空气流速:300 mL/min;载气:氮气。
柱温:程序升温先设置依据GB 5009.168-2016条件,如下:初始温度100℃,保持13 min;100℃→180℃,升温速率10℃/min,保持6 min;180℃→200℃,升温速率1℃/min,保持20 min;200℃→230℃,升温速率4℃/min,保持10.5 min。3种不同的色谱柱根据初始条件的分离情况进行适当调整优化。
2 结果与分析
2.1 HP-88柱温条件优化结果
通过对程序升温条件的优化,HP-88柱最终的柱温条件为:100℃保持4 min,12℃/min升温至180℃保持6 min,1℃/min升温至200℃保持15 min,8℃/min升温至230℃保持6 min。37种脂肪酸甲酯混标分离效果图谱见图1,各峰代表的脂肪酸、各峰的保留时间及峰宽见表1。当分离度R<1时,两峰有部分重叠,当1.0≤R<1.5时,分离度达到98%,色谱峰基本分离;当R≥1.5时,分离度可达99.7%,色谱峰完全分离[4]。经计算相邻两个峰的分离度最小值为2.1,均大于1.5,说明37种脂肪酸甲酯得到了有效的分离;完成所有组分的出峰分离时间约为61 min。
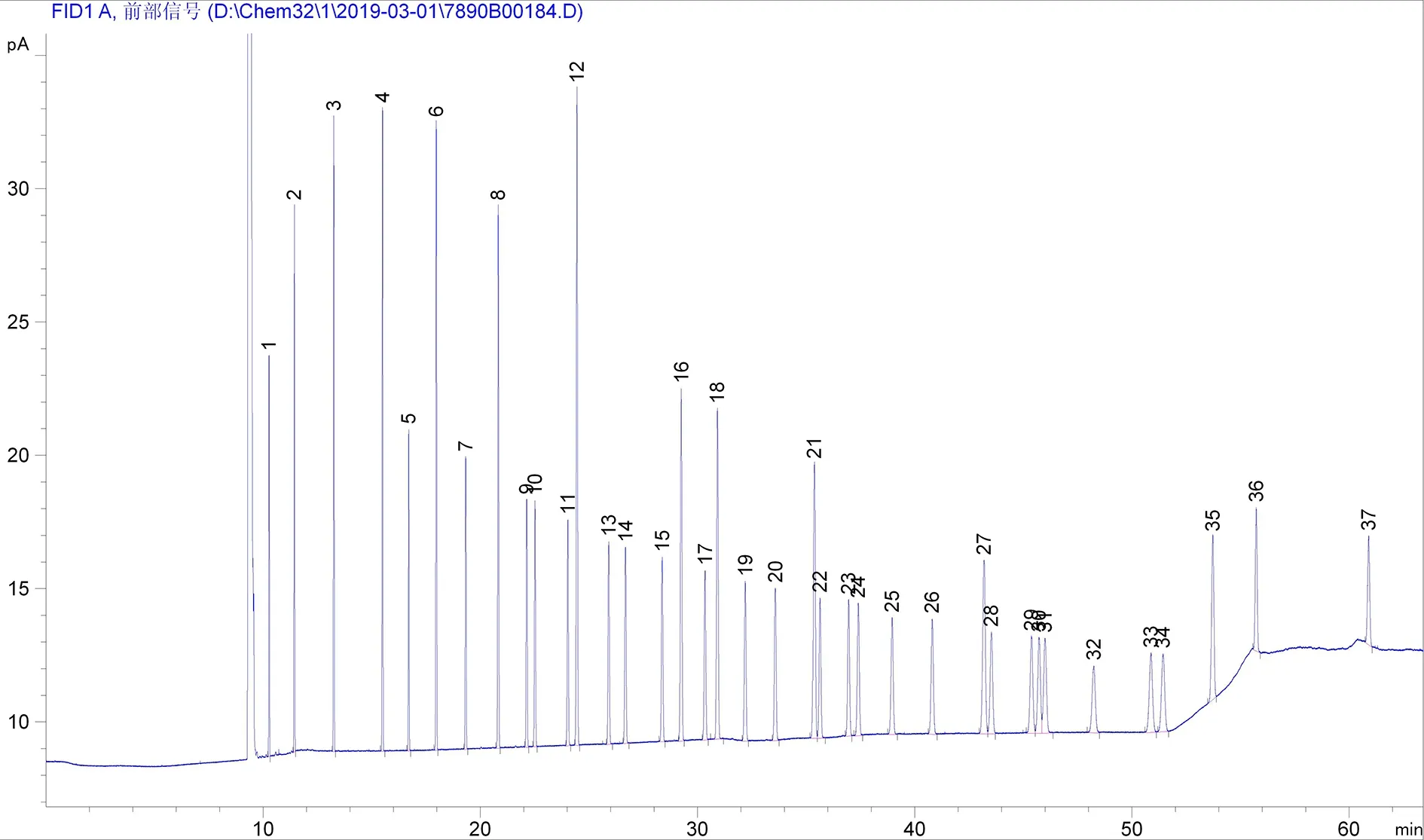
图1 HP-88柱温条件优化后分离37种脂肪酸甲酯色谱图
标准推荐的色谱柱固定相为聚二氰丙基硅氧烷强极性固定相,参考柱温条件下完成所有组分的出峰分离时间约为82 min,HP-88色谱柱固定相为(88%-氰丙基)芳基-聚硅氧烷,极性比标准参考略小,但改变柱温、升温程序以及升温速度等条件,可以改善混合标准品分离度[5-6],提前开始升温使分子量比较小的加快出峰,升温速率也适当增加,图中显示的各组分之间的分离度也是能满足要求的。

表1 HP-88分离37种脂肪酸甲酯分离情况
2.2 CP-Sil 88柱温条件优化结果
通过对程序升温条件的优化,CP-Sil 88柱最终的柱温条件为:100℃保持4 min,12℃/min升温至190℃保持6 min,2℃/min升温至210℃保持5 min,12℃/min升温至190℃保持10 min,8℃/min升温至230℃保持3 min。37种脂肪酸甲酯混标分离效果图谱见图2,各峰代表的脂肪酸、各峰的保留时间及峰宽见表2,经计算相邻的两个峰的分离度最小值为2.5,均大于1.5,说明37种脂肪酸甲酯得到了有效的分离;完成所有组分的分离出峰时间约为59 min。
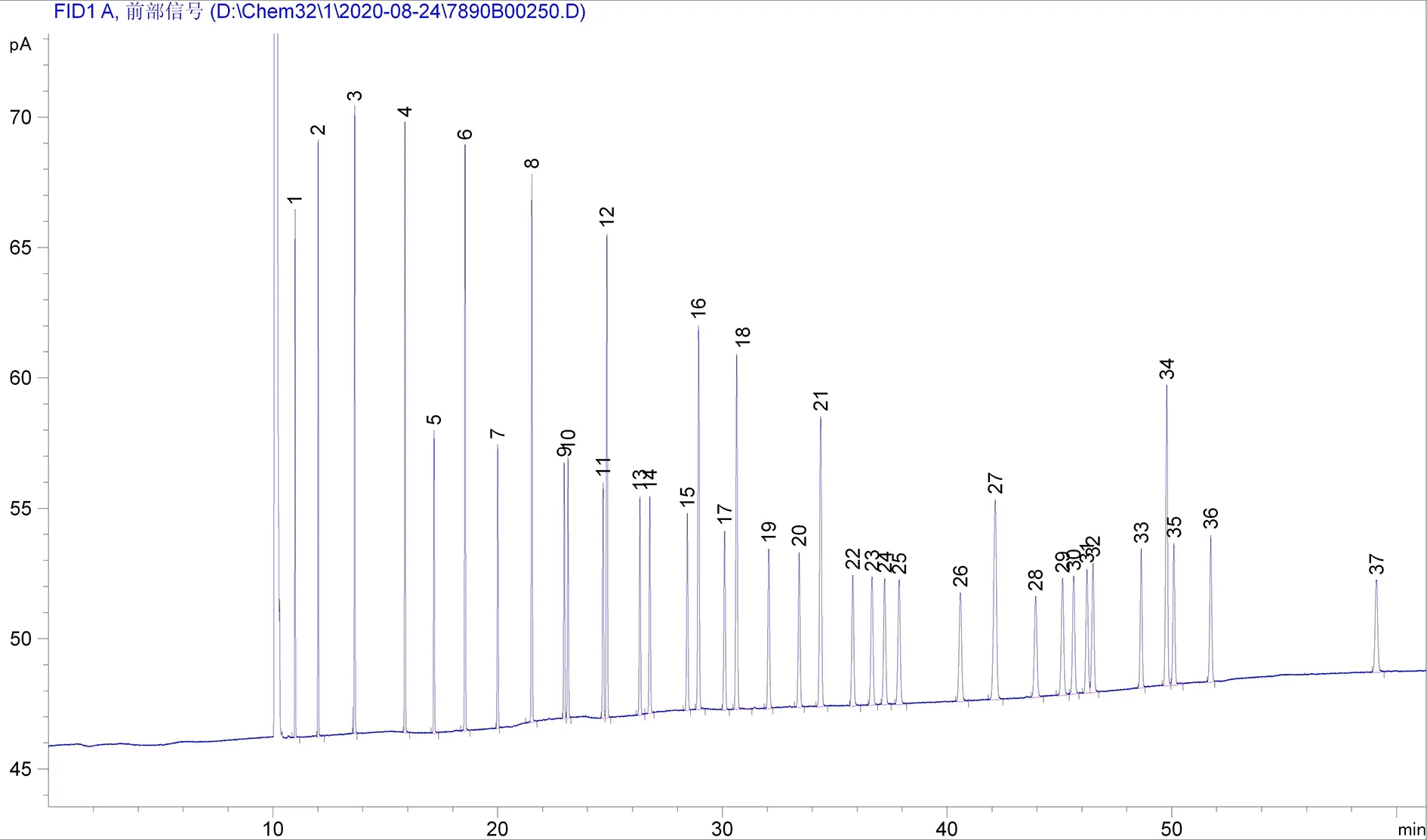
图2 CP-Sil 88柱温条件优化后分离37种脂肪酸甲酯色谱图
与HP-88色谱柱比较类似,CP-Sil 88并非100%纯强极性固定相,但对于脂肪酸具有极好分离效果,几种常见的顺反异构体都能较好的分离,检测时间相对于标准参考条件的也缩短很多,但C20:1、C22:1和C24:0的出峰顺序稍有差别。脂肪酸检测耗时较长,实验结果不仅要考虑是否得到较好的分离,检测时长、分离度等因素也是需要考虑的因素[7-8]。
2.3 MEGA-10柱温条件优化结果
通过对程序升温条件的优化,MEGA-10柱最终的柱温条件为:100℃保持4 min,12℃/min升温至190℃保持6 min,2℃/min升温至210℃保持5 min,12℃/min升温至190℃保持10 min,8℃/min升温至230℃保持3 min。37种脂肪酸甲酯混标分离效果图谱见图3,各峰代表的脂肪酸、各峰的保留时间及峰宽见表3,经计算相邻的两个峰的分离度最小值为2.3,均大于1.5,说明37种脂肪酸甲酯得到了有效的分离;完成所有组分的分离出峰时间约为50 min。

表2 CP-Sil 88分离37种脂肪酸甲酯分离情况
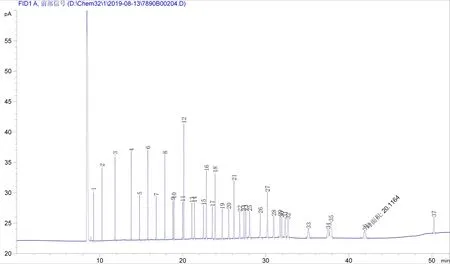
图3 MEGA-10柱温条件优化后分离37种脂肪酸甲酯色谱图

表3 MEGA-10分离37种脂肪酸甲酯分离情况
MEGA-10色谱柱固定相为100%氰丙基聚硅氧烷,相比前两种色谱柱固定相的极性更强一些,对37种脂肪酸甲酯这种复杂组分分离效果更好[9],选择的柱温升温条件与CP-Sil 88一致,全部组分完成分析的时间是本研究使用的3种色谱柱种最短的,比标准参照条件减少约30 min,有效提升了分析效率;另外MEGA-10色谱柱相比前两种色谱柱,使用成本方面还有一定的优势。
2.4 植物油样品测定
为进一步验证柱温条件优化的效果,选取一已知结果的菜籽油质控样品,分别采用HP-88、CP-Sil 88、MEGA-10三种不同的色谱柱进行检测分析,主要脂肪酸结果与标准值进行比较,如表4。
由表4可以看出,HP-88色谱柱检测结果与标准值的相对差值在-4.3%~2.0%,CP-SIL 88色谱柱检测结果与标准值的相对差值在-1.1%~5.5%,MEGA-10色谱柱检测结果与标准值的相对差值在-1.5%~7.1%,均符合GB 5009.168-2016中在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%的精密度要求,代入质控样计算Z值结果均小于2,说明3种色谱柱均能准确检测脂肪酸,方法有效[10]。
3 结论
按照GB 5009.168-2016的基础条件,选择HP-88、CP-Sil 88和MEGA-10强极性固定相色谱柱分离37种脂肪酸甲酯,虽然不同色谱柱本身的固定相不同,但均为强极性色谱柱且极性相似。通过对柱温条件的优化,使各脂肪酸甲酯色谱峰都能完全分离,分离度最小为2.1,均能满足完全分离的分析要求,分析时间相比标准中参考图谱都有一定程度的减少,有利于提升分析效率。CP-Sil 88分析个别脂肪酸甲酯的出峰顺序与其他两种色谱柱略有区别,使用3种色谱柱对菜籽油质控样品进行分析,不同脂肪酸甲酯检测结果与证书标准值差率最大分别为7.1%,能满足方法对于精密度的要求。本研究采用的3种品牌的色谱柱,通过对柱温条件优化,得出相对较好的分析条件、出峰顺序以及指纹图谱,可供其他使用者在进行植物油脂肪酸组成检测时参考。

表4 不同色谱柱检测脂肪酸质控样品结果比较 (单位:%)

