基于流式细胞仪鉴定菊芋倍性方法的建立及应用
赵孟良,任延靖,田闵玉,钟启文
(1青海大学 a农林科学院/青海省蔬菜遗传与生理重点实验室,b三江源生态和高原农牧业国家重点实验室,青海 西宁 810016;2 西北农林科技大学 园艺学院,陕西 杨凌 712100)
菊芋(HelianthustuberosusL.)又名洋姜、鬼子姜、姜不辣,属菊科(Composite)向日葵属(Helianthus)多年生草本植物[1],其起源于北美中部地区,在美国、加拿大和墨西哥等国家分布较多,我国大部分省区也都有分布[2]。菊芋通常以野生形式存在,是自然的同源或者异源六倍体,染色体数2n=102,具有天然的抗寒、抗旱、耐盐碱、耐瘠薄等优良特性。菊芋块茎富含菊粉(果聚糖),占干物质含量的80%以上,是一种良好的加工利用作物,其茎叶富含纤维素等营养物质,可作为家畜饲料的优质原料[3-4]。
倍性育种是利用人工诱发植物染色体数目变异的材料选育新品种或新种质的育种技术,可大大缩短育种年限。染色体作为遗传物质的载体,其重组常常会导致新种的出现并在一定程度上能够反映生物的本质[5]。倍性鉴定是倍性育种及其应用的重要环节[6]。传统的倍性鉴定方法主要依靠染色体计数法。杨柳慧等[7]采用染色体计数法对5个芍药属伊藤杂种进行核型分析,结果表明5个芍药属伊藤杂种均为三倍体(2n=3x=15),核型不对称系数为61.02%~62.41%,核型均属于2A型。何业华等[8]以根尖细胞为材料对5个黄皮品种实生苗进行倍性鉴定,结果显示它们均为二倍体(2n=2x=18),未发现随体、多倍和混倍现象。韩毅科等[9]采用染色体计数法对黄瓜的研究发现,与叶芽、茎尖相比,卷须更适合作为倍性鉴定的材料。郭启高等[10]以西瓜离体培养过程中的不定芽叶尖为材料,在显微镜下进行染色体计数,发现在培养早期可100%检测倍性。梁森林等[11]通过流式细胞术和染色体制片确定枇杷天然实生筛选株系B431为四倍体。染色体计数法操作过程比较复杂,工作量大,且本课题组前期试验结果显示,利用该方法对菊芋进行倍性检测效果并不明显。流式细胞仪(flow cytometry,FCM)是对细胞进行自动分析和分选的装置,自20世纪80年代以来得到较为广泛的应用,近几年来被普遍用于测试基因组大小和染色体倍性,是目前最高效、快速的倍性鉴定方法。其原理是根据物理、化学及生物学特性对细胞群进行定量分析、分选,将检测样本与标准二倍体细胞的荧光值相比较,进而推算出待检测样本的染色体倍性水平[12]。吕顺等[13]利用流式细胞仪快速准确地鉴定了169份香蕉种质资源的倍性。田路明等[14]利用流式细胞仪对260份梨种质资源染色体倍性进行了鉴定,结果表明供试的21份多倍体材料的倍性与前人鉴定结果一致,同时新发现9份三倍体种质。菊芋由于自交不亲和性,结实率低,实际生产中主要采用块茎进行无性繁殖。目前国内针对菊芋种质资源倍性的系统研究尚未见报道。本研究建立了基于流式细胞仪的菊芋倍性鉴定的方法,并用该方法对302份菊芋种质资源进行鉴定,以期为从细胞学层面了解菊芋及其遗传改良奠定基础。
1 材料与方法
1.1 材 料
1.1.1 供试材料 2个向日葵(HelianthusannuusL.,2n=2x=34)、18-c7和pL3白菜(Brassicarapa,2n=2x=20)、302份倍性未知的菊芋(见表1),由青海大学农林科学院菊芋研发中心提供。302份菊芋种质的来源为:中国140份、法国25份、美国45份、丹麦14份、泰国27份、以色列3份、加拿大1份,另外47份来源未知。将上述材料种植于青海大学农林科学院菊芋种质资源圃内,在盛花期取老叶、嫩叶、块茎和根等样品,备用。老叶选取距离顶端10片叶左右生长良好的叶片,沿叶脉处撕取叶片下表皮,备用;嫩叶选取部位为植株顶端顶芽处的幼嫩叶片;块茎选取顶芽下端3 cm处薯肉;根选取光照培养箱培养中产生的根尖。每个部位取3个混合样。
1.1.2 试剂及仪器设备 聚乙烯吡咯烷酮(PVP),分析纯级,天津市博迪化工股份有限公司产品;CyStain UV Precise P试剂盒,型号05-5002。Cyflow Plody Analyser型流式细胞仪(简称Cyfiow PA),希森美康医用电子(上海)有限公司产品。
1.2 流式细胞仪检测方法的建立
1.2.1 材料处理与检测方法 取0.1 g新鲜样品置于直径6 cm的一次性培养皿中,加入预冷的核裂解液200 μL,用锋利的双面刀片快速将样品切碎(5~10个样品后更换双面刀片),切碎过程中样品始终浸于核裂解液中。样品切碎后加入800 μL染色缓冲液孵育20 s,留样后加入40 g/L的PVP溶液1 mL,摇匀。将加PVP前后的样品用48 μm的细胞过滤器过滤至上样管中,用Cyflow Plody Analyser型流式细胞仪进行检测,每个样品收集3 000个以上细胞核。以细胞核DNA相对含量的荧光强度(RED-A)为横坐标,细胞核数量为纵坐标绘图。
1.2.2 电压的确定 根据流式细胞仪推荐的菊芋检测电压(340~440 V),设定不同梯度的电压(340,365.3和422 V)对加PVP前后的菊芋嫩叶进行检测,以确定菊芋检测的最适电压。
1.2.3 检测部位的确定 倍性鉴定过程中材料选择十分重要,不同部位材料的倍性检测效果不同。利用已筛选出的最优电压,对菊芋块茎、根、老叶、嫩叶加PVP的样品进行倍性检测,确定菊芋最适检测部位。
1.2.4 体系的稳定性试验 利用已经优化的菊芋倍性检测体系,分别以JA005菊芋、JA185菊芋、白菜18-c7、白菜pL3及2个向日葵的嫩叶为材料,进行体系稳定性检测。
1.3 菊芋倍性的鉴定
利用建立的方法对302份菊芋种质进行检测,以二倍体的向日葵作为对照,将待测样品与之比较,根据它们之间的关系,得出相应的菊芋染色体倍数。每个样品设置3组重复。
1.4 数据处理及分析
利用Flowjo 7.6软件进行数据分析,参考Doležel等[15]的方法进行菊芋染色体倍数分析。
2 结果与分析
2.1 流式细胞仪倍性检测方法的优化
2.1.1 检测电压的筛选 由图1可以看出,在电压为422 V时,检测图谱无明显主峰,且杂峰较多;在340 V电压下,检测图谱杂峰减少,但主峰偏离检测系统界面;调整电压为365.3 V时,检测图谱主峰能全部呈现,但伴有不显著的杂峰。由于菊芋组织中富含多酚类物质及多糖,仅通过调整电压无法完全排除杂峰的干扰,而PVP的作用主要是防止植物细胞中多酚类物质氧化,故本研究分析了样品处理时添加PVP对检测效果的影响,结果(图2)表明,添加PVP后在3种不同电压下杂峰均很大程度减少,其中以365.3 V下效果最优,主峰单一且无杂峰,便于后续统计分析。结果说明,365.3 V是流式细胞仪检测菊芋的合适电压。
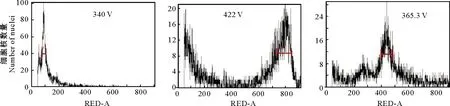
图1 不同电压下流式细胞仪法对菊芋倍性分析的检测效果
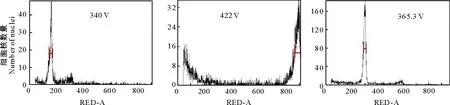
图2 添加PVP后不同电压下流式细胞仪法对菊芋倍性分析的检测效果
2.1.2 菊芋不同部位材料的筛选 利用已筛选出的最优电压,对添加PVP的菊芋块茎、根、老叶、嫩叶4个部位样品进行倍性检测,结果(图3)表明,菊芋不同部位样品检测图谱均可出现主峰,且无明显杂峰。对比不同部位样品的倍性检测效果发现,菊芋块茎中虽然细胞含量较高,但块茎中富含糖类及酚类物质,在主峰两边出现低微杂峰;菊芋根有主峰出现,但主峰位置偏移,且细胞含量较少;菊芋老叶中细胞新陈代谢速率缓慢,死亡细胞较多,同样在主峰两边出现不规律的轻微杂峰,且细胞含量较低;新鲜幼嫩菊芋叶片细胞含量较高,主峰单一且无杂峰。因此,菊芋新鲜幼嫩的叶片是倍性测定的理想材料。
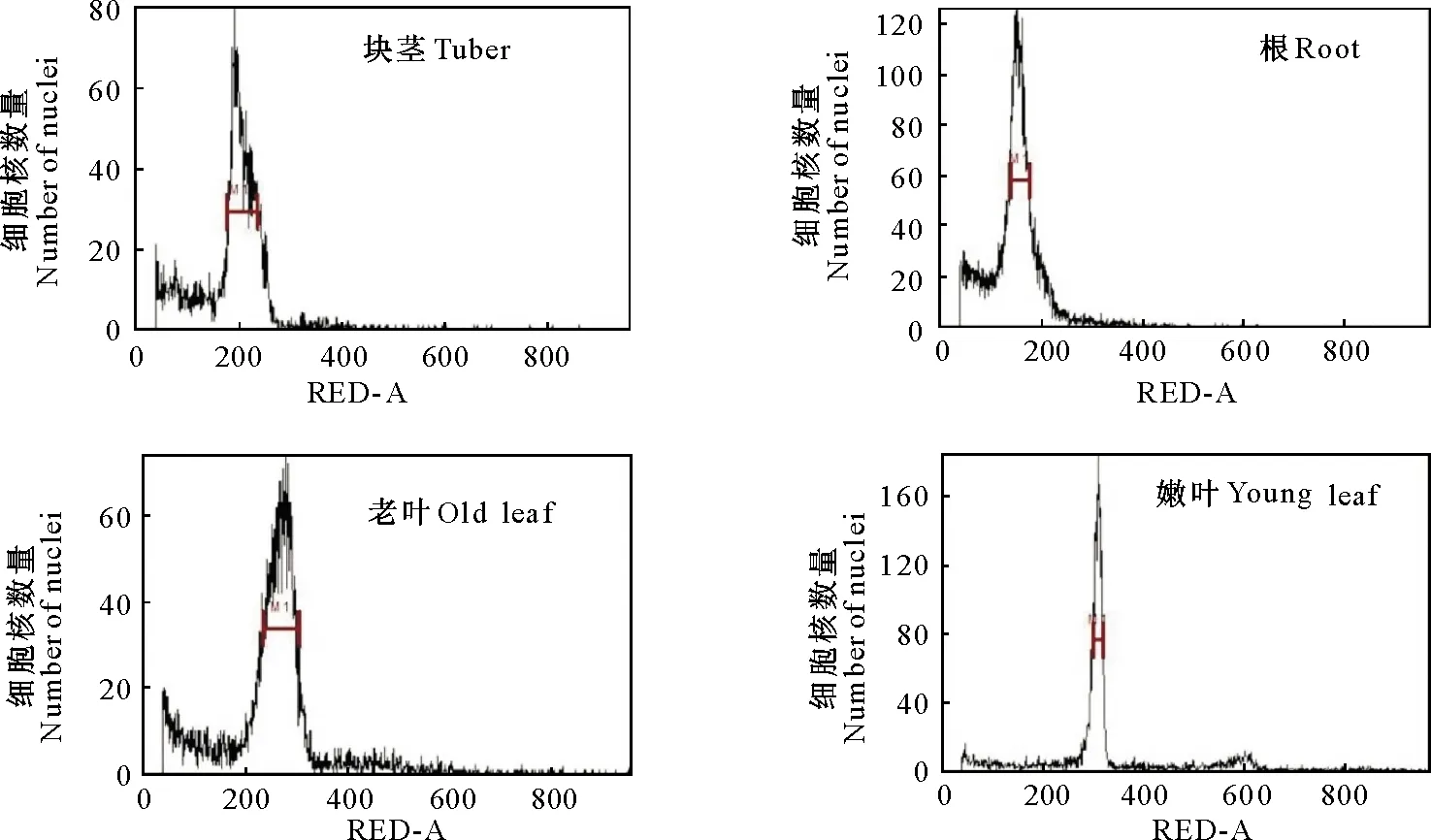
图3 流式细胞仪法对菊芋不同组织倍性的检测效果
2.1.3 优化体系的稳定性验证 利用已经优化的菊芋倍性检测体系,分别以菊芋JA005、JA185,白菜18-c7、pL3及向日葵的嫩叶为材料,进行体系稳定性检测,结果见图4。图4表明,该体系对菊芋倍性的检测效果稳定可靠;对已知倍性的白菜检测时出现了2个峰值,说明该体系并不适合白菜倍性的检测;对向日葵的倍性检测效果也较稳定。结果表明,针对不同科属的作物采用流式细胞仪进行倍性鉴定时,需要提前优化鉴定体系。

图4 流式细胞仪法检测菊芋倍性体系的稳定性评估
2.2 菊芋种质资源倍性检测
基于已优化出的菊芋倍性检测体系,以已知的二倍体向日葵为参照,对302份菊芋种质资源进行倍性检测及筛选。结果(表1)表明,302份菊芋资源倍性的整体变异系数为2.17~9.74,推导的倍性有二倍体、四倍体和六倍体,其中二倍体共3份,仅占资源总数的0.99%;四倍体共25份,占资源总数的8.28%;六倍体共274份,占资源总数的90.73%。
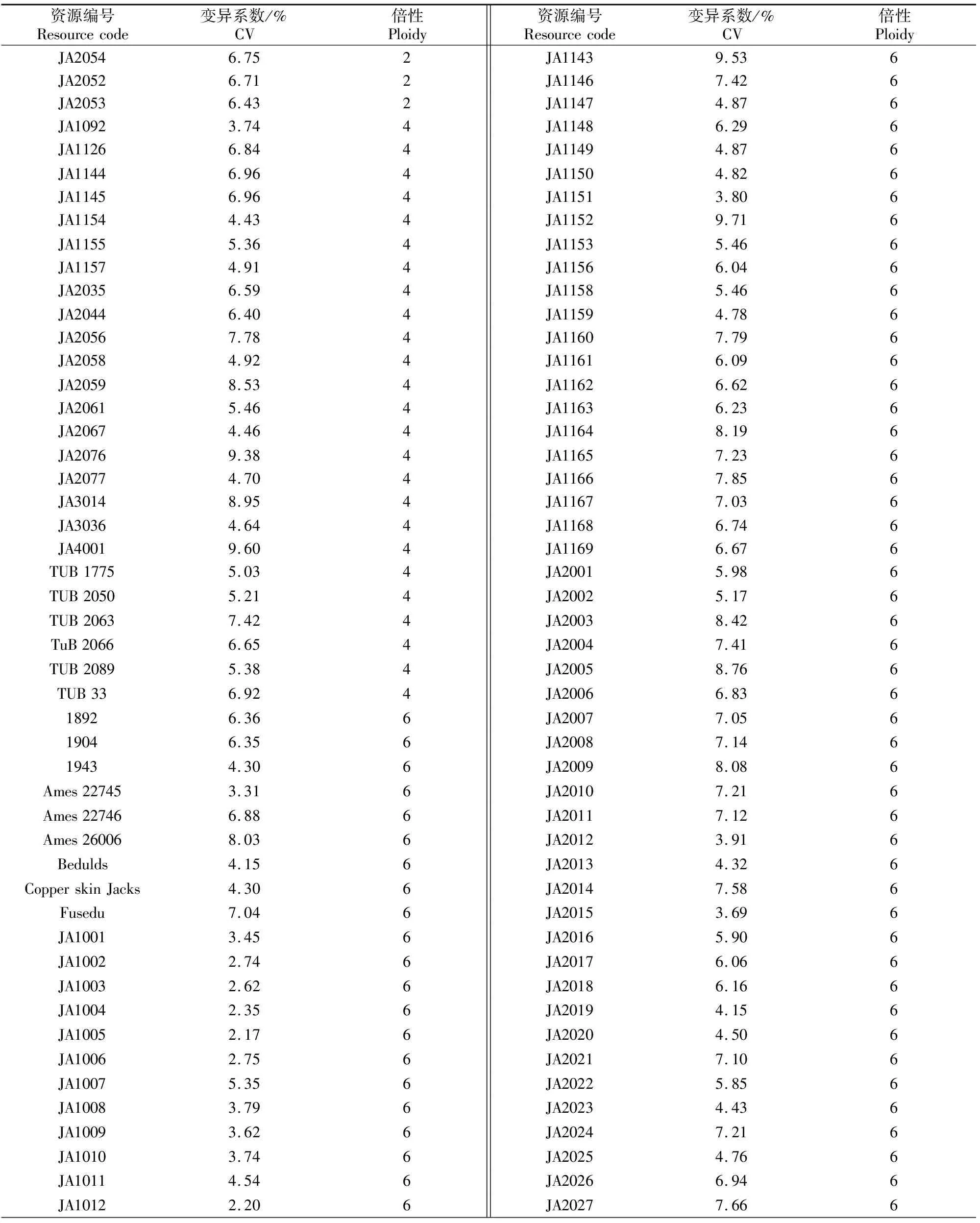
表1 流式细胞仪法对302份菊芋种质资源倍性的检测结果
3 讨 论
流式细胞仪能够对细胞的物理或化学性质,如细胞大小、细胞内部结构、染色体、RNA、蛋白质等进行快速检测并可分类收集。然而针对不同作物采用不同型号的流式细胞仪进行倍性检测时,需要对样品处理条件、仪器参数等进行优化,建立相应的检测体系。本研究采用Cyflow Plody Analyser型流式细胞仪,对菊芋倍性检测方法进行优化,结果发现不同电压处理对检测结果影响较大,电压过大主峰容易跑出检测界面,又可成为偏锋现象。偏锋现象是流式细胞仪检测中一种常见现象,属于检测误差。Farnham等[16]认为,样品荧光染色后放置的时间太长会导致偏锋现象出现,这种现象通过重复检测和缩短样品荧光染色后放置的时间有时可以消除[17]。
针对不同检测样品特性,为排除样品内源物质对检测结果的干扰,首先应明晰检测样本的特性,如菊芋组织富含酚类及糖类物质,对检测结果影响较大,而PVP是乙烯基吡咯烷酮通过自由基乙烯聚合反应得到的高分子均聚物,可用作片剂和颗粒剂药物的稳定剂。在菊芋倍性检测中添加PVP溶液,可有效抑制菊芋组织内干扰物质对检测效果的影响。
通过对比菊芋不同部位样品的倍性检测效果可知,不同部位样品在已优化的电压及添加PVP试剂下均能出现较好的结果,说明取材部位的不同对检测结果无显著影响,但考虑到菊芋块茎富含糖类及多酚类物质、老叶中死亡细胞较多、根中细胞数量较少等因素易对检测结果造成影响,故推荐选用幼嫩菊芋叶片作为菊芋倍性检测的首选材料。
在流式细胞仪实际操作过程中还应考虑到仪器型号及电压阈值的设定。电压阈值不是一个非常精确的数据,虽有经验值,但实际过程中应根据具体情况进行相应调节[18]。本研究按照流式细胞仪使用说明推荐的电压阈值进行设定后,发现对检测结果影响不大,故未再对电压阈值进行优化。流式细胞分析的对象是活细胞,若检测样品中死亡细胞较多,检测时仪器会将死亡细胞计入细胞总数,从而影响检测结果的可靠性。因此在样品实际处理过程中应尽可能缩短上样时间,研磨时要轻,以减少死亡细胞数量。
本研究选用向日葵和白菜对建立的菊芋倍性检测方法进行验证,选用向日葵是考虑到菊芋与向日葵同属于菊科向日葵属,亲缘关系较近,能够反映该方法在同科属作物中是否稳定;选用白菜主要是考虑在其他已知倍性的蔬菜作物上再次验证该方法的可靠性。
Georgiev等[19]认为,流式细胞仪检测的变异系数在9%以内,其检测结果比较可靠。本研究中302份资源的变异系数有291份均在9%以内,即97%的资源检测结果是有效的,也说明建立的菊芋倍性检测体系是可靠的。另外有9份菊芋资源倍性的变异系数在9%~10%,且部分2倍体的变异系数大于4倍体及更高倍性的变异系数,这与柳青慕等[20]的研究结果不同,推测认为菊芋种质资源中可能存在混倍体现象,这有待进一步深入研究。
4 结 论
建立了菊芋种质资源倍性流式细胞仪检测方法,该法检测条件为:选取幼嫩叶片为样品,样品处理时添加PVP溶液以消除多酚及多糖等物质的干扰,检测电压选用365.3 V;该法检测效果较好,准确性较高。302份菊芋种质资源倍性整体变异系数在2.17~9.74,二倍体共3份,仅占资源总数的0.99%;四倍体共25份,占资源总数的8.28%;六倍体共274份,占资源总数的90.73%。该体系的建立及菊芋种质资源倍性的明确为后续菊芋倍性育种奠定了理论基础。

