肠道菌群对半枝莲中活性成分的代谢及其抑制CYP1A1酶的影响
蒋家璐,孙溧,倪姐,徐坠成,宋蒙蒙,姚卫峰,程海波,康安,孙东东,3
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023;3.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023)
半枝莲为唇形科植物半枝莲ScutellariabarbataD.Don的干燥全草。其性味辛、苦、寒,归肺、肝、肾经,是一味常用的清热解毒药。半枝莲的主要活性成分为黄酮及二萜类化合物,具有抗肿瘤、抗炎、化学预防等多种药理作用,其中黄酮类成分如木犀草素、野黄芩素、汉黄芩素等具有确切的抗肿瘤作用及抗炎作用[1]。研究表明半枝莲中的黄酮类化合物中,苷类成分的含量显著高于其相应的苷元成分。而黄酮苷类成分在体内,可通过肠道菌群中的糖苷类水解酶对其进行水解,进而发挥其效应[2-3]。此外黄酮苷类成分的化学预防作用可能与其和体内药物代谢酶,尤其是CYP1A1酶的相互作用有关[4-5]。
CYP1A1是主要的细胞色素P450酶之一,其因参与多环芳烃(PAHs)代谢活化而受到广泛的关注[6]。PAHs暴露会诱导CYP1A1表达,而该酶又会将PAHs氧化代谢为具有遗传毒性的活性代谢物。目前,CYP1A1水平已成为环境和职业暴露于多环芳烃的生物标志物[7-9]。而当前的研究多采用多酚类物质来调控CYP1A1的表达起到化学预防的作用[5,10-11]。
基于半枝莲中富含黄酮类成分,且未见从肠道菌群角度研究其活性成分对CYP1A1酶抑制能力的影响,进而关联其潜在的化学预防作用。因此本实验首先通过液质联用的方法测定了半枝莲中的主要化学成分在肠道菌代谢前后的含量变化,并使用肠S9与CYP1A1特异性底物乙氧基试卤灵温孵,根据其产物试卤灵来判断半枝莲提取物及其活性成分对CYP1A1酶活性的影响。最后结合体外肠道菌群代谢的结果与酶活实验结果筛选出潜在的活性化合物并通过分子对接进一步验证化合物与CYP1A1之间的结合能力。本研究旨在为半枝莲能够防治或减缓CYP1A1介导的致癌物的代谢活化提供新的证据支持,为其在化学预防领域中的应用提供新思路。
1 材料
1.1 试剂
野黄芩素(批号:P23N4R1),野黄芩苷(批号:YY20110513),汉黄芩素(批号:P11M9F61014),木犀草素(批号:YY20110606),橙皮素(批号:HM0320KB14)购自上海源叶生物科技有限公司。汉黄芩苷(批号:H-019-170106)购自成都瑞芬思生物科技有限公司。木犀草苷(批号:1444/11017)购自上海诗丹德生物技术有限公司。半枝莲碱A(BBP00853),半枝莲碱B(BBP00826),半枝莲碱X(BBP00933)购自云南西力生物技术股份有限公司。所有对照品质量分数均大于98.0%。半枝莲药材(批号:190605)购自汕头市粤东药业有限公司。乙氧基试卤灵(批号:076M4129V)和试卤灵(批号:MKBT9342V)购自Sigma公司。BCA蛋白浓度测定试剂盒(批号:080719191118,碧云天生物技术有限公司),厌氧产气袋(批号:9354ZJ-3,日本三菱瓦斯化学株式会社)。乙腈,甲醇(色谱纯,德国默克公司),甲酸(色谱纯,阿拉丁试剂有限公司),纯水(实验室自制)。
1.2 仪器
MGC三菱密封培养罐(日本三菱瓦斯化学株式会社),ZWY-103B多振幅轨道恒温摇床(上海智城分析仪器制造有限公司),Milli-Q超纯水机(美国Millipore公司),微量高速冷冻离心机(美国Thermo Scientific公司),Speed Vac离心浓缩仪(美国Thermo Scientific公司),AB Sciex QTRAP 5500质谱仪(美国AB公司),LC20A快速液相仪(装有DGU-20A 3在线脱气机,LC-20AD XR泵,SIL-20A XR自动进样器及CTO-20AC柱温箱,日本Shimadzu公司),Spark 10M多功能酶标仪(瑞士Tecan公司)。
1.3 动物
清洁级SD大鼠,雄性,体质量220~250 g,购于杭州医学院。实验动物生产许可证号:SCXK(浙)2019-0002。
2 方法
2.1 半枝莲提取液的制备
取半枝莲药材粗粉约0.5 g,精密称定,放置于50 mL具塞锥形瓶中,精密加入甲醇20 mL,密塞,称定质量后超声30 min,放冷,再称定质量并用甲醇补足减失的质量,摇匀,过滤后于4 ℃保存。其中,野黄芩素、野黄芩苷、木犀草素、木犀草苷、汉黄芩素、汉黄芩苷、半枝莲碱A、半枝莲碱B、半枝莲碱X的含量分别为482.03、3 540.93、93.07、17.29、3.29、1.54、176.18、121.86、147.68 μg/g。在进行肠道菌温孵实验前,将提取液放置于离心浓缩仪中挥干(45 ℃),并用同体积的纯水超声复溶。
2.2 肠道菌群孵育液的制备
取新鲜大鼠粪便与无菌处理的PBS按质量体积比1∶40研磨制成混悬液,过3层纱布,混匀后得肠道菌孵育液。
2.3 体外温孵实验及样品处理
将2.1项下处理得到的半枝莲提取液与2.2项下制备的大鼠肠道菌孵育液以体积比1∶9混匀,分装于1.5 mL离心管中,每管500 μL。在厌氧状态下,将温孵的样品置于37 ℃气浴恒温摇床中,分别孵育0、0.5、1、2、4、6、12、24 h,每个时间点平行3份样品。在相应的时间点取出温孵的样品并立即加入500 μL冰乙腈终止反应,涡旋5 min,12 000 r/min离心10 min,取上清于4 ℃保存,100 μL上清溶液加10 μL内标混匀后挥干,加100 μL甲醇溶解离心后进样。
2.4 肠道菌温孵液中半枝莲8种活性化合物含量测定方法的建立
2.4.1 色谱条件 色谱柱:Thermo AcclaimTMRSLC 120 C18色谱柱(3.0 mm×100 mm,2.2 μm);柱温:40 ℃;流速:0.4 mL/min;进样量:2 μL;流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱程序:0~1 min,10%B;1~5 min,10~35%B;5~10 min,35%B;10~12 min,35~90%B;12~16 min,90%B;16~17 min,10%B。
2.4.2 质谱条件 电喷雾离子源(ESI);采用多反应检测模式(MRM)在正离子模式下检测;离子源喷雾电压(IS)5 500 V;离子源温度(TEM)550 ℃;气帘气(CUR)40 psi;雾化气(GS1)60 psi;辅助加热气(GS2)60 psi(1 psi=6.8948 Pa)。母离子及子离子信息如图1所示。
2.4.3 溶液的制备 混合标准品储备液:取野黄芩苷、木犀草苷、野黄芩素、木犀草素、汉黄芩素、半枝莲碱X、半枝莲碱A、半枝莲碱B对照品适量,精密称定,加甲醇溶解,配制成质量浓度分别为83.0、3.34、80.2、31.2、0.333、10.0、8.37、2.00 μg/mL的混合标准品储备液。
内标储备液:取橙皮素对照品适量,精密称定,加甲醇溶解,配置成质量浓度为1.70 mg/mL的内标储备液,临用前稀释成1.70 μg/mL的内标溶液。
肠道菌标准曲线及质控样品:将储备液稀释成系列标准溶液,肠菌液与系列标准溶液以1∶1的比例混匀,离心后取100 μL上清溶液加10 μL内标,挥干后用100 μL甲醇溶解离心取上清进样。低、中、高质控样品配制参照标准曲线配制的方法,其中野黄芩素的浓度分别为0.500、2.00、6.00 μg/mL,野黄芩苷的浓度分别为0.050、0.500、6.60 μg/mL,木犀草素的浓度分别为0.100、0.600、1.20 μg/mL,木犀草苷的浓度分别为0.002、0.020、0.270 μg/mL,汉黄芩素的浓度分别为0.002、0.020、0.050 μg/mL,半枝莲碱A的浓度分别为0.090、0.900、1.30 μg/mL,半枝莲碱B的浓度分别为0.020、0.100、0.300 μg/mL。半枝莲碱X的浓度分别为0.010、0.050、0.160 μg/mL。
2.5 肠S9的制备
取新鲜的肠黏膜加入4倍量的PBS匀浆,4 ℃,9 000×g,离心20 min得到的上清即为肠S9,检测肠S9的蛋白含量并分装保存于-80 ℃。
2.6 肠道菌与半枝莲共孵溶液的提取
以等体积的正丁醇及乙酸乙酯萃取在肠道菌中孵育0、0.5、1、2、4、6、12、24 h的半枝莲提取液,合并正丁醇及乙酸乙酯层并挥干,随后以甲醇复溶,离心取上清,每1 mL相当于原药材1 g。
2.7 CYP1A1活性检测(EROD)[12]
体外温孵体系包含氯化镁10 mmol/L,乙氧基试卤灵2 μmol/L,肠S9 0.24 mg/mL,NADPH 0.5 mmol/L。温度为37 ℃,反应时间为20 min,结束后立即加入等量冰乙腈,混匀离心后取上清100 μL加入到96孔板中。使用多功能酶标仪检测激发波长/发射波长535/590 nm处的值。
2.8 分子对接
配体野黄芩素,木犀草素,汉黄芩素的3D结构从PubChem获得,蛋白CYP1A1的3D结构(PDB:4I8V)从Protein Data Bank(PDB)获得[13]。CYP1A1对接盒子中心坐标设置为:center_x=-16.955,center_y=36.683,center_z=-28.371,盒子维度设置为:size_x=40,size_y=40,size_z=40。使用AutoDockTools 1.5.6和PyMOL1.7对小分子及蛋白质进行预处理。采用AutoDockTools 1.5.6进行分子对接,使用PyMOL1.7和Discovery studio 2019令结果可视化。
2.9 统计学方法
3 结果
3.1 方法学考察
3.1.1 专属性 取空白肠道菌,空白肠道菌加对照品和内标,样品溶液参照2.4项下方法检测,结果如图1所示,空白肠菌液(A)未出现与肠菌液加对照品和内标(B)中9种待测成分保留时间一致的色谱峰,样品溶液(C)未在相应位置出现其他干扰成分,表明该方法专属性良好。

注:A.空白肠道菌;B.空白肠道菌加对照品和内标;C.样品溶液
3.1.2 线性关系 参照2.3项下方法制备肠道菌系列标准溶液,记录样品中各化合物及对应内标的峰面积,以化合物质量浓度为横坐标(X),化合物与内标峰面积比值为纵坐标(Y),用加权(1/X)最小二乘法进行回归运算,分别求得各化合物的标准曲线方程如表1所示,结果表明各化合物在各自线性范围内线性关系良好。

表1 线性回归方程和相关系数
3.1.3 准确度和精密度 以低、中、高浓度的质控样品进行准确度与精密度考察,每个浓度平行6份,连续3 d进样。结果表明,野黄芩素、野黄芩苷、木犀草素、木犀草苷、汉黄芩素、半枝莲碱A、半枝莲碱B、半枝莲碱X的日内准确度分别为96.5%~100.9%、97.5%~102.6%、95.1%~100.8%、96.1%~99.9%、97.7%~101.3%、98.6%~102.2%、98.4%~104.6%、99.1%~103.4%,日间准确度分别为97.1%~102.1.3%、96.2%~102.3%、95.1%~101.4%、95.8%~102.7%、96.7%~101.2%、98.6%~100.5%、98.4%~103.6%、86.1%~100.9%,所有化合物的日内精密度均小于9.6%,日间精确度均小于11.2%。
3.1.4 回收率、基质效应和稳定性 低、中、高浓度肠道菌质控样品中化合物的峰面积为A,空白肠道菌样品经提取挥干后加入对应浓度的标准溶液测得的化合物谱峰面积为B,以“A/B×100%”计算回收率,结果表明野黄芩素、野黄芩苷、木犀草素、木犀草苷、汉黄芩素、半枝莲碱A、半枝莲碱B、半枝莲碱X和橙皮素的回收率分别为86.1%~96.3%、89.8%~96.8%、85.1%~92.1%、87.1%~90.7%、86.7%~98.4%、91.6%~98.2%、90.4%~99.6%、89.1%~97.9%和98.6%。
以6只大鼠肠菌液制备的基质样本和以流动相制备的无基质样本中目标化合物峰面积比值来考察基质效应(Matrix effect,ME)。结果表明野黄芩素(ME:90.8%~102.4%)、野黄芩苷(ME:90.3%~100.5%)、木犀草素(ME:91.9%~103.3%)、木犀草苷(ME:91.1%~99.2%)、汉黄芩素(ME:93.9%~102.1%)、半枝莲碱A(ME:95.0%~106.5%)、半枝莲碱B(ME:96.5%~103.4%)、半枝莲碱X(ME:94.1%~101.4%)和橙皮素(ME:95.6%)的基质效应均符合要求。
对低、中、高3个浓度质控样品进行稳定性考察(n=6)。各成分在室温放置4 h(准确度:82.5%~101.3%),经过3次冻融(准确度:87.9%~102.1%),进样室内放置24 h(准确度:82.2%~100.3%),-80 ℃放置1个月(准确度:85.4%~103.8%)稳定性良好。
3.2 半枝莲提取液经肠道菌转化前后主要化学成分的经时变化过程
含量测定结果见图2,半枝莲中的黄酮类化合物经过肠道菌的转化后含量变化较为明显,而二萜类化合物含量变化不明显。野黄芩苷、木犀草苷和汉黄芩苷这些黄酮苷的含量显著降低,在2 h内均降到了较低的水平,由于从样品中检测到汉黄芩苷较少,无法精确的定量,因此采用峰面积比值来反映其变化。另外,相应的苷元在肠道菌代谢后均发生了显著变化,总体呈增加的趋势。野黄芩素经肠道菌温孵4 h后含量增加6倍多,随后逐渐减少。木犀草素与汉黄芩素在孵育2 h后含量增至原来的2倍左右,随后无明显的增加或减少趋势。

图2 半枝莲肠道菌共孵育液中各化学成分的含量
3.3 半枝莲提取物经肠道菌代谢转化前后对CYP1A1酶活的抑制作用
图3结果显示,半枝莲提取液对肠S9中的CYP1A1酶活性具有一定的抑制作用,经过肠道菌转化2、4、6 h的提取液对酶的抑制作用较0 h点增强,但经肠道菌转化12、24 h后这种抑制作用减弱。结合前面的研究可知,在肠道菌中温孵2 h后,半枝莲中的黄酮苷含量普遍降低到较低水平,而相应黄酮苷元升高到较高水平,在代谢12、24 h后含量较高的野黄芩素含量逐渐减少,暗示半枝莲肠道菌温孵液对CYP1A1的抑制活性可能与其中的黄酮苷元的含量有关,特别是野黄芩素的含量。本实验测定了3对黄酮苷及其苷元对肠S9中CYP1A1酶活的影响,结果如图4所示,这3个黄酮苷元对CYP1A1的酶活抑制作用均强于其相应的黄酮苷。

注:与对照组比较,*P<0.05,**P<0.01;与0 h组比较,#P<0.05。

图4 半枝莲主要化学成分对CYP1A1酶的抑制作用
3.4 分子对接
本实验以野黄芩素、木犀草素及汉黄芩素作为配体分子对接至CYP1A1的催化活性空腔。配体与CYP1A1的结构和结合模式如图5所示,与先前发现的抑制剂α-萘黄酮与CYP1A1的相互作用一致,这些配体与CYP1A1的PHE224形成π-π堆积作用[13],此外,氢键、静电、范德华力等相互作用是复合物形成的主要驱动力。CYP1A1与各配体的结合自由能及相互作用的氨基酸残基列于表2中,这些相互作用都提示了野黄芩素、木犀草素和汉黄芩素与CYP1A1酶产生较强的结合。

表2 配体与人CYP1A1的结合能及相互作用
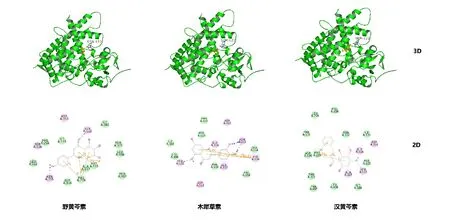
图5 野黄芩素、木犀草素和汉黄芩素与CYP1A1的分子对接图
4 讨论
CYP1A1参与外源性物质以及内源性物质的代谢清除,在脱毒和化学预防中起着重要的作用[14]。但其也因参与BaP和相关多环芳烃的氧化代谢而受到广泛关注。BaP存在于工业废气、汽车尾气、香烟烟雾以及熏烤油炸食品之中,是一种有毒、有害的五环芳烃类化合物。机体暴露于BaP会引起芳烃受体(AHR)的激活,激活的AHR从细胞质转移至细胞核中并与芳烃受体核转运子(ARNT)形成复合物,随后该复合物与异种生物反应元件(XRE)结合并诱导CYP 1家族成员特别是CYP1A1基因的高表达。CYP1A1酶促进BaP的代谢,加速致癌代谢物二羟环氧苯并[a]芘(BPDE)的产生,BPDE与DNA相互作用形成加合物造成DNA损伤,具有致癌、致突变的作用[15]。
肠道菌被称为“隐形的器官”,其对药物的代谢能力远强于肝脏[16]。肠道菌群可以代谢中药使其成分组成发生变化而改变其药理活性。本实验利用肠道菌温孵半枝莲提取物以模拟药物的代谢,建立UPLC-Q-TRAP-MS方法用于同时定量半枝莲中的主要活性成分在经过肠道菌转化后的含量变化,结果提示黄酮苷类化合物有可能发生了脱糖代谢而转化成相应的黄酮苷元。另外,考虑到肠道为口服半枝莲可以直接接触的部位,因此以肠S9作为酶体研究药物对CYP1A1酶活的影响。结合含量测定以及半枝莲中黄酮苷元及其苷的单体对CYP1A1酶活抑制作用的研究结果,我们推测半枝莲对CYP1A1的抑制作用与黄酮苷元的含量有关。最后将野黄芩素、木犀草素和汉黄芩素作为配体与CYP1A1蛋白进行分子对接,结果发现它们之间有较强的结合,由此推测这些苷元可能是通过与CYP1A1的活性位点结合而抑制CYP1A1酶的活性。
综上,本研究为半枝莲用于化学预防提供了一定的证据支持及研究基础。在实验中,野黄芩素、木犀草素和汉黄芩素已被验证对CYP1A1酶具有抑制作用,但无法排除一些代谢产物也对CYP1A1的抑制作用,这需要在以后的研究中对其进行评估。

