不同因素影响下棉田土壤中大丽轮枝菌微菌核的数量特征
刘海洋,王 伟,张仁福,温切木·阿布列孜,姚 举
(1. 新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;2. 阿勒泰市菜篮子工程办公室, 新疆阿勒泰836500)
0 引 言
【研究意义】2019年新疆棉花种植面积和产量均占全国的80%以上,多年的大规模连续种植,新疆棉花黄萎病发生严重。2015年阿克苏、石河子、乌苏等地黄萎病发生棉田均超过70%,全疆棉田发病率50%以上[1],已影响到优质棉基地的建设和棉花产业的长效发展。【前人研究进展】土壤中大丽轮枝菌Verticilliumdahliae的微菌核是棉花黄萎病的主要侵染源,微菌核数量与黄萎病的发生程度呈显著正相关[2]。微菌核抗逆性强,在40~50℃下处理24 h仍有部分微菌核存活[3],其主要聚集或均匀分布在0~20 cm的耕层中[4]。土壤温度、湿度、pH以及有机质含量能够影响微菌核的生长[5],偏碱性条件下,棉花黄萎病菌产生微菌核的能力较强,氯化物、硫酸盐能够促进微菌核的形成[6],棉花连作年限长土壤中微菌核数量会增加[7]。降低土壤中的微菌核数量是棉花黄萎病防控的重要措施,利用西兰花残渣或几丁质粉的生物熏蒸技术可降低棉花黄萎病的发生程度和土壤中微菌核的数量,该技术存在茬口难以匹配的现状[8];棉田深翻改土也能有效降低浅耕作层中的微菌核的数量,减轻黄萎病的发生程度[9]。Lpezescudero等[10]将Diplotaxisvirgata,Lavandulastoechas和Thymusmastichina制成有机改良剂施用,棉花黄萎病菌产生微菌核的能力显著降低,棉花黄萎病的发病程度得到了有效抑制。作物轮作倒茬是防控棉花黄萎病的主要农业措施。姚琴等[11]研究表明,韭菜根系分泌物能够明显抑制微菌核的萌发;但是,在实际作物轮作过程中,Huisman等[12]发现当土壤中存在一定数量的微菌核时,种植对黄萎病菌免疫的作物对微菌核的生存影响不大,且由于微菌核在土壤中自然减退率低,作物短期轮作对棉花黄萎病的防治意义不大;Borza等[13]同样发现,芥菜与棉花轮作未能降低土壤中黄萎病菌的丰度。【本研究切入点】除作物轮作与种植抗病品种外,棉花黄萎病的防治尚无有效的防控措施,并且现阶段对新疆棉区棉田不同环境土壤中微菌核的分布特征还不明晰。研究外界因素对土壤中微菌核数量的影响特征。【拟解决的关键问题】利用荧光定量PCR方法和选择性平板分离技术,大田试验与室内试验相结合系统分析棉田土壤中微菌核的自然分布特征以及棉稻间作、种植抗病性棉花品种、盆栽水淹等因素对土壤中微菌核数量的影响,分析外界因素对大丽轮枝菌微菌核分布的影响,为新疆棉花黄萎病的暴发成灾提供预测预警支持。
1 材料与方法
1.1 材 料
1.1.1 品 种
棉花品种:新疆农业科学院植物保护研究所提供的耐病品种中植棉2号、新陆中66号、以及感病品种军棉1号;中国农业科学院植物保护研究所提供的耐病材料K3、中5;水稻品种为新疆农业科学院核生物技术研究所提供的新稻11号,所有作物均于2018年4月18日种植。
1.1.2 土 壤
2018年分不同时期在农业部库尔勒作物有害生物科学观测实验站(E85.801821、E41.750644)内的棉花黄萎病病圃采集棉田10 cm耕层土壤,该病圃自2014年通过人工接种大丽轮枝菌建设而成,棉花黄萎病发生严重、均匀。
1.1.3 引 物
检测大丽轮枝菌的特异引物:大丽轮枝菌上游引物 5′-CGTTTCCCGTTACTCTTCT-3′,大丽轮枝菌下游引物5′-GGATTTCGGCCCAGAAACT-3′[14],由美国英杰生命技术有限公司合成。
1.1.4 试 剂
DCP336土壤基因组DNA提取试剂盒,天根生化科技(北京)有限公司;Cw0716 2×TaqMasterMix、Cw2591s Puc-TTAcloningkit,Cw0808s感受态细胞DH5α,北京康为世纪生物科技有限公司;RR82LR SYBR®PremixExTaqTMII (Tli RNaseH Plus)、ROXplus 、3427Q DL2000 DNA Marker,TaKaRa。
1.1.5 仪 器
QL-902涡旋振荡仪,海门市其林贝尔仪器制造有限公司;Centrifuge5415D离心机,Eppendorf;NANODROP 2000分光光度计,Thermo scientific;Tanon1600凝胶成像系统,上海天能科技有限公司;ABI7500 AppliedBiosystems荧光定量 PCR仪,ABI。
1.2 方 法
1.2.1 土壤中微菌核分离法效果
2018年在实验站病圃内均匀设置长度5 m小区,标准膜宽小区,随机设单种新稻11号(X11)、新陆中66号(X66)、军棉1号(J1)以及新稻11号+新陆中66号(X+X)套种4处理,没处理取5份土样。于7月10日采集实验站内各处理土壤并采集相邻轻病田土壤(LD)5份,利用荧光定量PCR技术检测土壤中大丽轮枝菌的基因拷贝数,利用选择性平板分离技术分析土壤中大丽轮枝菌的微菌核数量。
1.2.1.1 荧光定量PCR检测
提取土壤样本的基因组DNA,用大丽轮枝菌目的基因引物进行PCR扩增,回收PCR产物进行TA连接,利用菌落PCR鉴定阳性克隆后提取质粒作为绝对定量的标准品,之后将所有 DNA 样品分别配置 Realtime PCR反应体系,将质粒标准品从 101~105进行10倍梯度稀释,每个梯度取2 μL做模板建立标准曲线,将上述 96孔PCR 板置于Realtime PCR仪上进行 PCR反应。委托北京奥维森基因科技有限公司对2019年7月10日在实验站采集的轻病田(LD)、X11、Z49和X+Z以及J1处理的根际土壤样品利用绝对定量法检测土壤DNA中大丽轮枝菌的基因拷贝数,5个处理,每处理5个重复。
1.2.1.2 选择性平板分离
配制选择选择性培养基[15],称取3 g土壤样品用研钵研细,3份,分别放入盛有200 mL水的三角瓶中,加入少量玻璃珠,静置10 min,在200 r/min的摇床上摇30 min。然后倒入上层150 μm,下层38 μm的双层细筛,在自来水下将泥土冲洗干净。留在下层筛网上的土壤残留物全部转移到50 mL三角瓶中,用无菌水定容到30 mL。将定容好的土样液用移液枪每次均匀吸取2 mL,于改良微菌核选择分离培养基表面均匀涂布,接种5皿(接种前将三角瓶中的土样液充分摇匀),放在超净工作台上吹干,在28℃下黑暗培养10 d进行检查。每5皿的检验结果数目之和就是所测1 g土样中所含棉花黄萎病菌微菌核的数量,3次重复。
1.2.2 棉田土壤中大丽轮枝菌微菌核的数量1.2.2.1 棉田土壤中微菌核的区域分布特征
在病圃内均匀设置长度5 m,标准膜宽小区,横向5个处理,竖向4重复,共计20个小区。于5月20日每个小区采集1份土壤样品利用选择性平板分离方法检测,分析棉田不同区域土壤中的微菌核数量差异。
1.2.2.2 不同作物根围土壤中微菌核的数量
于7月10日、10月10日分别在1.2.1小节设计的X11、X66、X+X 三个处理,取种植不同作物的根际土壤,利用选择性平板分离方法检测土壤中微菌核的数量,每处理取6个土样,分析种植对大丽轮枝菌免疫作物后土壤中微菌核的数量差异。
1.2.2.3 不同抗病性棉花品种根围土壤中微菌核的数量
在病圃内随机种植中5(Z5)、K3、军棉1号(J1)3种不同抗病性的棉花品种,3重复,每处理取6个土样,于7月10日分别取各处理根围土壤,利用选择性平板分离方法检测土壤中微菌核的数量,分析不同抗病性棉花品种根围土壤中微菌核的数量差异。
1.2.3 室内盆栽土壤中大丽轮枝菌微菌核数量
取病圃内土壤混匀后进行室内盆栽试验,试验前土壤利用选择性平板分离方法检测4次,每次3个重复。选择直径22 cm,深20 cm的盆钵。
1.2.3.1 不同抗性棉花品种与水稻混种对土壤中微菌核的影响
设置5处理,其中单种中植棉2号(Z2)、军棉1号(J1)2处理各种植10粒;2个混种处理中植棉2号+新稻11号(Z+X)、军棉1号+新稻11号(J+X)各种植10粒棉籽和10粒稻种;空白对照(CK)不种植任何作物,共计5个处理,每处理3重复。种植90 d后采集各处理土壤,利用选择性分离培养基检测微菌核的数量,分析不同抗病性棉花品种以及与稻混种对土壤中微菌核影响。
1.2.3.2 水淹及种稻对盆栽土壤中微菌核影响
设水淹(W)、水淹+新稻11号(W+X)2处理,其中W+X处理每盆种植10粒稻种。每处理设10、20、30、60、150 d 5个时间梯度取土壤样品,每个时间梯度5个重复,定期取土样利用选择性分离培养基检测土壤中微菌核的数量。
1.3 数据处理
利用 Excel 软件对常规数据进行整理、汇总,利用 SPSS 19.0 软件的 ANOVA 程序中Duncan分析法对数据进行差异显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 土壤中微菌核分离法效果
研究表明,不同处理之间存在显著差异,其中在新陆中66号根围土壤DNA中大丽轮枝菌靶标片段基因的拷贝数最高,为2.01×106/μL,大丽轮枝菌基因拷贝数为2.41×108拷贝/g土,显著高于轻病田对照;新稻11号、新陆中66号、新稻11号+新陆中66号3个处理土壤中大丽轮枝菌基因拷贝数没有显著差异,军棉1号处理土壤中大丽轮枝菌基因拷贝数显著低于新陆中66号处理。
不同处理之间同样存在显著差异。新陆中66号处理土壤中大丽轮枝菌微菌核数量最高,为124.2个/g,显著高于轻病田对照,与新稻11号+新陆中66号处理无显著差异,与实时定量PCR检测结果基本一致。与实时定量PCR技术相比,选择性平板分离技术同样能准确的判断不同土壤中的大丽轮枝菌的丰度。表1
2.2 棉田土壤中大丽轮枝菌微菌核的数量
2.2.1 棉田土壤中微菌核的区域分布特征
研究表明,5月20日采集的20个小区土壤中微菌核数量最高的为59个/g,最低仅有14个/g平均为29.4个/g,其中微菌核数量高于或低于30个/g的土壤样本各10个,分别占50%,不同小区之间存在显著差异,棉田土壤中微菌核呈聚集分布。图1
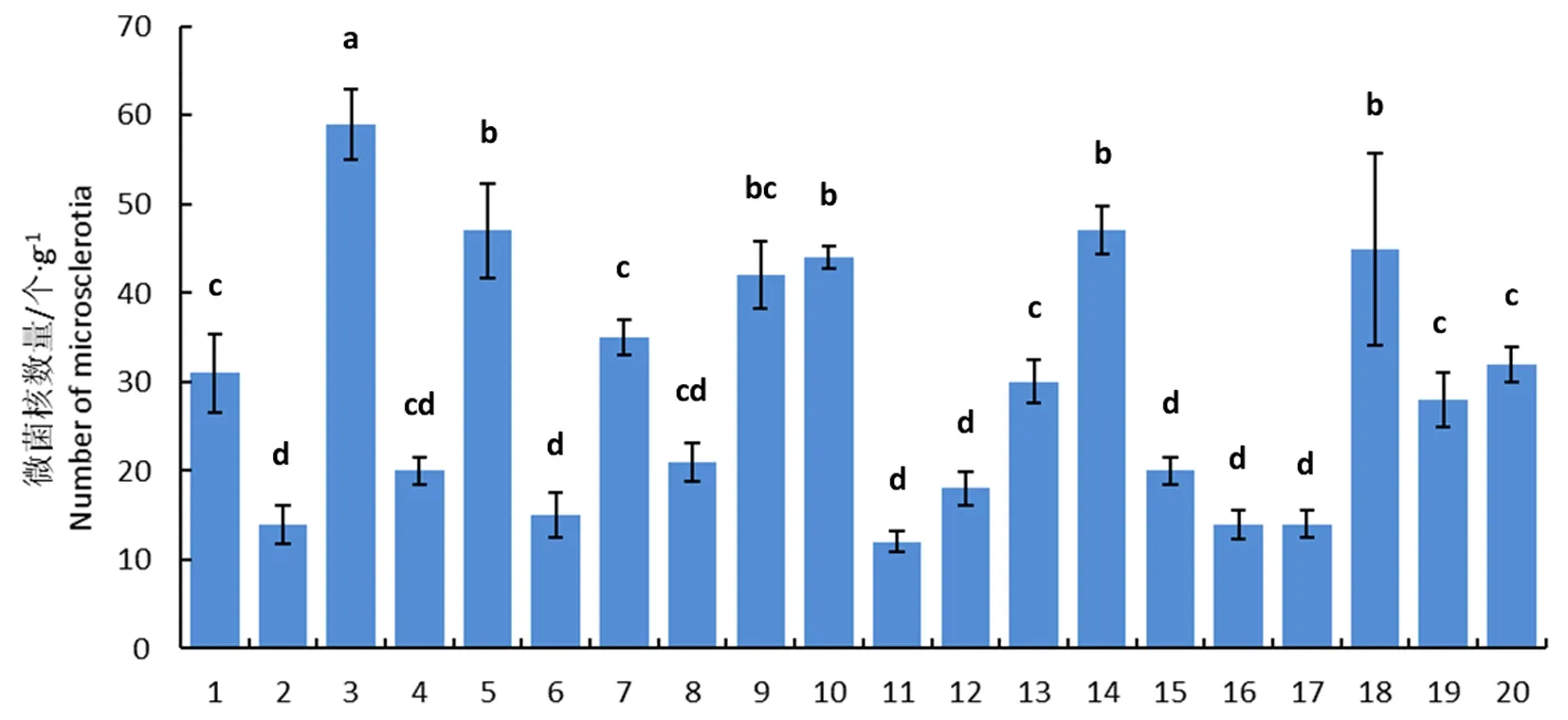
注:不同小写字母表示不同土壤样品中微菌核的数量差异显著(P<0.05),误差线表示平均值的标准误差(n=4),1~20代表不同的土壤样品编号
2.2.2 不同作物根际土壤中微菌核的数量
研究表明,7月10日,新稻11号根际土壤中微菌核数量平均为59.2个/g,新陆中66号根际土壤中微菌核数量为124.2个/g,新稻11号+新陆中66号处理土壤中微菌核数量为116.2个/g,新稻11号根际土壤中微菌核数量显著低于新陆中66号根际土壤,而新稻11号+新陆中66号处理与新陆中66号处理没有显著差异;与5月土壤相比,7月10日 新陆中66号、新稻11号+新陆中66号处理土壤中微菌核的数量均明显上升,分别增加了94.8和87.2个/g,新稻11号根际土壤中微菌核数量仅增加了29.8个,种植水稻明显减缓了土壤中微菌核的上升速度。
至10月10日,3个处理土壤中微菌核数量分别为98.3、92.5和101.2个/g,处理之间没有显著差异。与7月10日相比,新稻11号+新陆中66号处理与新陆中66号处理土壤中微菌核数量略为减少,而新稻11号根际土壤中微菌核数量增加了33.3个/g。生长后期,水稻对土壤中微菌核生长的抑制能力减弱。图2
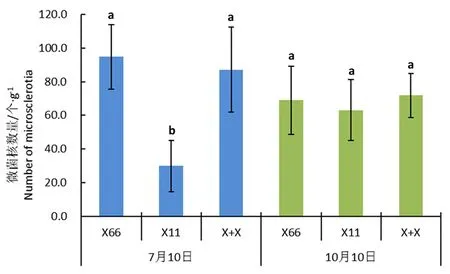
注:X66:新陆中66号,X11:新稻11号,X+X:新稻11号+新陆中66号不同小写字母表示不同土壤样品中微菌核的数量差异显著(P<0.05); 误差线表示平均值的标准误差(n=6)
2.2.3 不同抗病性棉花品种根围土壤中微菌核的数量
研究表明,5月20日,感病品种军棉1号根围土壤中微菌核含量为48.3个/g;耐病材料中5根围土壤中微菌核含量为40.0个/g,低于感病品种军棉1号;而耐病品种K3根围土壤中微菌核含量为69.3个/g,高于感病品种军棉1号。
7月10日,感病品种军棉1号根围土壤中微菌核含量为53.8个/g,较5月20日增加5.5个/g;耐病品种中5与K3根围土壤中微菌核含量分别为56.3和65.7个/g土,分别高于感病品种军棉1号2.5和11.9个/g;相比5月20日,耐病品种中5根围土壤中微菌核数量增加16.3个/g土,而耐病品种K3根围土壤中微菌核数量减少3.6个/g。
棉花根围土壤中微菌核的数量与棉花品种的抗病性无明显相关。图3
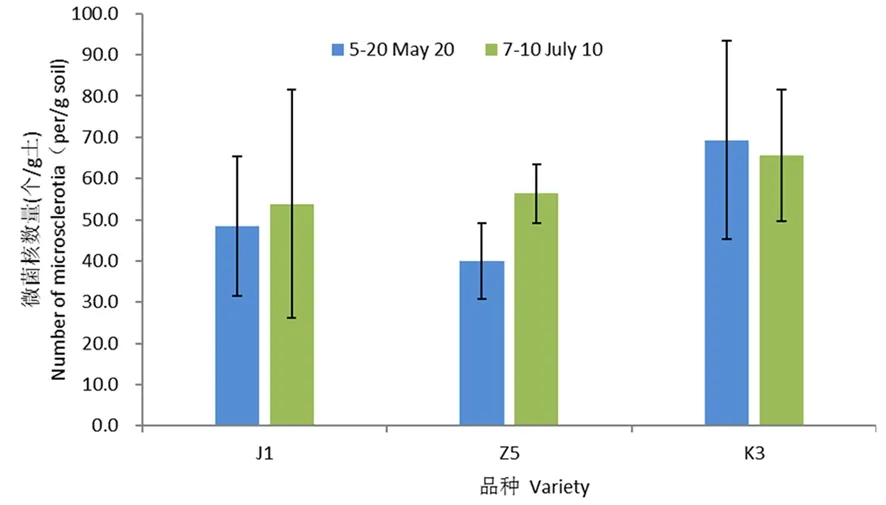
注:J1:军棉1号;误差线表示平均值的标准误差(n=6)
2.3 室内盆栽验证不同处理方式对土壤中微菌核的影响
2.3.1 不同抗性棉花品种与水稻混种对土壤中微菌核的影响
研究有明,盆栽试验前土壤中微菌核的数量为47.4个/g。出苗90 d后,空白对照土壤中微菌核的数量为57.0个/g,较盆栽前略为升高;与空白对照相比,耐病品种中植棉2号根际土壤中微菌核数量为57.3个/g,2处理之间无显著差异;感病品种军棉1号根际土壤中微菌核数量为35.3个/g,与空白对照相比下降11.7个/g。感病品种军棉1号根际土壤中微菌核数量较耐病品种低。
与新稻11号混种后,中植棉2号+新稻11号混种处理土壤中微菌核的数量较单种中植棉2号处理减少12.3个/g,而军棉1号+新稻11号混种处理土壤中微菌核数量较单种军棉1号处理增加17.4个/g。与稻混种后土壤中微菌核数量的变化没有表现出一致规律。图4
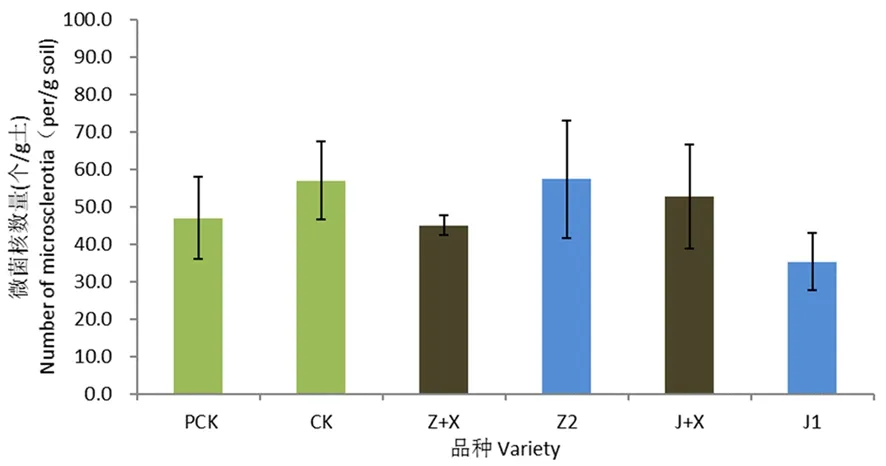
注:PCK:试验前对照,CK:同期对照,Z:中植棉2号,J1:军棉1号,Z+X:中植棉2号+新稻11号,J+X:军棉1号+新稻11号,误差线表示平均值的标准误差(n=3)
2.3.2 水淹及种稻对盆栽土壤中微菌核的影响
研究表明,水淹10 d后,纯水淹处理土壤中微菌核数量为47.7个/g,与试验前土壤中微菌核的数量47.4个/g土相比,无明显变化;20 d后,空白对照土壤中微菌核数量显著上升至121.7个/g;至30 d,空白土壤中微菌核数量显著上升至231.7个/g;至60 d,空白土壤中微菌核数量下降至193.3个/g;至150 d后,微菌核数量又恢复上升至239.0个/g。水淹后土壤中微菌核的数量显著增加。
新稻11号水淹处理土壤中微菌核的消长动态与空白对照一致,同样表现为迅速升高继而降低再升高的趋势。2处理在0~20 d时土壤中微菌核含量没有显著性差异;至30 d时,新稻11号水淹处理土壤中微菌核数量为347.0个/g,显著高于空白对照,至60 d时,微菌核数量降至155.0个/g,低于空白对照;至150 d时,新稻11号水淹处理土壤中微菌核数量显著升高至385.7个/g。
室内盆栽条件下,水淹显著促进了土壤中微菌核数量的增长,种植水稻未能抑制土壤中微菌核的增长。图5
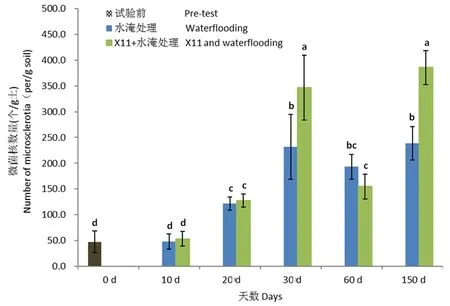
注:不同小写字母表示不同土壤样品中微菌核的数量差异显著(P<0.05), 误差线表示平均值的标准误差(n=5)
3 讨 论
微菌核是大丽轮枝菌在土壤中的主要存活体,其在土壤中主要呈聚集或均匀分布[4]。对棉田土壤中的大丽轮枝菌进行定量是对黄萎病预警、合理进行品种布局预防棉花黄萎病的基础[16]。目前检测土壤大丽轮枝菌主要采用实时荧光定量技术[17]和选择性平板分离的方法,其中荧光定量技术具有精准的优势。因为在轻病田中利用实时定量PCR技术检测到的大丽轮枝菌基因拷贝数量级很高。研究发现,选择平板分离技术对棉田中微菌核的检测准确度很高,具有分离到病原菌以便进行后续研究的优势,该方法在区分轻病田与重病田方面更明显。库尔勒实验站棉花病圃内大丽轮枝菌微菌核在土壤中呈聚集分布,不同采样点微菌核的数量存在显著差异,由于该病圃建设年限仅5年,土壤中微菌核分布不均匀可能与病圃的建立年限较短有关。
Knox等[18]研究表明,不同棉花品种与根际土壤微生物的相互作用存在差异,抗、感黄萎病棉花品种间根际微生物种类存在明显不同[19],抗病品种根际土壤中枯萎菌数量明显少于感病品种[20];Huisman等[12]研究表明,感病棉花品种能刺激微菌核增长,继续种植抗病品种时土壤中微菌核数量会继续增多,吴玉香等[21]认为抗病棉花品种根系分泌的精氨酸可能抑制黄萎病菌的生长发育,而感病品种根系分泌的丙氨酸刺激黄萎病菌的生长。同块棉田中采集的不同抗病性棉花品种根围土壤中微菌核的数量与棉花品种的抗病性无明显相关,甚至感病品种根围土壤中微菌核数量低于抗病品种,盆栽试验结果与大田结果较一致,可能棉花的根系分泌的物质影响范围有限,不能对棉花根围土壤的微生态环境造成明显影响,抑或由于感病品种军棉1号后期发病死亡,根系停止分泌化感物质到土壤中,对根围土壤中微菌核的刺激降低所致。
不同作物对土壤中微生物群落多样性的影响具有显著差异[22]。研究发现,水稻根系分泌物能有效抑制尖孢镰刀菌孢子萌发,对土壤中西瓜枯萎病致病菌具有抑制作用[23]。苏世鸣等[24]发现西瓜间作旱稻可显著降低西瓜根际土壤中的尖孢镰刀菌的数量。此外,玉米、莴苣的根系分泌物同样能够抑制尖孢镰刀菌的生长[25];拟南芥的根系分泌物能够抑制多种土传病原菌的生长[26]。作物轮作在防治土传病害方面具有天然的优势,生产中同样利用水旱轮作的方式来防治棉花土传病害。研究了旱稻与棉花间作对土壤中大丽轮枝菌微菌核数量的影响作用,研究发现,在大田中,前期种植旱稻能够减缓了土壤中微菌核数量的增长速度,但后期对微菌核没有抑制作用;室内盆栽同样发现旱稻与不同抗病性棉花混种没有降低土壤中微菌核的数量,尤其是在水淹的条件下,稻-棉混种的土壤中微菌核的数量显著增加,这可能与微菌核极强的抗逆性有关,该结果与Huisman[12]、Borza[13]的研究结论较为一致。
利用不同作物间作、轮作是防治土传病害的主要措施。研究发现,短期内,种植不同抗病性棉花品种抑或对大丽轮枝菌免疫的稻均对土壤中微菌核的生存均没有显著影响,而土壤长时间湿度大的情况下,稻-棉间作促进了土壤中微菌核的增长,该结果有待进一步验证。杨家荣等[5]研究发现在高湿、密闭条件下土壤中微菌核存活数量显著降低,可能与土壤通气状况不佳导致病菌缺氧呼吸有关。而研究发现在开放、盆栽水淹条件下,土壤中微菌核数量显著增加,从侧面证实了杨家荣等[5]土壤通气状况不佳导致病菌缺氧影响微菌核存活的结论。新疆棉田长年连作并秸秆还田导致了病原菌的加速积累,马云艳等[27]研究发现将棉秆炭化还田具有改善土壤理化性质并从源头阻止黄萎病菌在土壤中积累的优点。薛磊等[6]研究发现偏碱性条件能增强棉花黄萎病菌产生微菌核的能力,而新疆棉田土壤多为偏碱性,这是否为新疆棉田中微菌核数量逐渐增多的原因值得分析。
4 结 论
棉田土壤中大丽轮枝菌难以通过作物单生长季内轮作有效消除,大丽轮枝菌微菌核在棉田土壤中呈聚集性不均匀分布,土壤中大丽轮枝菌微菌核的数量与棉花品种抗病性无明显相关。7月旱作水稻、棉花根际土壤中微菌核分别为59.2和124.2个/g,旱作水稻显著低于棉花,10月旱作水稻、棉花根际土壤中微菌核分别为92.5和98.3个/g,2处理之间已无显著差异,种植旱稻生长前期能延缓棉田土壤中大丽轮枝菌微菌核的增长,生长后期对微菌核的影响能力降低。水淹30 d时土壤中大丽轮枝菌微菌核的数量显著上升至231.7个/g,至60 d土壤中微菌核数量略下降,至150 d时微菌核数量升至239.0个/g,是初期微菌核数量的5倍;种稻处理土壤中微菌核的消长动态与水淹处理一致,至150 d时微菌核数量385.7个/g是初期的8倍,水淹显著促进土壤中微菌核数量的增长,水淹条件下水稻未能抑制土壤中微菌核数量的增长。

