γ-聚谷氨酸对大豆分离蛋白热稳定性的影响
齐 蕾 仵心军 徐 超,2 张波波 沈 玥 艾志录,2 谢新华,2
(河南农业大学食品科学技术学院1,郑州 450002) (农业农村部大宗粮食加工重点实验室2,郑州 450002) (郑州市食品药品检验所3,郑州 450006)
大豆分离蛋白(soybean protein isolate,SPI)是大豆中主要的蛋白成分,与大多数谷物蛋白相比,含有人体必需的八种氨基酸,是一种优质的植物蛋白,在食品工业中应用广泛[1]。在实际生产中,干热处理会使蛋白发生一定程度的变性,不利于蛋白功能性质的保持[2,3]。有很多研究通过蛋白质与聚电解质的静电复合来抑制蛋白受热后变性聚集的现象,提高蛋白的热稳定性。Jones等[4]研究发现,热处理后β-乳球蛋白与果胶的复合物在广泛的pH内均具有良好的稳定性;Xiong等[5]通过对卵白蛋白-羧甲基纤维素热诱导的凝胶行为分析,发现随着羧甲基纤维素添加量的增大,热处理后的卵白蛋白的聚集体逐渐消失;Chang等[6]的研究结果也表明,添加壳聚糖提高了油菜分离蛋白的峰值变性温度和变性焓值,提高了蛋白的热稳定性。
γ-聚谷氨酸(γ-polyglutamic acid, γ-PGA)是一种由D-或L-谷氨酸通过α-氨基和γ-羧基形成γ-酰胺键结合而成的阴离子聚电解质,具有良好的水溶性、增稠性、保水性及可食用性,在食品工业中应用广泛[7,8]。在pH 3.5时SPI与γ-PGA带有相反的电荷,可形成较多静电复合物,为提高大豆分离蛋白的热稳定性,本文在此条件下对不同浓度及不同水浴加热时间下复合物的浊度值、粒径、ζ-电位以及蛋白表面疏水性进行测定,分析γ-聚谷氨酸对大豆分离蛋白热稳定性的影响,为γ-聚谷氨酸在酸性大豆分离蛋白溶液中的应用提供理论依据。
1 材料与方法
1.1 实验材料
大豆分离蛋白(蛋白质量分数为90%)、γ-聚谷氨酸(食品级)、8-苯氨基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS);盐酸(HCl)和氢氧化钠(NaOH)均为分析纯。
1.2 仪器与设备
5430R型高速冷冻离心机,752型紫外可见光分光光度计,LS 13 320型激光衍射粒度分析仪,Zetasizer Nano S90型电位仪,Lumina型荧光分光光度计。
1.3 方法
1.3.1 SPI溶液与γ-PGA复合体系的制备
将SPI和γ-PGA粉末分别溶于蒸馏水中,在室温下搅拌2 h,得到质量浓度为10 g/L 的SPI溶液和γ-PGA溶液作为储液[9]。分别取合适体积的SPI和γ-PGA储液混合,用蒸馏水稀释至所需浓度,使大豆分离蛋白的质量浓度恒定为5.0 g/L,γ-PGA的质量浓度分别为0.5、2.0、5.0 g/L,制备完成后用2 mol/L的HCl以及NaOH调节复合溶液的pH值至3.5。
1.3.2 水浴加热过程
将复合溶液于80 ℃下进行水浴加热,加热时间分别为1 min(T1),2 min(T2),3 min(T3)和 4 min(T4)。将未经加热的复合物(T0)作为对比[10]。
1.3.3 浊度的测定
将制备好的不同浓度的样品摇匀,取2 mL样品倒入比色皿中,用蒸馏水作为空白对照,使用分光光度计于600 nm处测定其吸光度值,测定温度为25 ℃[11]。
1.3.4 粒径的测定
复合物的粒径大小使用Beckman Coulter激光粒度分析仪在室温下进行测定,采用通用液体模块,设置运行长度为60 s,由3个独立样品的3次进样计算出体积加权平均直径D[4,3][12]。
1.3.5 ζ-电位的测定
采用Malvern Nano ZS 90对复合体系的ζ-电位进行测定,选择电位测量模式,将复合溶液放入测量池中进行测定,分散介质选择为水,样品平衡时间为120 s,测定温度为25 ℃[13]。
1.3.6 表面疏水性的测定
使用ANS荧光探针法测定蛋白表面疏水性。将制备好的不同浓度的样品在4 000 r/min的速度下离心20 min,其上清液用pH 3.5的蒸馏水稀释,并使用Lowry法测定稀释后上清液中蛋白质的质量浓度,使之达到0.07~0.67 mg/mL之间。取稀释后的样品4 mL,加入50 μL 8 mmol/L 的ANS溶液,将其充分混匀后静置10 min,在330 nm的激发波长和490 nm的发射波长下测定其荧光强度,狭缝设置为5 nm。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性[14]。
1.4 数据分析
每组样品重复3次测量,使用SPSS16.0对所得数据进行统计分析,用Origin8.0进行绘图。
2 结果与分析
2.1 SPI-γ-PGA复合物的浊度分析
由图1可知,水浴加热前随γ-PGA质量浓度从0.5 g/L提高至5.0 g/L,复合物浊度值由1.91显著增加至2.43,但结合图2中复合物粒径变化情况可知,随着γ-PGA的增加,复合物的粒径在γ-PGA质量浓度为2.0 g/L时达到峰值,而当质量浓度比为5.0 g/L时粒径减小至1.68μm。其原因可能是随着γ-PGA的增加, SPI分子可以结合越来越多的γ-PGA分子,并使之形成复合物,其浊度值及粒径增大,但当带有大量负电荷的γ-PGA持续增加时,复合体系中静电斥力增大,形成了相当数量粒径较小的复合物,因此复合物的粒径减小但浊度值并未降低[15]。
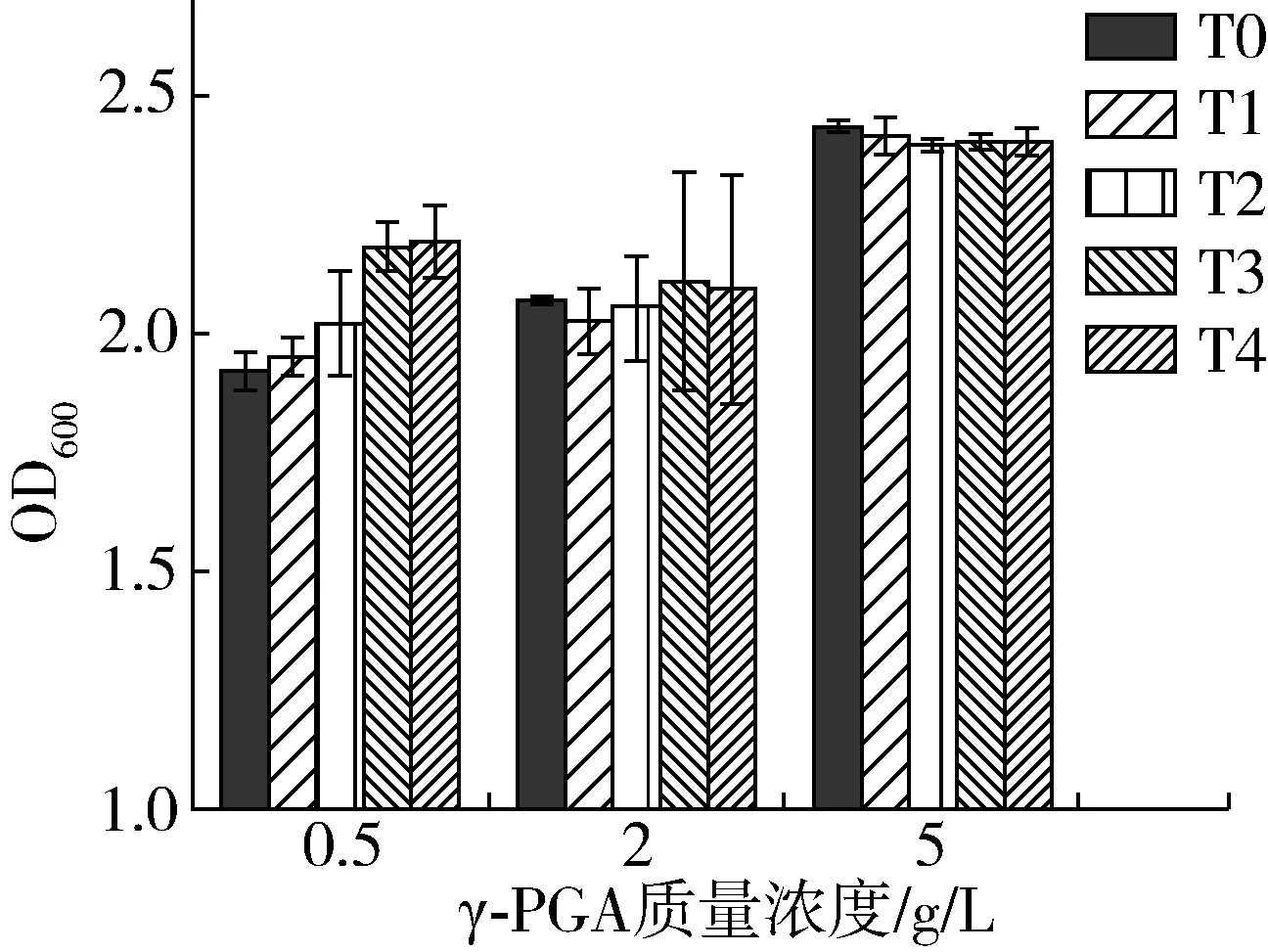
图1 SPI-γ-PGA复合物在水浴加热前后的浊度
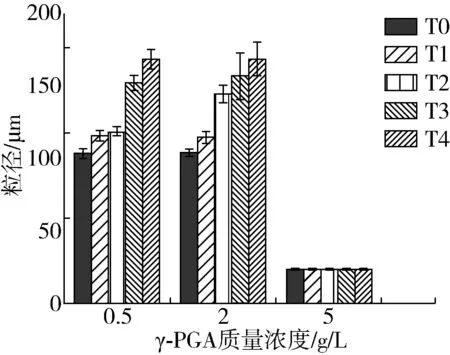
图2 SPI-γ-PGA复合物在水浴加热前后的粒径
随着水浴加热时间的增加,γ-PGA质量浓度为0.5 g/L时复合物浊度值由1.91逐步增加至2.20,γ-PGA质量浓度增加为2.0 g/L时,其浊度值的增长趋于平缓,当γ-PGA持续增加至5.0 g/L时,复合物的浊度值略有降低。这是因为加热使蛋白分子空间结构发生改变,分子间互相靠近聚集,引起复合体系浊度值增高[16],随γ-PGA加入后与SPI形成大量静电复合物,提高了蛋白的溶解度从而抑制了浊度值的显著升高,当γ-PGA持续添加至5.0 g/L时,体系中具有较强的静电排斥力,抑制了蛋白分子间的热聚集,提高了SPI分子热稳定性[17]。
2.2 SPI-γ-PGA复合物的粒径分析
蛋白分子的粒径大小直接影响其聚集程度,粒径越小,蛋白分子分散越均匀,体系越稳定[17]。由图2可知,水浴加热前,随着γ-PGA的增加,SPI-γ-PGA复合物的粒径在γ-PGA质量浓度为2.0 g/L时达到最大值为92.33 μm,而当其质量浓度达到5.0 g/L时显著减小至1.68 μm,这是由于γ-PGA加入后与SPI分子结合形成了尺寸较大的复合物,复合物的粒径增大,但当γ-PGA持续增加至5.0 g/L时,高浓度的γ-PGA使复合体系中有较多的负电荷,静电斥力增强,引起复合物的粒径减小[18]。
随着水浴加热时间的增加,γ-PGA质量浓度为0.5 g/L时复合物粒径由90.54 μm增至163.66 μm,当其质量浓度为2.0 g/L时复合物粒径从92.34 μm增大至164.08 μm,而在5.0 g/L下,复合物粒径从1.68 μm降低至1.38 μm,综合图1中复合物浊度值随水浴加热时间的变化情况可知,当γ-PGA浓度较低时,蛋白分子过量,加热使较多的蛋白分子发生了热聚集,粒径增大;随着γ-PGA的增加,热处理使SPI与γ-PGA形成的静电复合物进一步聚集,因此当γ-PGA质量浓度为2.0 g/L时复合物浊度并未发生明显变化但粒径却有显著增长;但当γ-PGA质量浓度达到至5.0 g/L时,分子间静电斥力较强,导致聚集物发生一定程度的解离,其粒径减小[19]。
2.3 SPI-γ-PGA复合物的ζ-电位分析
SPI与γ-PGA之间的相互作用力主要是静电相互作用力,复合物的表面电荷对于体系的稳定性具有重要意义,当溶液体系的ζ-电位绝对值升高时,溶液的斥力位能增加,分子热运动所需要克服的能垒加大,体系因此变得更加稳定[20]。由图3可知,随着γ-PGA添加量的增大,SPI-γ-PGA复合物的ζ-电位由4.51 mV逐步降低至-27.53 mV。这是因为随着γ-PGA浓度的提高,大豆分离蛋白携带的正电荷被部分γ-PGA的负电荷所中和,其余的γ-PGA分子分散在体系中,体系中净负电荷较多,ζ-电位的绝对值增大,复合体系分散性更好,更为稳定[21]。
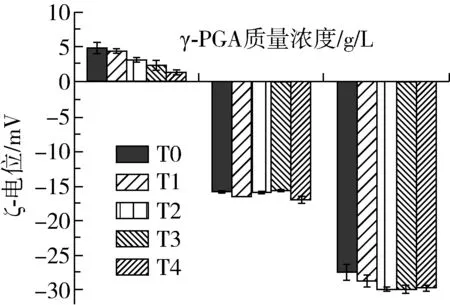
图3 SPI-γ-PGA复合物在水浴加热前后的ζ-电位
水浴加热处理后,复合体系的ζ-电位随着加热时间的增加而逐步降低,在γ-PGA质量浓度为5.0 g/L时,这种降低趋势得到了抑制。其原因可能是加热使蛋白分子发生了一定程度的展开,γ-PGA的阴离子基团以及蛋白分子的疏水性氨基酸在热处理后暴露,使复合物表面电势降低[22],γ-PGA加入后可与SPI形成静电复合物,对蛋白分子具有保护作用,有助于抑制SPI分子因受热发生变性,γ-PGA添加至5.0 g/L时,较多的净负电荷使体系中静电斥力增强,更有利于体系的稳定。
2.4 大豆分离蛋白的表面疏水性分析
由图4可知,水浴加热之前,添加γ-PGA显著降低了大豆分离蛋白的表面疏水性,且当γ-PGA质量浓度增大至5.0 g/L时蛋白表面疏水性降至最低,这是因为γ-PGA携带有负电荷,它与蛋白分子通过静电相互作用形成复合物,减少了SPI分子表面疏水基团的暴露,且当γ-PGA浓度较高时,SPI分子表面的疏水位点也会被γ-PGA分子掩盖,从而减弱了疏水作用力,使蛋白分子表现出更加亲水的特性,抑制了蛋白分子的聚集[23]。
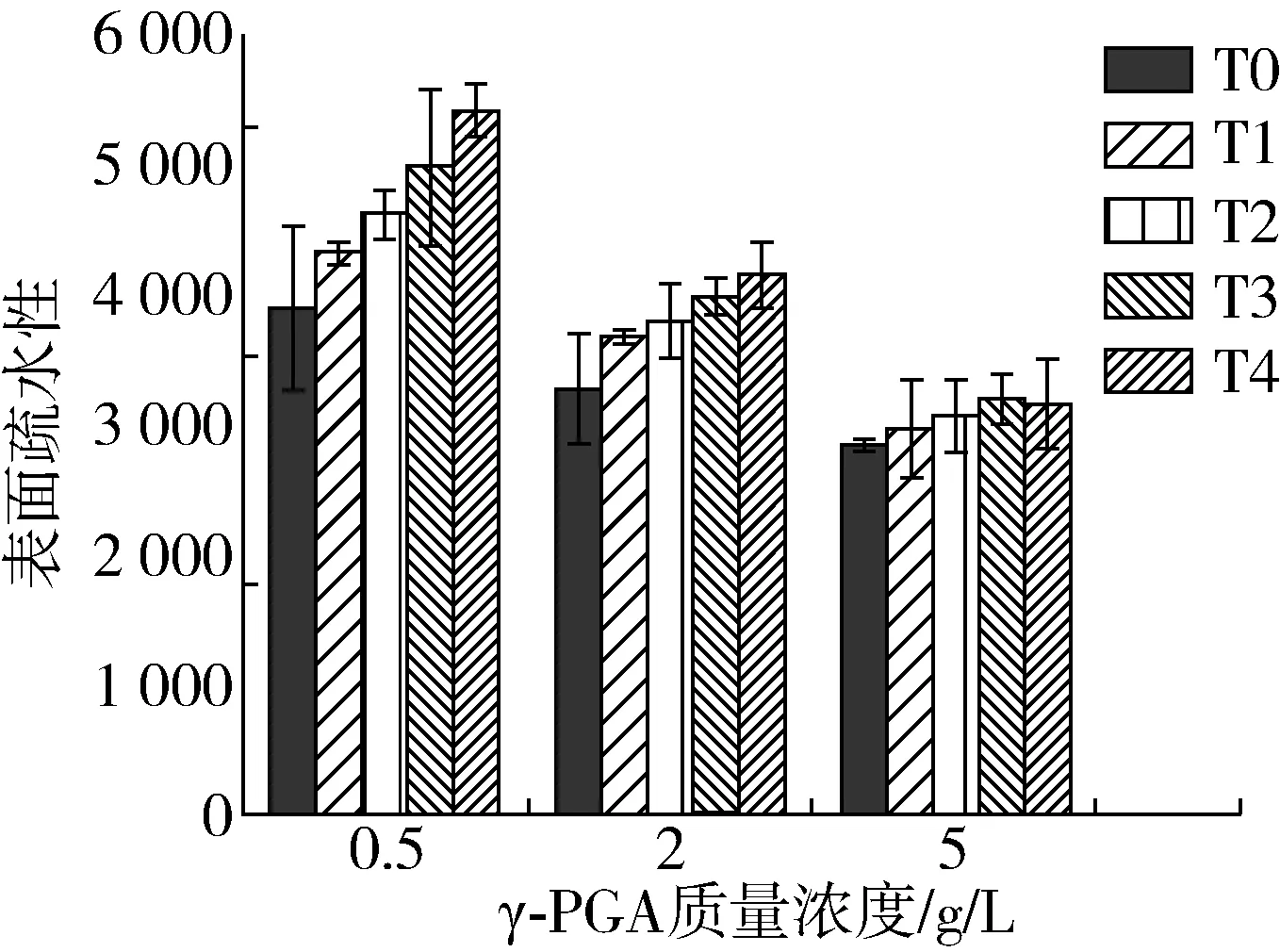
图4 大豆分离蛋白在水浴加热前后的表面疏水性
水浴加热后,随着加热时间的增加,γ-PGA质量浓度为0.5 g/L时蛋白表面疏水性数值由3 907.62升高至5 419.39,当γ-PGA质量浓度增加至5.0 g/L时,其表面疏水性数值升高的趋势趋于平缓,这可能是水浴加热导致蛋白发生解折叠,埋藏在内部的疏水性残基暴露到分子外部,表面疏水性升高[24],当γ-PGA加入后与蛋白相互作用形成了静电复合物,减少了SPI疏水基团的暴露,且较多的γ-PGA分子也起到了掩盖蛋白分子表面疏水位点的作用,从而减弱了疏水作用力,有利于抑制蛋白受热后结构的变化。
3 结论
随γ-PGA浓度的增加,SPI-γ-PGA复合物的浊度值增大,但在γ-PGA质量浓度达到5.0 g/L时其粒径显著降低,且复合体系中ζ-电位及蛋白表面疏水性均降至最低,表明添加γ-PGA提高了复合体系的稳定性。水浴加热处理后复合物的浊度值和粒径增大,其表面电势降低,蛋白表面的疏水基团暴露,蛋白分子易变性发生聚集,随加热时间的增加这种变化更为明显,当γ-PGA质量浓度增加至5.0 g/L时,复合体系中具有较强的静电斥力,有效抑制了SPI分子因热处理发生的凝聚,提高了大豆分离蛋白的热稳定性。

