青头菌(Russula virescens)聚酮合酶基因的克隆及碳源对该基因表达的影响
原晓龙, 王 毅, 杨文忠
(云南省林业和草原科学院,云南省森林培育与开发利用重点实验室/国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
食用菌因其上佳的口感、柔软的质地和丰富的营养而广泛地被人们所喜爱.青头菌[Russulavirescens(Schff. ex Zart.) Fr.]是其中一种重要的野生食用菌.青头菌又名绿菇,是一种红菇科(Russulaceae)红菇属(Russula)担子菌类真菌[1],通常着生在阔叶或针叶树种(如云南松等)根部形成外生菌根[2],其子实体较大,味道浓郁鲜美、营养丰富[3],长期以来被用作传统中药的民间药方[4].目前关于青头菌的分子生物学研究大多集中在系统进化、ITS鉴定[5]和DNA条形码等[6]方面.青头菌在成长过程中会产生戊基呋喃、辛酮和丁烯酮等聚酮类挥发性产物[3],目前尚未发现有关青头菌聚酮类化合物相关基因研究的报道.
大环内酯类、蒽环类、四环素类和聚醚类天然聚酮化合物具抗感染、抗真菌、抗肿瘤和免疫抑制等活性,这些聚酮类化合物在临床上被广泛应用[7];聚酮类是由聚酮合酶(polyketide synthase, PKS)催化合成的,聚酮合酶通过催化前体物质进行反复的缩合反应,可以形成多种聚酮体,再经过甲基化、氧化还原、糖基化等修饰反应形成各种各样结构复杂的聚酮类化合物[8].本研究通过对青头菌转录组数据的BLAST比对分析,获得了一条PKS基因,通过RT-PCR克隆获得该基因全长,并检测了其在含不同碳氮源添加物培养基上的具体表达情况,以期为青头菌品质研究、及具生物活性聚酮类生物合成提供基础材料.
1 材料与方法
1.1 青头菌菌株分离
将采集于云南省宜良县的青头菌带回实验室后,采用组织分离法,在无菌环境下将新鲜子实体的菌柄、菌盖等不同部位的组织分离出来,切成小块,置于PDA斜面培养基上,25 ℃恒温环境培养.长满管后,转接2次平板,纯化菌丝.纯化后的菌丝经形态鉴定,及ITS(GenBank登录号MW307354)、β-tubulin(GenBank登录号MW307355)和elongation factor 1α(GenBank登录号:MW307356)鉴定后,该菌种为青头菌(R.virescens),并将该菌株命名为Rv-yaf-001.
1.2 试剂与仪器
真菌RNA提取试剂盒(康为世纪公司),高保真DNA聚合酶(TaKaRa公司),NanoDropTM2000紫外分光光度计(赛默飞世尔科技公司),真菌总RNA提取试剂盒(TaKaRa公司),反转录试剂盒(赛默飞世尔科技公司),DNA纯化试剂盒(Qiagen公司),无缝克隆试剂盒(Biomiga公司).
1.3 RvPKS基因的挖掘和分离
首先以曲霉中已报道过的PKS基因为模板,利用本地BLAST对青头菌基因组进行扫描,获得可能含有PKS基因的contigs,然后利用antiSMASH(https://antismash.secondarymetabolites.org/)软件进行验证,并利用GENEFISH对contigs进行开放阅读框扫描,通过生物信息学分析获得青头菌基因组中RvPKS基因的DNA序列以及蛋白序列.
根据DNA序列设计含起始密码子的特异引物RvPKSF:5′-ATGGAACATCTGAATATCCC-3′,及含终止密码子的特异引物RvPKSR:5′-ACGGCCTCTGCAATAATTGA-3′,以青头菌cDNA为模板,用HiFi高保真DNA聚合酶用于RvPKS基因全长cDNA的克隆;经DNA纯化试剂盒将该片段纯化后,并将其连接到克隆载体Peasy-T3上,转化到Trans-T1感受态细胞中.37 ℃培养24 h,进行菌落PCR后选择含有插入片段的阳性克隆送到上海生工进行测序.
1.4 生物信息学分析
应用ExPASy数据库(https://www.expasy.org/)中的ProtParam、SignalP、TargetP、Prosite和TMHMM对RvPKS蛋白对其理化性质、信号肽、细胞定位、保守结构域和跨膜结构域进行分析.并从美国生物技术信息中心(NCBI)上选择功能已知且鉴定过化合物的蛋白序列用于聚类分析,采用MEGA 7.0中的Clustal W程序对所选择的PKS蛋白序列和青头菌中的RvPKS蛋白序列进行比对后,采用邻位相接法(Neighbor-joining),自检举1 000次,其余采用默认参数构建分子系统进化树.依据聚类结果,从基因起源与功能分化的角度预测该基因功能,并进一步推测该基因产生的聚酮化合物.
1.5 RvPKS基因在不同培养基上的表达
根据RvPKS基因的DNA序列设计特异检测引物(TRvPKSF:5′-AGAATCGCTTCAGAGTTG-3′, TRvPKSR:5′-ATGAACACCGAGTATCAC-3′).然后将青头菌菌种培养在不同含量的碳源添加物培养基上,37 ℃恒温培养箱中培养14 d后,从每种培养基上收获0.5 g菌丝体,重复3次取样,提取总RNA并选择完整性较好和浓度合适的转录成cDNA.以MYA为基本培养基,分别添加2%和10%的葡萄糖、山梨醇、蔗糖、肌醇、麦芽糖、甘露醇和可溶性淀粉.然后以actin为阳性对照,采用RT-PCR以特异引物TRvPKSF和TRvPKSR检测该基因的具体表达情况.
2 结果与分析
2.1 RvPKS基因的全长cDNA克隆
RvPKS基因的克隆测序结果(图1)显示,该基因(GenBank登录号MT655136)的全长cDNA含有6 039 bp,可编码氨基酸2 012个;保守结构域分析显示该基因的蛋白结构域组织为:ACP酰基转移酶(SAT)-β酮基合成酶(KS)-酰基转移酶(AT)-酰基载体蛋白(ACP)-硫酯酶释放结构域(TE).将该基因的cDNA全长于NCBI上进行BLASTN比对,未发现与该基因同源的基因;将其蛋白序列进行BLASTP比对发现,该蛋白与易碎软齿菌(Dentipellisfragilis)的PKS(TFY72602.1)蛋白序列拥有最高的相似性,但其相似度仅为49.03%,说明该基因为尚未报道的PKS基因.
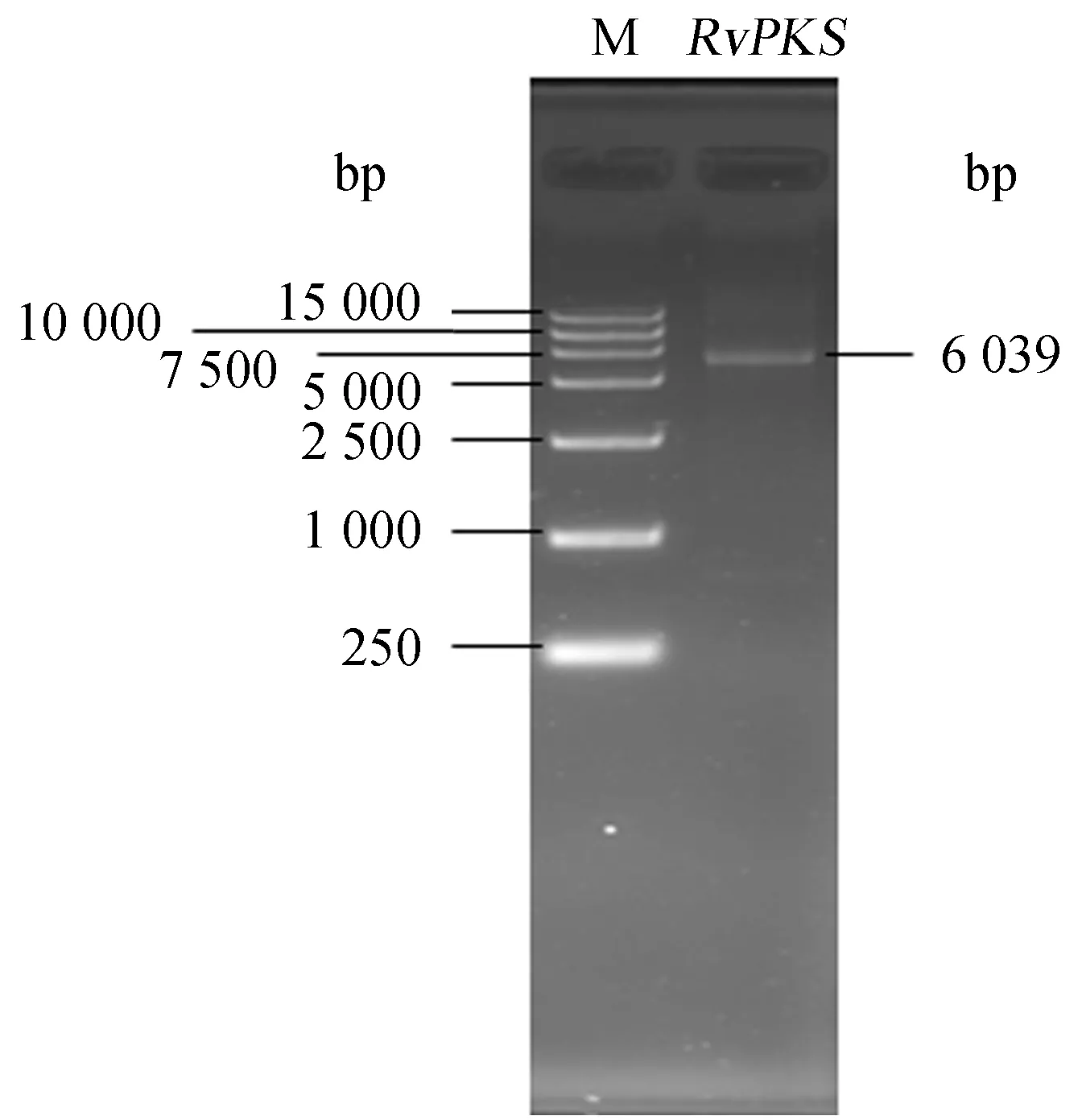
M:maker.图1 RvPKS基因全长cDNA的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of the full-length cDNA of the RvPKS gene
2.2 RvPKS蛋白的生物信息学分析
RvPKS蛋白分子质量为219.03 ku,理论等电点(pI)5.89,分子式为C9748H15372N2656O2910S8,其由2 012个氨基酸残基组成,其中亮氨酸(Leu)、丝氨酸(Ser)和丙氨酸(Ala)为该蛋白中含量最高的3个氨基酸,酸性氨基酸数量191个,碱性氨基酸155个;该蛋白的不稳定系数(Ⅱ)是41.02,属于不稳定蛋白;其脂肪族氨基酸系数为97.09,亲水性平均系数(GRAVY)为0.061.经保守结构域分析表明,该蛋白含有SAT-KS-AT-ACP-TE等结构域,其中各结构域的保守活性氨基酸序列(图2)为SAT(GIIGFSSGII),KS(DTACSSSL)、AT(NVVEAHGTGTQ)、ACP(VVGHSLGEYVA)和TE(LGGWSLGGIIA)(粗体字代表高度保守氨基酸).SignalP-5.0预测显示RvPKS蛋白无信号肽存在,TargetP 2.0预测结果显示该蛋白定位于细胞质基质;SOPMA预测显示该蛋白组成α螺旋的氨基酸有813个、β折叠289个、β转角87个、无规则卷曲823个,分别占蛋白质氨基酸总数的40.41%、14.36%、4.32%和40.90%(图3).青头菌RvPKS蛋白与其他真菌PKS蛋白的聚类分析结果显示(图4),该聚类树分为5个分支,其中火丝菌(Pyronemaomphalodes, GenBank登录号:CCX04910)、鸡枞菌属(Termitomycessp., GenBank登录号:KNZ72615)、白环菇属(Leucoagaricussp., GenBank登录号:KXN83388)、乌氏曲霉(Aspergillusudagawae, GenBank登录号:GAO84443)、丝曲霉(Aspergilluslentulus, GenBank登录号:GFG17843)、Penicilliumsubrubescens(GenBank登录号:OKP10856)和青头菌PKS蛋白聚为一支,其结构域组织顺序为SAT-KS-AT-ACP-TE,含有非还原型PKS的结构域SAT,即该蛋白编码非还原型PKS;该分支中乌氏曲霉的PKS(GenBank登录号:GAO84443)[9]、火丝菌的PKS(GenBank登录号:CCX04910)[10]其蛋白产物为聚酮合酶,生物合成的产物为分生孢子色素,青头菌RvPKS基因的终产物可能为分生孢子色素.

RvPKS:青头菌PKS(Russula virescens);DePKS:软齿菌属PKS(Dentipellis sp., GenBank登录号:KAA1469652.1);GtPKS:密褐褶孔菌PKS(Gloeophyllum trabeum, GenBank登录号:XP_007866703.1);HsPKS:小侧沟香菇(Heliocybe sulcata, GenBank登录号:TFK52663.1);AgPKS:法国蜜环菌(Armillaria gallica, GenBank登录号:PBK92884.1),*表示竖列中的氨基酸完全一致,表示竖列中的氨基酸有3个以下的差异.图2 青头菌RvPKS蛋白各结构域的保守活性位点Fig.2 Conserved active amino acids sites of the RvPKS proteins in R.virescens
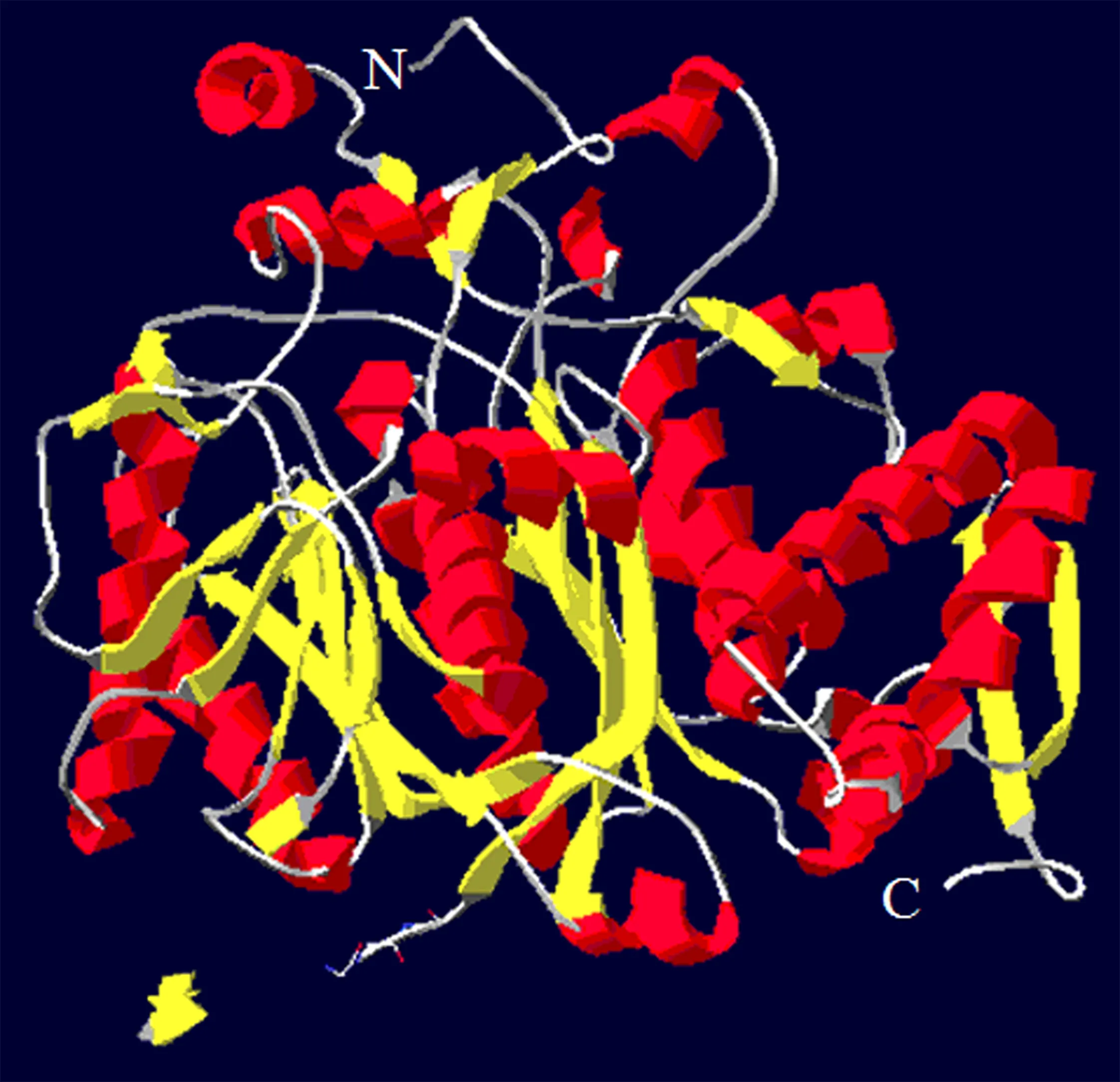
图3 RvPKS蛋白的三级结构预测结果Fig.3 Prediction of the RvPKS protein tertiary structure
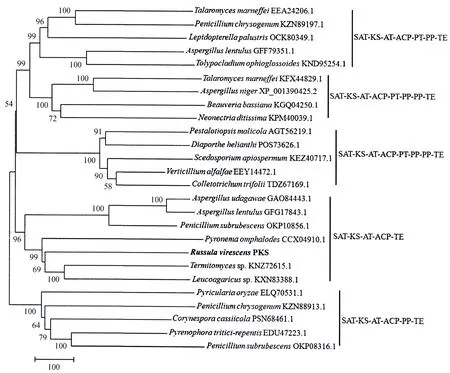
图4 青头菌RvPKS蛋白与其他真菌PKS蛋白的聚类分析Fig.4 Phylogenic analysis of the RvPKS in R.virescens and PKS proteins from other fungus
2.3 RvPKS基因的表达分析
RT-PCR结果显示(图5):该基因在2%碳源含量条件下,添加山梨醇的培养基中,该基因表达量最高,后面从高到低依次为麦芽糖>葡萄糖>肌醇>蔗糖>甘露醇>可溶性淀粉;RvPKS基因在10%碳源含量条件下,表达量从高到低依次为蔗糖>葡萄糖>山梨醇>麦芽糖>甘露醇>肌醇>可溶性淀粉.说明该基因受不同含量糖类的诱导表达程度不同,但可溶性淀粉均不能强烈诱导该基因表达.
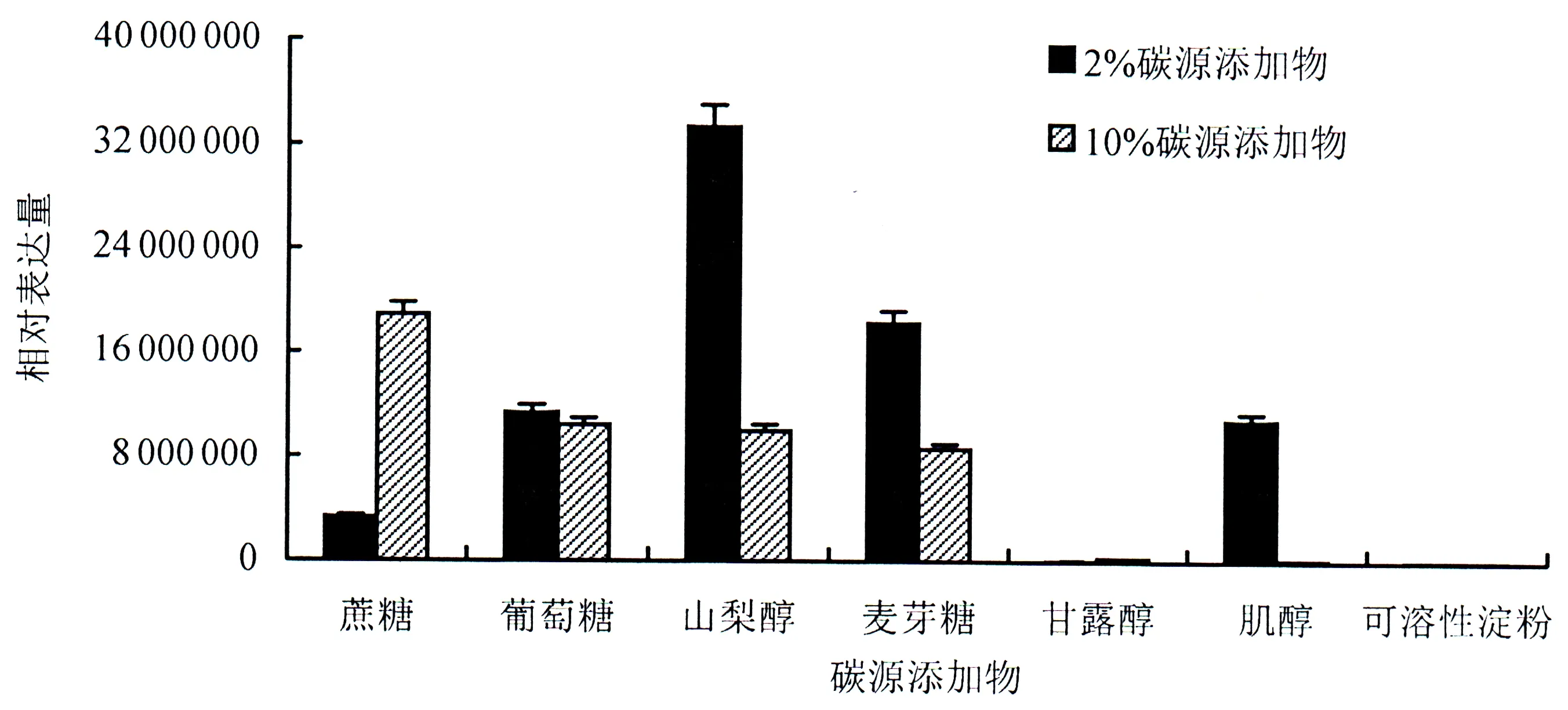
图5 RvPKS基因在含不同碳源添加物培养基上的基因表达情况Fig.5 Relative expression of the RvPKS gene under mediums supplemented with various carbon sources
3 讨论
目前,关于青头菌的研究主要集中在青头菌冷冻工艺[11]、化学成分[12,13]、子实体多糖的理化性质[14]、系统发育和ITS鉴定[15,16]、系统分类等方面,而关于青头菌中聚酮类化合物及其基因的研究尚未见报道.本研究以青头菌的基因组数据为基础,分离获得一条PKS基因,生物信息学分析显示该基因的蛋白序列含有SAT-KS-AT-ACP-TE,其中SAT结构域为非还原型PKS特有的结构域[17];与其它真菌进行比较,发现各结构域含有保守氨基酸序列,分别为SAT[G(I/V)(I/L)GFSSGI(I/L)],KS(DTACSSS)、AT(HGTGT)、ACP(VVGHSLGEY)和TE(GGWSLGG)[18,19];同时该蛋白含有KS-AT-ACP这3个聚酮合酶的最基本结构域[20];分子系统进化树显示与青头菌RvPKS蛋白聚为一支的其他真菌,其结构域组织顺序均为SAT-KS-AT-ACP-TE;且其中乌氏曲霉的PKS(GenBank登录号:GAO84443)[9]、火丝菌的PKS(GenBank登录号CCX04910)[10]的终产物为分生孢子色素.这些证据均表明青头菌RvPKS基因编码非还原型PKS酶,其终产物可能为分生孢子色素.
青头菌是一种与阔叶树或针叶树的根部共生的外生菌根菌,需要供给其合适的营养成分和生长条件才能使其孢子萌发、菌丝生长[21].离体培养时,不同的培养基会影响青头菌菌种的菌丝生长速度[22],青头菌子实体中多糖含量成分较高,其单糖组分主要包括葡萄糖、甘露糖和果糖等[14];同时渗透压、不同碳氮源和不同含量的碳氮源添加物能影响真菌中聚酮类次生代谢产物和PKS基因的表达,如10%含量的山梨醇、2%和10%含量的蔗糖均能够促使长松萝中UlPKS基因的大量表达[23].因此,本研究在基础培养基上,添加不同种类和浓度的碳源添加物以研究碳源添加物对RvPKS基因表达的影响.结果表明,不同含量的碳源添加物对该基因表达影响差异显著,其中在2%碳源含量条件下,山梨醇对该基因的表达的影响最为强烈;在10%碳源含量条件下,蔗糖对该基因表达的影响最为强烈.这种同一基因在不同培养条件下表达量明显差异的现象是因其受到渗透压、培养基成分和酶抑制剂等的影响,使同一蛋白酶受到正或负反馈,进而进入不同的代谢通路,产生不同的次级代谢产物,是一种通过微生物基因组数据挖掘获得骨架新颖、活性不同的次级代谢产物的有效途径[24,25].本研究以基因组数据为基础,结合生物信息学分析成功分离得到一条青头菌的RvPKS基因,并对其功能进行预测分析,并检测该基因在不同碳源条件下的具体表达,为鉴定和异源表达青头菌中聚酮合酶基因提供依据.

