双孢蘑菇湿泡病抗病性鉴定方法研究*
张春兰,孙 灿,金正文,曾云霞,徐玮琦,周 晨,李 玉
(1.长春大学园林学院,吉林长春130000;2.吉林农业大学食药用菌教育部工程研究中心,吉林长春130118)
双孢蘑菇湿泡病(wet bubble disease of Agaricus bisporus) 是由有害疣孢霉(Hypomyces perniciosus Magnus Delacr)的病原真菌引起的。有害疣孢霉可产生分生孢子和厚垣孢子[1],至今未见其有性生殖阶段的报道。受侵染后的双孢蘑菇菇床中通常可观察到3种不同形状的罹病子实体:一种为菌盖、菌柄分化正常,但菌盖表面有病斑;另一种为菌盖较小,菌柄粗大的畸形病菇;最后一种为无菌柄、菌盖及子实层分化的似马勃状菇包状病菇。
目前关于双孢蘑菇对湿泡病的感抗病情况的研究报道较少,截止目前其抗病评价的方法一直沿用着Flecher等[2]的方法,具体为:在常规栽培双孢蘑菇的环境条件下,待双孢蘑菇菌丝即将长满覆土层而未形成原基前,向覆土层表面喷施 1×105个/mL~1×106个/mL的有害疣孢霉菌悬液,待双孢蘑菇子实体长至采收期,以双孢蘑菇发病率(发病子实体数/所调查的子实体总数) 作为双孢蘑菇感抗病情况的评价依据。但此评价方法存在一些问题,首先其在接种时间选择上,由于每个双孢蘑菇品种间的产量上存在区别,产生原基数目不同,因此若于原基形成前的菌丝体阶段接种病原菌,不能够保证所有待评价的双孢蘑菇品种形成子实体后其数目一致,导致于此生长阶段接种得到品种间抗病性结果存在较大误差。另外此方法单纯的只是依赖发病率作为感抗病评价参考标准,试验结果重现性差,结果不够可靠。
科学的抗病评价体系应同时包括质量性状及数量性状的评价参数,研究制定科学的双孢蘑菇湿泡病的抗病性评价的方法是进行病原菌的致病性研究、寄主的抗病性研究等的基础工作和核心技术。研究并建立一套操作简便、鉴定结果可靠准确、重现性好的抗病鉴定技术体系是决定抗病育种成败的关键。
因此,应筛选出用于双孢蘑菇湿泡病抗病性评价的最佳接种方式、接种时间、接种量、接种后培养湿度以及评价时间。根据以上试验所得的最佳环境条件下双孢蘑菇的发病病症,建立科学的病情分级标准,计算病情指数,最终建立田间双孢蘑菇湿泡病抗病评价体系。
1 材料与方法
1.1 菌种来源
为了增强所得的双孢蘑菇湿泡病抗病性评价方法的稳定性与可靠性,在双孢蘑菇品种的选择上,使用前期Fu[3]研究工作中已初步筛选出的形态差异较大且抗病性有差别的3个双孢蘑菇品种;有害疣孢霉菌株使用本实验室分离鉴定的来自中国不同双孢蘑菇产区的,形态差异较大的4株有害疣孢霉菌株。
试验中3个双孢蘑菇品种分别为:1) 美国Sylvan公司的A15菌株,白色品种;2) 浙江省农业科学院的闽秀2号菌株(A40),棕色品种;3)福建省食用菌研究所的As2796菌株,奶白色品种。菌种均保存于吉林农业大学菌种保藏中心。供试的有害疣孢霉菌株均采用组织分离的方法,经纯培养后获得纯种。有害疣孢霉菌种编号为H1-12、WH1、H3-4、HN0015-8,供试的4株有害疣孢霉分别具有不同的菌落形态,其中H1-12、WH1、HN0015-8的菌种信息见参考文献[4]。H3-4菌种信息见参考文献[5]。不同形态有害疣孢霉的菌株信息见表1,供试的4株有害疣孢霉菌落形态见图1。

表1 不同形态有害疣孢霉的菌株信息Tab.1 Information of four Hypomyces perniciosus isolates
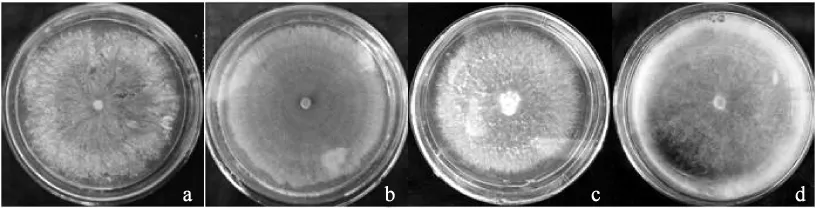
图1 4株有害疣孢霉的菌落特征Fig.1 Colony characteristic of 4 Hypomyces perniciosus isolates
1.2 PDA培养基
马铃薯200 g、葡萄糖20 g、琼脂15 g,加蒸馏水定容到1 L。
1.3 双孢蘑菇栽培条件
双孢蘑菇的出菇试验于吉林农业大学菌菜基地进行。双孢蘑菇培养料配方及环境控制条件具体如下。
二次发酵麦草鸡粪培养料:小麦∶石膏∶鸡粪的重量比为10∶6∶0.5,含水量64%~66%。按麦粒种占1%比例播种,层播方式播种。采用筐式栽培(33 cm×20 cm×15 cm),培养料厚度15 cm,每筐装料约5 kg。播种后菇房环境控制为温度23℃~24℃,相对湿度90%~95%。待菌丝长满培养料后使用草炭土进行覆土,覆土厚约2.5 cm~3.5 cm。待菌丝长至2/3覆土层时,改变菇房环境条件,降低温度至16.5℃~17.5℃,相对湿度87%~92%,加大通风。
1.4 接种方式
待双孢蘑菇子实体菌盖直径达到5 mm~10 mm时,采用2种不同的方法进行接种。
1.4.1 喷雾法
规格为100 mL的手握式喷壶,用75%酒精对其消毒5 min,无菌水润洗3次。取配制好的菌悬液装入喷壶中,菌悬液的配置参照Flecher等[2]的方法。将长有子实体的栽培筐放入40 cm×30 cm×50 cm的箱子中,每筐喷施菌悬液的浓度为3×104个/mL,共喷20 mL,喷施时喷壶口距离覆土层的高度为10 cm。
1.4.2 滴定法
移液枪吸取配制好的菌悬液,将菌悬液滴于双孢蘑菇菌盖中间,每个子实体接种的菌悬液的量设置为10 μL。接种有害疣孢霉后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测。菇房环境条件使用常规栽培双孢蘑菇出菇期的最适温14℃~18℃,湿度86%~91%。
1.5 双孢蘑菇湿泡病抗病性鉴定接种环境条件设置
1.5.1 接种时双孢蘑菇菌盖直径
当双孢蘑菇菌盖直径约3 mm~8 mm、9 mm~14 mm及15 mm~20 mm时,采用1.4中得到的最佳的接种方式接种有害疣孢霉菌,每筐控制在约20个子实体;其中较大或较小的子实体于接种之前用灭菌的手术刀挖除掉,以保证所接种的各个试验组子实体数目及大小基本相同,每个处理3次重复。接种有害疣孢霉后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测。菇房环境条件使用常规栽培双孢蘑菇出菇期的最适温14℃~18℃,湿度86%~91%。
1.5.2 接种有害疣孢霉孢子浓度
使用无菌的医用5 mL注射器吸取无菌水,不断冲洗生长于PDA培养基中20 d的有害疣孢霉菌,每皿约用20 mL无菌水冲洗;孢子被冲洗下来后,用灭菌的10层纱布过滤,以去掉菌丝体,得到的菌悬液于血球计数板中计算孢子浓度;若孢子浓度低于试验要求浓度,则继续冲洗新培养皿中的孢子添加于菌悬液中;若孢子浓度过高,则加入无菌水对其进行稀释。最终将4株供试的有害疣孢霉孢子浓度分别调节为 1×105个/mL、3×104个/mL、3×103个/mL,3个浓度梯度,每处理3次重复。采用1.4中得到的最佳的接种方式接种有害疣孢霉菌,选择1.5.1中所得的最佳接种子实体大小阶段进行接种,接种有害疣孢霉后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测。菇房环境条件使用常规栽培双孢蘑菇出菇期的最适温14℃~18℃,湿度86%~91%。
1.5.3 接种后菇房相对湿度
采用1.4中得到的最佳的接种方式接种有害疣孢霉菌,接种时双孢蘑菇的子实体大小选择1.5.1中所得的最佳接种子实体大小阶段及1.5.2中的最佳接种浓度进行接种。菇房相对湿度分别控制于80%~85%、86%~91%及92%~97%的湿度范围内。接种后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测,每处理3次重复,以不接种病原菌相同菌盖直径的子实体为对照组。接种有害疣孢霉后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测。菇房环境条件使用常规栽培双孢蘑菇出菇期的最适温14℃~18℃。
1.5.4 接种后监测时间
采用1.4中得到的最佳的接种方式接种有害疣孢霉菌,接种时双孢蘑菇的子实体大小选择1.5.1中所得的最佳接种子实体大小阶段及1.5.2中的最佳接种浓度进行接种,1.5.3中的最佳培养湿度进行接种。接种有害疣孢霉后每隔1 d观察记录双孢蘑菇的发病情况,直至接种后第9天停止监测。
1.6 病情调查方法
于1.5.1~1.5.5所述情况下,接种有害疣孢霉后每隔1 d逐一记录接种的双孢蘑菇病情。调查记录具体包括:子实体形态变化、是否畸形、颜色变化、有无病原菌菌落及孢子形成、菌盖直径大小、褐斑形态数目及大小、菌盖开伞时间。
发病率(F,%)计算公式为:

式中:G为感病子实体数(个);Z为总子实体数(个)。
子实体表面现褐色病斑,且病斑数大于10个即为感病。
1.7 建立双孢蘑菇湿泡病的病情分级标准及病情指数的计算
通过以上试验得到的最佳的评价指标,建立病情分级标准,计算病情指数。
2 结果与分析
2.1 接种有害疣孢霉的方式对双孢蘑菇发病情况的影响
不同接种方式接种后双孢蘑菇的发病情况见图2。
如图2所示,使用滴定法接种3 d后,各双孢蘑菇子实体菌盖表面现一褐色病斑,不同品种间病症区别较小;接种5 d各双孢蘑菇子实体菌盖表面现病斑,病斑形状不规则,不同品种间病症区别较小;接种后7 d供试,供试双孢蘑菇子实体菌盖表面现大量的有害疣孢霉菌丝,观察不到病斑情况,供试的3株有害疣孢霉品种间发病症状无明显区别。

图2 不同接种方式接种5 d后双孢蘑菇的发病情况Fig.2 Disease symptoms of Agaricus bisporus after inoculation of Hypomyces perniciosus with different methods after 5 d
使用喷雾式接种,接种后第3天开始,供试各双孢蘑菇子实体菌盖表面均现少量病斑;接种后5 d,供试3株双孢蘑菇子实体菌盖表面现明显病斑,且不同双孢蘑菇品种接种同一株有害疣孢霉菌株后病斑数目不同,其中As2796>A15>A40;接种后7 d,供试双孢蘑菇子实体菌盖表面现大量的有害疣孢霉菌丝,供试的3株有害疣孢霉品种间发病症状无明显区别。
综上所述采用喷雾接种的方法为最佳接种方法。
2.2 双孢蘑菇不同发育阶段接种有害疣孢霉对其发病情况的影响
双孢蘑菇在不同生长发育阶段接种有害疣孢霉5 d后发病症状情况见表2,双孢蘑菇在不同生长发育阶段接种有害疣孢霉5 d后发病率情况见表3。双孢蘑菇在不同生长发育阶段接种有害疣孢霉后发病情况见图3。
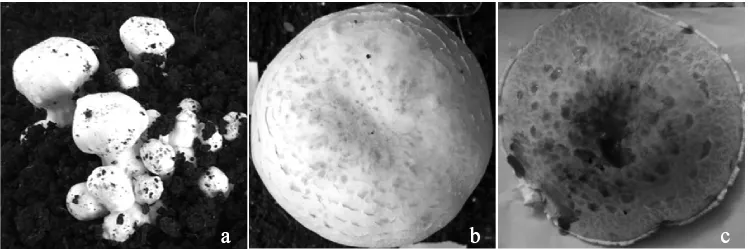
图3 双孢蘑菇在不同生长发育阶段接种5 d后有害疣孢霉后发病情况Fig.3 Disease symptoms of inoculation after 5 d of Hypomyces perniciosus on different Agaricus bisporus fruiting body growth stage

表2 双孢蘑菇在不同生长发育阶段接种有害疣孢霉5 d后发病症状情况Tab.2 Disease symptoms of inoculation of Hypomyces perniciosus on different Agaricus bisporus fruiting body growth stage after 5 d

表3 双孢蘑菇在不同生长发育阶段接种有害疣孢霉5 d后发病率情况Tab.3 Disease rate of inoculation of Hypomyces perniciosus on different Agaricus bisporus fruiting body growth stage after 5 d
由表2、表3及图3可知,当菌盖直径为3 mm~8 mm时接种会形成菌柄粗、菌盖小的畸形菇,品种间病症差异不明显。当菌盖直径9 mm~14 mm时接种,接种后3,出现少量病斑,但发病症状不明显;接种后5 d菌盖表面现褐色病斑,且不同品种间病斑数目与大小有差异。当菌盖直径为15 mm~20 mm时接种,子实体在没有观察到明显的病斑症状时即开伞,开伞后表面颜色变深,且开伞后由于孢子弹射导致菌盖被褐色孢子覆盖,使发病病症不易观察,且此时接种双孢蘑菇发病率较低。
2.3 接种有害疣孢霉孢子浓度对双孢蘑菇发病情况的影响
双孢蘑菇接种不同浓度有害疣孢霉5 d后发病率情况见表4。

表4 双孢蘑菇接种不同浓度有害疣孢霉5 d后发病率情况Tab.4 Disease rate of inoculation of Hypomyces perniciosus with different concentrations on Agaricus bisporus fruiting body after 5 d
由表4可知,有害疣孢霉的最佳接种浓度为3×104个/mL,每筐接种20 mL。当接种浓度为3×103个/mL时,产生病斑数少、发病慢;接种浓度为1×105个/mL时子实体表面产生病斑数过多。A15子实体菌盖直径为9 mm~14 mm时接种不同浓度H1-12后发病情况见图4。
如图4所示,肉眼不易观察品种间发病症状的区别。
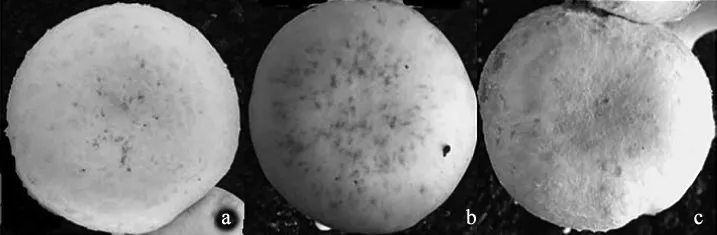
图4 双孢蘑菇A15子实体菌盖直径9 mm~14 mm时接种不同浓度H1-12菌株5 d后发病情况Fig.4 5 d after inoculation of H1-12 on A15 fruiting body with 9 mm-14 mm cap diameter under different spore concentration.
2.4 接种有害疣孢霉后空气相对湿度对双孢蘑菇发病情况的影响
不同培养湿度下双孢蘑菇接种有害疣孢霉5 d后发病率情况见表5。不同培养湿度下双孢蘑菇闽秀1号接种有害疣孢霉H1-12约5 d后发病情况见图5。
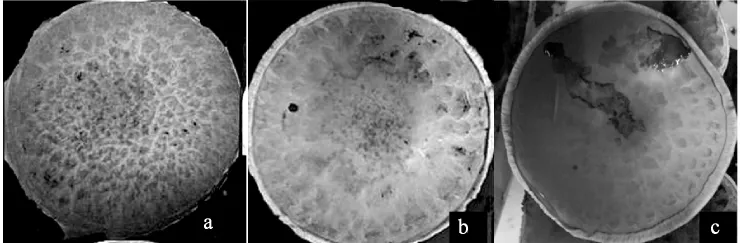
图5 不同培养湿度下双孢蘑菇接种有害疣孢霉5 d后发病情况Fig.5 Disease symptoms of inoculation of Hypomyces perniciosus on Agaricus bisporus fruiting body under different humidity after 5 d
表5 在不同培养湿度下双孢蘑菇接种有害疣孢霉5 d后发病率情况Tab.5 Disease rate of inoculation of Hypomyces perniciosus on Agaricus bisporus fruiting body under different humidity after 5 d
由表5、图5可知,接种后菇房相对湿度控制于86%~91%范围内为最佳培养湿度。于此相对湿度情况下双孢蘑菇长势良好,不会出现生长发育缓慢或者提前开伞的情况,且在接种后第5天子实体表现明显的发病症状及发病率差异;当相对湿度为80%~85%时,各双孢蘑菇品种接种有害疣孢霉后发病率低,菌盖表面产生病斑数目相对较少,且病斑颜色浅,如褐色的双孢蘑菇品种A40不易观察病斑;当接种后相对湿度控制在92%~97%时,双孢蘑菇子实体会形成菌柄较长,菌盖薄提早开伞子实体褐变,致未观察到明显病斑前,其孢子覆盖双孢蘑菇子实体表面,不同品种间观察不到明显的病症差别。
2.5 接种有害疣孢霉后不同时间内双孢蘑菇发病情况
双孢蘑菇菌盖直径9 mm~14 mm时接种有害疣孢霉后不同时间内发病率情况见表6,双孢蘑菇闽秀2号菌盖直径9 mm~14 mm时接种有害疣孢霉H1-12后不同时间内发病情况见图6。

表6 双孢蘑菇菌盖直径9 mm~14 mm时接种有害疣孢霉后不同时间内发病率情况Tab.6 Disease rate of inoculation of Hypomyces perniciosus on Agaricus bisporus fruiting body with 9 mm-14 mm cap diameter under different time after inoculation
由表6、图6可知,接种有害疣孢霉后病情评价的最佳时间为接种后第5 d。接种后的前3 d,病原菌处于潜伏期,双孢蘑菇无明显的发病症状。接种后5 d,双孢蘑菇表现明显的发病症状,双孢蘑菇病斑大量发生,不同双孢蘑菇品种间病斑差异明显,有害疣孢霉未在双孢蘑菇子实体表面产生大量的孢子和菌丝体。因此,此时为病情评价的最佳时期;接种后第7天及之后,双孢蘑菇处于发病后期,子实体表面会产生褐色液滴且有害疣孢霉的菌丝体覆盖双孢蘑菇表面导致品种间病症相近,不易区分病害等级。
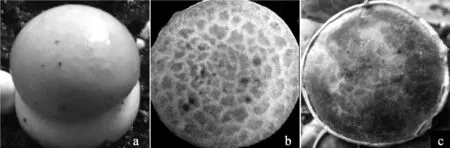
图6 双孢蘑菇菌盖直径9 mm~14 mm时接种有害疣孢霉后不同时间内发病情况Fig.6 Disease symptoms of inoculation of Hypomyces perniciosus on Agaricus bisporus fruiting body with 9 mm-14 mm cap diameter under different time after inoculation
2.6 病害分级标准
病害分级评判等级依据接种后双孢蘑菇表面的病斑数目及形态,共分5个等级。
0级:病斑数目0,双孢蘑菇无任何发病症状;1级:双孢蘑菇菌盖表面现少量稀疏间断的病斑,病斑1个~10个,病斑直径0.5 mm~2.0 mm;2级:子实体菌盖病斑数约10个~20个,病斑直径约0.5 mm~2.0 mm;3级:子实体菌盖病斑数约20个~40个,部分病斑相连,病斑直径约0.5 mm~4.0 mm;4级:菌盖表面病斑数大于40个,病斑过密而完全相连,病斑处现白色绒毛。
2.7 供试的双孢蘑菇于最适接种条件接种有害疣孢霉后病情指数情况
病情指数(D,%) 计算公式为:

式中:J为小区中调查蘑菇的感病等级的级数;G为此感病等级的蘑菇子实体数目(个);Z为小区中调查的蘑菇子实体总数(个);B为此小区中感病蘑菇的最高病情等级。
供试的双孢蘑菇于最适接种条件接种有害疣孢霉后病情指数情况见表7。

表7 双孢蘑菇于最适接种条件接种有害疣孢霉后病情指数情况Tab.7 Disease index of Agaricus bisporus after inoculation Hypomyces perniciosus
由表7可知,由于不同的双孢蘑菇品种对不同的有害疣孢霉菌株表现不同的病情分级程度,因此得到不同的病情指数值。供试的双孢蘑菇品种接种相同浓度的H1-12菌悬液后病情指数最高,而接种HN0015-8后病情指数值最低。证明HN0015-8的致病力低于其他3个有害疣孢霉菌株。双孢蘑菇闽秀2号品种在接种同一菌株相同浓度的的有害疣孢霉后其病情指数均低于其他2个供试的双孢蘑菇品种,说明闽秀2号品种的抗病能力高于AS2796和A15。
2.8 感抗病程度划分标准
综合田间调查结果,参照品种病情,提出以病情指数来划分感抗病标准:高抗(high resistance,HR):病情指数低于15%;抗病(resistance,R):病情指数大于15%,低于30%;中抗(moderately resistance,MR):病情指数大于 30%,低于 45%;感病(susceptible,S):病情指数大于45%,低于60%;高感(highsusceptible,HS):病情指数大于60%。
3 讨论
试验结果表明,在栽培环境条件相同的条件下,双孢蘑菇接种有害疣孢霉后湿度越大病斑数目越多,发病速度越快。结合Regnier[6]的研究结果,随着湿度的增加,有害疣孢霉孢子的萌发率增加,可以较好解释为什么湿度越大双孢蘑菇子实体表面病斑数目增加。同时,于双孢蘑菇不同生长阶段进行接种发现,9 mm~14 mm接种为最佳接种时期,低于9 mm时,子实体过小接种产生大量畸形菇,且各品种之间表现症状差异不明显,导致评价困难且误差较大。Umar[5]于双孢蘑菇不同生长阶段接种有害疣孢霉观察记录双孢蘑菇的发病情况,发现于双孢蘑菇原基直径小于6 mm时接种有害疣孢霉菌,双孢蘑菇子实体不能进行菌柄和菌盖的分化而形成菇包状组织,双孢蘑菇表现菌柄粗大,菌盖小的畸形子实体,或形成无菌盖及菌柄分化的马勃状菇包组织。Umar[7]的研究结果与本研究所得结果相同,畸形蘑菇导致病斑数目少,因此较小时期的子实体不适合作为双孢蘑菇感抗病评价。而当菌盖直径大于15 mm接种,由于双孢蘑菇接种后第5天初现明显病症,但此时双孢蘑菇已处于子实体发育中后期,菌盖开伞,孢子开始弹射,子实体颜色加深不利于病斑产生情况观察,因此菌盖直径大于15 mm不能满足肉眼快速判定品种间病症差别要求。
4 结论
综合使用不同接种方法下得到的发病症状及数据,确定了最佳接种条件及评价时间,建立了以接种后双孢蘑菇菌盖表面的病斑数量和大小作为新的双孢蘑菇湿泡病病情分级评价标准。通过病情评价等级计算双孢蘑菇的病情指数,以供试的3个双孢蘑菇品种的病情指数建立了双孢蘑菇感抗病评价等级。为国内首次对双孢蘑菇湿泡病感抗病评价体系的建立进行系统的研究。该方法初步确定我国双孢蘑菇品种中确实存在感抗病分化的现象,未来需要以此方法鉴定更多的双孢蘑菇品种的感抗病情况,以更好的确定该评价系统的准确性及在抗病性鉴定过程中不断的规范和提高该评价系统。

