基于ITS 序列鉴别特色民族药材土牛膝及其混伪品的研究
胡亮,方磊,李瑞莲,王湘波,周明
湖南省药品检验研究院,湖南药用辅料检验检测中心,湖南省药品质量评价工程技术研究中心,湖南 长沙 410001
土牛膝最早记载于《本草纲目》,指各地野生的牛膝,为苋科植物牛膝Achyranthes bidentataB1.的干燥根,其功效为“活血散瘀、祛风利尿,坠胎”[1];肖步丹《岭南采药录》[2]中记载土牛膝的来源之一为粗毛牛膝Achyranthes aspera L.的根。土牛膝作为西南地区瑶族和土家族常用的民族药,应用十分广泛,但未有国家统一的药材标准,其中《湖南省中药材标准》2009 年版、《贵州省中药材标准》2003 年版收载的植物基原为苋科植物粗毛牛膝AchyranthesasperaL.的干燥根及根茎;《江苏省中药饮片炮制规范》1980 年版收载了3 个基原,分别为粗毛牛膝、野生牛膝和柳叶牛膝;现行其余质量标准收载基原均为野生牛膝[3-4]。土牛膝的现行质量标准包括性状、显微鉴别和薄层色谱鉴别项目,通过品种考证、药用资源分布调查发现,3 种土牛膝药材外观形态较相似,不易区分,存在不同基原混用的情况。
近年来,随着分子生物学技术的快速发展,植物DNA 条形码被大量应用于不同基原药材的鉴定,陈士林等[5]首次提出将ITS2 序列作为药用植物鉴定的通用条形码序列。DNA 条形码鉴定技术在中药药材鉴定中具有不受个体形态特征、药用部位、鉴定经验等限制的优点,克服了传统鉴定方法的诸多缺陷[6-10]。其中植物核糖体DNA 内转录间隔区(rDNA/ITS 区)序列进化速率快,可以提供丰富的变异位点和信息位点[11]。本研究首次应用ITS 和MatK 条形码对3 种植物基原土牛膝药材及其混伪品(川牛膝、广东土牛膝)进行鉴定研究,为土牛膝的快速准确鉴定提供新的技术手段。
1 仪器与试药
植物基因组DNA 提取试剂盒(Plant Genomic DNA kit,TIANGEN);2×Taq Master Mix 缓冲液(GK8006,GENEray);ExRed(ZS203-1,庒盟生物);琼脂糖(50002,Lonza);引物(上海捷瑞生物工程有限公司合成),ITS 引物(ITS4:5'-TCCTCCGCTTATTGATATGC-3';ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3'),MatK引物(MatKF:5'-CGTACAGTACTTTTGTGTTTACGAG-3';MatKR:5'-ACCCAGTCCATCTGGAAATCTTGGTTC-3')。
PCR 仪:ABI VERITI;分 析 天 平:Mettler AB135-S;MM400 球磨仪:德国Retsch 公司;纯水仪:美国Millipore 公司;Nano Value 微量紫外分光光度计;电泳仪:EPS-301,美国Amersham 公司;全自动凝胶成像系统:英国Syngene 公司。
2 材料
本次研究共收集30 份样本,包括5 个物种。其中实验样本24 份(表1),包含粗毛牛膝、野生牛膝、柳叶牛膝、川牛膝和广东土牛膝,实验材料由湖南省野生动植物司法鉴定中心进行鉴定。其余4 条ITS和2 条MatK 研究序列来自GenBank,ITS 序列包含野生牛膝2 条(登录号KX055976、KX055977),柳叶牛膝1 条(登录号MG730614),川牛膝1 条(登录号KC898550);MatK 序列包含野生牛膝2 条(登录号MH659904、MH658983)。

表1 土牛膝及其混伪品样品信息
3 方法
3.1 DNA 提取
研究样品经75%乙醇擦拭表面,称取50 mg,在MM400 球磨仪(德国Retsch)上进行研磨,用天根植物基因组DNA 提取试剂盒提取DNA。
3.2 PCR 扩增和测序
PCR 反应体积为20 μL,使用ITS 和MatK 序列的通用引物对样品DNA 进行扩增,其反应条件为:95 ℃变性5 min,再进行35 个循环(95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1min),最后72 ℃延伸7 min。反应体系为2×Taq PCR MasterMix 10 μL,正反向引物(2.5 μmol/L)各0.4 μL,模板DNA 1 μL,其余用灭菌超纯水补至20 μL。通过ABI3730XL 测序仪对纯化后的PCR 产物进行双向测序。
3.3 数据分析
应用软件CodonCode Aligner V6.0 对序列峰图进行校对拼接,去除引物区及低质量序列,获得ITS序列和MatK 序列。利用软件MEGA 6.0 进行种内种间Kimura 2-parameter(K2P)遗传距离分析,用NJ(邻接)法构建系统聚类树对土牛膝及其混伪品进行鉴定分析。
4 结果与分析
4.1 土牛膝及其混伪品药材DNA 提取与PCR 扩增
研究样品采用植物基因组DNA 提取试剂盒并做适当调整,提取的样本DNA 使用Nano Value 微量紫外分光光度计进行纯度测定。通过ITS 和MatK引物进行PCR 扩增,电泳条带清晰,其中ITS 扩增片段约750 bp,为单一条带;MatK 扩增片段约780 bp,见图1。

图1 土牛膝药材及其混伪品电泳图
4.2 土牛膝及混伪品药材ITS 序列种内及种间变异分析
使用MEGA 6.0 软件对样品ITS 序列进行变异位点分析,粗毛牛膝与柳叶牛膝、野生牛膝存在28~32 个变异位点,变异率为4.25%~4.86%;粗毛牛膝和柳叶牛膝均只有一个单倍型;野生牛膝有2 个单倍型,2 个单倍型之间有1 个碱基差异,为418 位的C-A 取代;粗毛牛膝与川牛膝存在75 个变异位点,部分碱基有缺失,川牛膝只有一个单倍型;粗毛牛膝与广东土牛膝存在150 多个变异位点,部分碱基有缺失,广东土牛膝存在一个单倍型,不同基原土牛膝与混伪品川牛膝、广东土牛膝碱基差异较大,易于区分。
粗毛牛膝与柳叶牛膝的种间最大K2P 为0.051,与野生牛膝的种间最大K2P 为0.044,柳叶牛膝和野生牛膝的种间最大K2P 为0.010;3 种植物基原的土牛膝(粗毛牛膝、野生牛膝和柳叶牛膝)与川牛膝的种间K2P 范围为0.111~0.121、与广东土牛膝的种间K2P 范围为0.415~0.444。土牛膝各基原间种内最大K2P 小于种间最小K2P,有利于不同基原土牛膝的区分,同时与混伪品川牛膝、广东土牛膝K2P 较远,区分明显。
4.3 土牛膝药材Matk 序列种内及种间变异分析
用MEGA 6.0 软件对样品MatK 序列进行变异位点分析,粗毛牛膝与柳叶牛膝、野生牛膝存在5个变异位点,变异率为0.61%;粗毛牛膝和柳叶牛膝均只有一个单倍型,野生牛膝有2 个单倍型,2个单倍型之间有2 个碱基差异,为232 位的G-C 取代和621 位的C-T 取代。粗毛牛膝与野生牛膝、柳叶牛膝的种间平均K2P 均为0.006,柳叶牛膝和野生牛膝的种间平均K2P 为0.001;不同基原土牛膝之间种间K2P 较小,不利于物种的鉴别。
4.4 土牛膝药材及其混伪品NJ 树鉴定
从基于ITS 序列建立的聚类树种可看出,不同植物基原粗毛牛膝、野生牛膝和柳叶牛膝聚为独立的一支,且支持率高,并呈现较好的单系性;混伪品川牛膝和广东土牛膝聚为独立的一支,呈现较好的单系性,与不同基原土牛膝能够进行有效区分,见图2。

图2 基于ITS序列建立土牛膝与其混伪品的NJ树图
基于MatK 序列建立的聚类树种可看出,粗毛牛膝聚为独立的一支,呈现较好的单系性,野生牛膝和柳叶牛膝均未单独聚为一支,种间差异较小,未能有效进行区分,见图3。
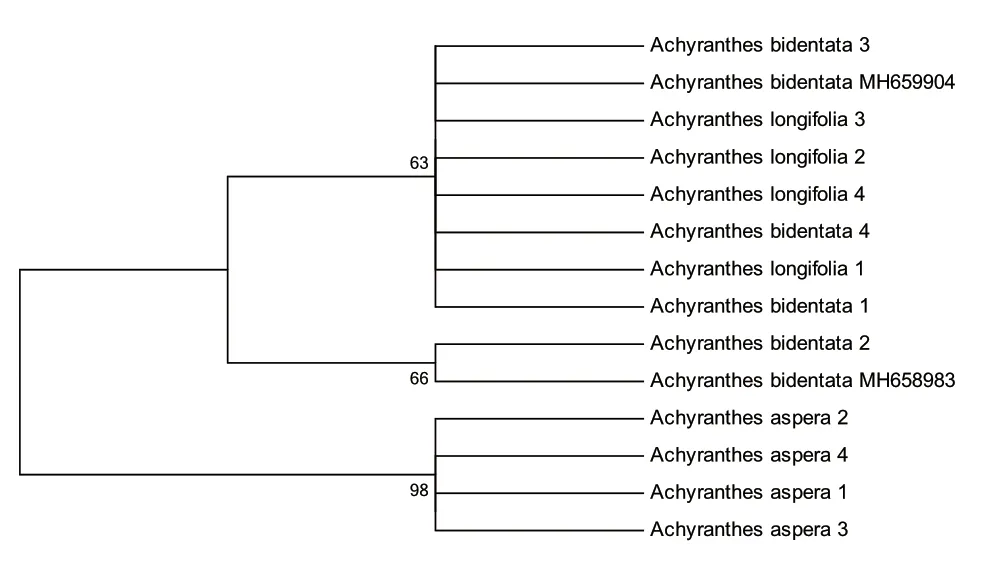
图3 基于MatK序列建立土牛膝与其混伪品的NJ树图
5 讨论
土牛膝作为西南地区瑶族和土家族常用的民族药,应用十分广泛。基于现有样品的ITS 序列变异分析表明,粗毛牛膝、柳叶牛膝暂未在现有样品中发现种内变异,后续需进一步扩大样品量;野生牛膝种内变异较小,种内最大K2P 为0.006。土牛膝药材及其混伪品ITS 扩增序列NJ 树图分析表明,粗毛牛膝、野生牛膝和柳叶牛膝可相互区分,土牛膝3 种基原与其混伪品川牛膝、广东土牛膝区别明显;MatK 扩增序列NJ 树图分析表明,粗毛牛膝单独聚为一支,但与野生牛膝和柳叶牛膝未能进行有效区分。因此,ITS 作为常用的DNA 条形码,不仅可以鉴定土牛膝3 种基原,而且可以有效区分其常见混伪品川牛膝和广东土牛膝。

