细胞减灭术联合腹腔热灌注化疗治疗恶性腹膜间皮瘤20例分析
史冠军 夏奥 马瑞卿 王冰 庞少军 许洪斌
恶性腹膜间皮瘤(malignant peritoneal mesothelioma,MPM)是一种罕见起源于腹膜间皮和间皮下层细胞的肿瘤,具有高度的生物侵袭性和致死性。该肿瘤起病隐匿,缺乏特异性临床症状,早期诊断困难,多数患者确诊时已经为中晚期,未接受治疗中位生存期不足1年[1]。2006年国际腹膜表面肿瘤联盟共识声明将以腹膜切除技术为核心的肿瘤细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗(hyperthermic in⁃traperitoneal chemotherapy,HIPEC)推荐作为MPM的首选治疗方式,该综合治疗模式将部分MPM患者的中位生存时间提升至5年以上[2-3]。但目前国内尚缺乏CRS+HIPEC治疗MPM的相关报道。本研究旨在通过对CRS+HIPEC治疗的20例MPM患者的临床资料进行分析,评估该综合治疗模式的安全性及疗效。
1 材料与方法
1.1 一般资料
本研究回顾性分析自2015年1月至2020年6月于北京航天中心医院接受治疗的20例MPM患者,男性8 例,女性12 例,男女比例为1:1.5。年龄42~77岁,平均56.3岁。收集相关资料主要包括病理特征、治疗数据及预后生存情况。纳入标准:接受CRS+HIPEC治疗;病理确诊为MPM。排除标准:仅行传统减瘤手术治疗或行“开关腹”;术前合并严重系统性疾病或化疗禁忌无法接受HIPEC 治疗;合并其他恶性肿瘤或术前已存在远处转移。
1.2 方法
1.2.1 入院检查 根据腹膜表面肿瘤治疗专家共识[4]所有患者入院后完善常规检查,包括血、尿、便常规检查,生化、凝血、肿瘤标志物(CEA、CA125、CA199)检测,腹部彩超和腹盆腔增强CT等影像学检查。
1.2.2 手术治疗 手术采用开腹或腹腔镜方式完成,进腹后首先充分探查腹腔,按Sugarbaker教授[5]所述的标准计算腹膜癌指数(peritoneal cancer index,PCI)评价腹腔内肿瘤负荷。根据探查情况行CRS手术,通过腹膜切除联合脏器切除的方式,尽可能切除所有肉眼可见肿瘤[6-7]。手术结束后通过最大残余肿瘤直径对肿瘤细胞减灭程度[5](completeness of cytoreduction,CC)进行评估。标准为CC-0:肉眼无可见残余肿瘤;CC-1:残余肿瘤直径<2.5 mm;CC-2:残余肿瘤直径在2.5 mm与2.5 mm之间;CC-3:残余肿瘤直径>2.5 cm。当减瘤程度达到CC-0/1时,被定义为完全肿瘤细胞减灭术(complete cytoreductive surgery,CCRS);CC-2/3被定义为最大限度减瘤术(maximal tumor debulking,MTD)。
1.2.3 腹腔热灌注化疗 术中CRS完成后进行1次封闭式HIPEC,时间60 min,温度控制在(43±0.5)℃。化疗方案为顺铂80 mg,溶剂为0.9%氯化钠注射液。术后根据患者身体恢复情况,辅助3~5次腹腔热灌注化疗,化疗方案为1g 5-Fu,灌注时间、方式与术中相同。
1.2.4 随访 所有患者术后每6 个月复查肿瘤标志物(CEA、CA125、CA199)及腹盆腔增强CT。生存时间从手术之日起,至患者死亡或随访时止。本研究随访终点为2020年7月30日。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。生存资料分析选用Kaplan-Meier法计算总生存,单因素分析采用Log-rank检验,多因素分析采用Cox回归模型。P<0.05为差异具有统计学意义。
2 结果
2.1 主要临床病理特征
20 例患者首次就诊原因:腹胀、腹痛12 例;腹部肿物3 例;体检发现腹水3 例;腹部其他手术中意外发现2 例。6 例在确诊前高度怀疑为腹腔结核,其中3 例接受过抗结核治疗。11 例通过腹腔穿刺活检确诊。7 例在入院前曾接受过手术;9 例曾接受过静脉化疗。所有患者入院肿瘤标志物检测:CA125异常9例,CA199异常1例。CT检查结果示16例有腹膜、大网膜弥漫性增厚伴腹水;2例提示有少量腹水;1例提示盆腔巨大肿物;1例未显示明显异常。术后病理结果均为MPM,分型为上皮型。
2.2 手术相关参数
20 例患者中11 例开腹完成CRS+HIPEC 治疗,6例为腹腔镜检查后中转开腹,3例在腹腔镜下完成治疗。平均手术时间为462(166~827)min。术前PCI<20分12例,减瘤程度达到CC-0/1为11例。联合脏器切除≤2 个12 例;脏器切除>2 个6 例。出血量平均1 180(50~4 000)mL。
2.3 生存分析
患者均得到随访,至随访截止时间,共死亡8例,死亡原因主要为肠梗阻、恶病质。中位随访时间21(1~42)个月,中位OS为27(1~42)个月。1、2、3年生存率分别为73.9%、58.2%和43.6%(图1)。生存单因素分析中,性别(P=0.295),CA125异常(P=0.256),既往手术(P=0.460)以及静脉化疗(P=0.283)未见对总生存有显著影响(表1)。年龄>60岁(P=0.037,图2),CC-2/3(P=0.027,图3),PCI≥20分(P=0.014,图4)在影响总生存单因素分析具有统计学意义。将单因素分析中的影响因素纳入Cox回归模型进行多因素分析,结果显示各影响因素均差异无统计学意义(表2)。

图1 20例MPM患者总体生存曲线
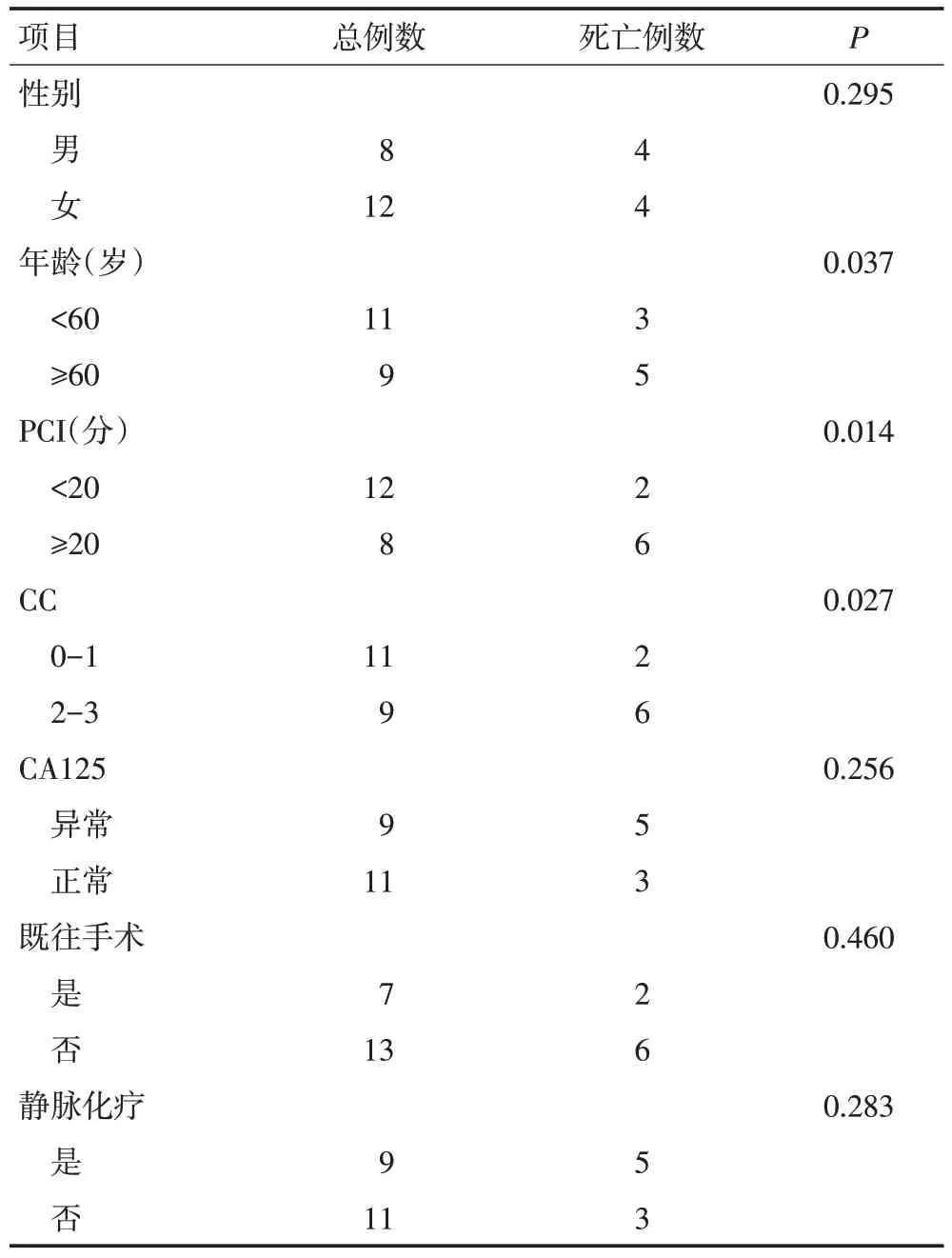
表1 20例MPM患者生存预后单因素分析

图2 年龄生存曲线
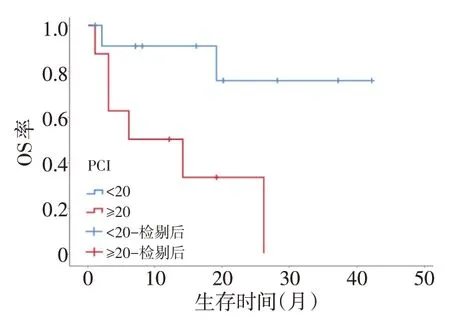
图3 PCI生存曲线
2.4 不良反应
20例患者共出现不良反应为3例(Clavien-DindoⅢ~Ⅳ级),占15%,胸腔积液2例穿刺引流后好转,肠瘘1例再次手术后恢复良好。围手术期死亡1例。
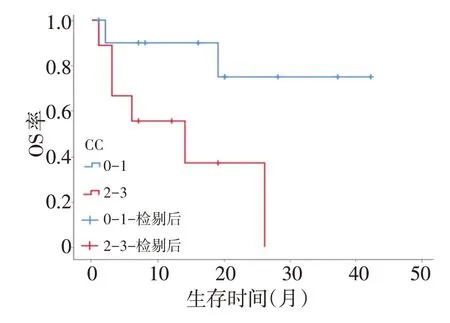
图4 根治程度生存曲线
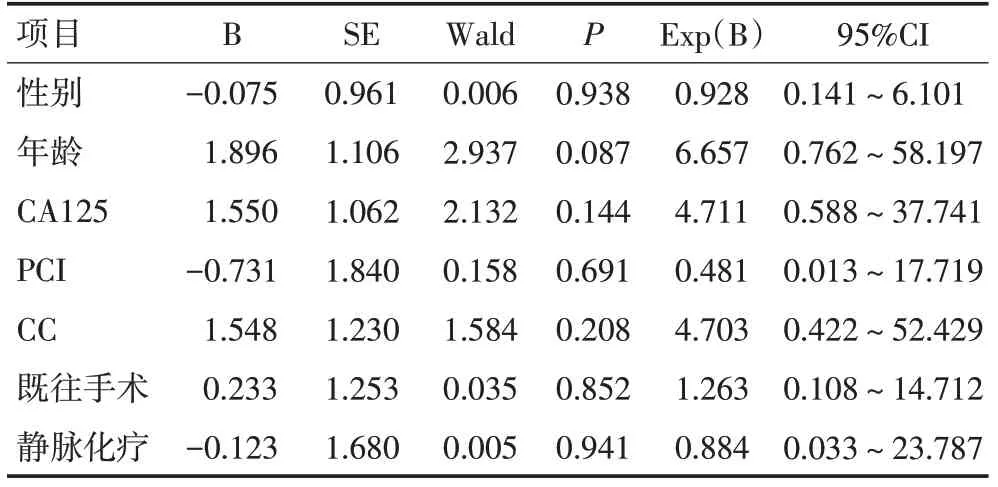
表2 20例MPM患者生存预后多因素分析
3 讨论
恶性间皮瘤是一种起源于胸膜、腹膜、心包膜及睾丸鞘膜间皮细胞层的罕见肿瘤[1,8]。MPM占所有恶性间皮瘤的7~20%,无明显性别差异[9-10]。已经证实接触石棉与恶性间皮瘤发病密切相关,然而与胸膜间皮瘤不同,MPM 仅有8%的患者接触过石棉,而胸膜间皮瘤患者石棉接触史高达80%[11-13]。
MPM起病隐匿,早期往往无明显症状,或者仅表现出较轻微的腹部不适,极易被忽视。随着疾病的发展,逐渐出现的主要症状为腹胀、腹痛及腹围增大[10-11],本研究患者中以腹胀、腹痛就诊12例(60%)。其他症状可能包括体质量减轻、饮食减少、腹部肿块等[1]。由于MPM罕见和缺乏特异性临床症状,容易被误诊为其他腹膜转移疾病,从而导致接受不恰当的治疗。
血清肿瘤标志物检测可能表现CA125升高,然而该肿瘤标志物不具有特异性,较难用于诊断,但对术后监测复发有一定的价值[14]。CT是常用的影像学检查,典型表现为腹水、腹膜不规则增厚、大网膜弥漫性增厚、肠管走型紊乱模糊[15-16]。PET-CT在MPM早期诊断中作用有限[11,16]。腹水穿刺脱落细胞学检查往往难以为确诊提供帮助[17],而超声或CT引导下组织穿刺活检则有着较重要的意义[18]。腹腔镜检查也是一种很好的诊断方式,其创伤小,可以探查腹腔肿瘤分布情况,评估完全细胞减灭术的可能性,并且能够获取更多组织进一步明确诊断[19-20]。最终病理需要依靠免疫组织化学法检测确定诊断,最敏感阳性染色标记物包括Calretinin、CK5/6、Vimentin、WT-1,阴性染色标记物包括癌胚抗原、B72.3、MOC-31、TTF-1、Ber-EP4[21],在确定MPM时至少使用两种以上免疫组织化学标记[12]。
MPM最早报道于1908年,上世纪以传统静脉/腹腔化疗或姑息手术为主要治疗手段,但在传统治疗模式下MPM中位生存期均不足1年[1,22-23]。单纯静脉化疗未能在MPM 研究中体现出显著的生存优势,中位生存期仅为10.3~13.1个月[24-25]。基于SEER数据库的大样本量MPM 回顾性研究可知,减瘤手术尤其是联合放化疗的综合方案可显著的改善MPM患者的远期预后[26-27]。研究中未接受手术治疗的中位生存期分别为4.0 和10.5 个月,而接受基于减瘤手术的综合治疗方案后中位生存可达20.0个月和20.8个月[26-27]。
随着以腹膜切除技术为核心的CRS+HIPEC在腹膜肿瘤治疗中的普及,越来越多的中心采纳此综合治疗模式,并逐渐成为MPM 公认有效的治疗方式。选择合适的患者进行CRS+HIPEC治疗,可将MPM的5年生存率提升至50%以上[2-3,22,28]。Yan[22]等总结了29 个中心405 例接受CRS+HIPEC治疗MPM 患者在2009年一项大样本量的回顾性研究,结果显示整体中位生存期为53个月,3年和5年生存率分别为60%和47%。2013年美国3 个诊疗中心研究显示,在CRS+HIPEC治疗后,211例患者的5年和10年生存率分别为41%和26%[29]。Helm等[30]基于20篇文献共计1 047例患者的Meta分析结果显示,手术达到CC-0/1以及接受铂类为主的腹腔灌注化疗,是改善MPM 患者远期预后的关键因素。Sugarbaker等[2]报道的单中心129例接受CRS+HIPEC治疗的MPM患者5年生存率亦在50%以上,且研究提出术后长期的腹腔化疗可进一步延长远期生存,研究中29 例长期接受腹腔化疗的患者中位生存可达14.8年。而近期报道的单中心29 例接受CRS+HIPEC 治疗的MPM 患者中8年生存率也高达62%,值得注意的是研究中41%(12/29)的患者PCI在20分以上[31]。
虽然国际多个中心报道了CRS联合HIPEC综合治疗模式下MPM的预后情况,但各中心样本量均不大,且国内尚无相关文献报道,目前国内对MPM相关研究仍局限于传统减瘤手术或静脉化疗[1]。本研究结果显示MPM患者在接受CRS联合HIPEC治疗后整体1、2、3年生存率分别为73.9%、58.2%和43.6%,其中达到CC-0/1的患者3年生存率为75%,与国外既往研究一致,总体生存率明显优于传统治疗结局[22,29]。
本研究中单因素分析结果显示,年龄>60岁、CC-2/3、PCI≥20分差异具有统计学意义(P<0.05),提示上述因素是预后不良的影响因素,与国外报道相似[29]。研究指出,高龄、不完全肿瘤细胞减灭术、高PCI 是预后不良的影响因素[32-33]。Liu 等[33]的研究同时指出多因素分析中显示CC-2/3是影响预后的独立因素。高龄作为影响预后的不良因素,可能与手术后恢复差有关。本研究中多因素分析未能得出有统计意义的结果,考虑可能与样本量少有关。CRS+HIPEC综合治疗模式实施难度高,往往需要经历漫长的学习曲线过程,Kusamura 等[34]指出大约需要接受100例次手术,才能达到熟练水平。Raza等[35]综合分析30 篇文献指出MPM 接受CRS+HIPEC 治疗3 级及以上并发症发生率为14%~71%,围手术期死亡率0~11%。本研究中3 级以上并发症发生率为15%,围手术期死亡率5%,亦与国外报道相似[36]。
MPM患者能否在新辅助化疗中获益目前存在争议,相关研究极少。Kepenekian 等[36]研究显示,新辅助化疗会降低生存率。而Deraco 等[37]研究结果显示术前辅助化疗并不能提高MPM根治率及降低并发症发生水平,且接受术前化疗的患者未体现出生存优势。本研究中9 例曾接受静脉化疗的患者中位生存期仅为7个月,而未接受静脉化疗的患者尚未达到中位生存。本研究未接受静脉化疗的患者3年生存率为60%,虽因样本量较小生存分析结果显示未体现出显著生存差异(P=0.283),可证实静脉化疗治疗并不能提高术后生存期。
本研究不足之处为回顾性研究,样本量少,事件发生率低,随访时间短,可能是导致部分因素未得到有意义的结论的主要原因。其次患者术后接受治疗数据缺失,可能对研究结果产生影响。
综上所述,MPM是一种临床较少见恶性肿瘤,目前整体对MPM认知尚不足。虽然回顾性研究结果显示CRS+HIPEC在MPM患者中可延长生存时间,并已成为治疗MPM 的首选方案,但其远期疗效仍需要更大样本量或高质量的临床研究证实,以期得到更可靠的结论及治疗筛选策略。

