氨曲南竞争性抑制NDM-1对β-内酰胺类抗生素的水解
王玺,李彬春,张晟,谢斌,吴长新,李深伟,孟庆来*
(1.山西大学 生物医学研究院,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006;3.隆德大学 纯应用生物化学系,瑞典 隆德 SE-22100;4.上海国际旅行卫生保健中心,上海 200335)
0 引言
新德里金属-β-内酰胺酶1(NDM-1)是一种金属-β-内酰胺酶(MBL),可水解几乎所有β-内酰胺类抗生素(包括碳青霉烯类)以及丝氨酸β-内酰胺酶抑制剂[1]。NDM-1从肺炎克雷伯菌分离株中发现后其编码基因blaNDM-1在世界范围内迅速传播,主要出现在大肠杆菌、肺炎克雷伯菌、阴沟肠杆菌、铜绿假单胞菌和鲍曼不动杆菌等条件致病菌中[2]。随着blaNDM-1基因不断进化,目前已出现近20种变体。伴随着进化这些变体的热稳定性和锌离子结合力逐步提高,以应对环境压力和宿主营养免疫[3-4]。由于NDM-1常与其他β-内酰胺酶及其他抗生素抗性相关因子在病原菌中共表达,因此表达NDM-1的病原菌几乎对目前所有临床可用的抗生素具有抗性,导致感染发病率和死亡率的升高[5-6]。因此,产NDM-1的菌株已成为全球主要健康威胁菌之一。
氨曲南(ATM)是一种单环β-内酰胺类抗生素,对MBL具有稳定性,但可被Ambler分类中的一些A类和C类广谱β内酰胺酶水解[7]。氨曲南是一种主要用于治疗由革兰氏阴性菌如假单胞菌引起感染的抗生素,其杀菌机制主要通过与青霉素结合蛋白3结合从而抑制细菌壁生成,最终导致细菌死亡。近年来,联合应用ATM与头孢他啶(CZA)-阿维巴坦治疗产MBL的多重耐药肠杆菌在体外杀菌实验和体内临床治疗都取得了较好的效果[8],该治疗策略的作用机制为由于氨曲南对MBL稳定,在阿维巴坦(丝氨酸酶抑制剂)的保护作用下氨曲南可对同时产超广谱β内酰胺酶(ESBL)和MBL的肠杆菌进行杀伤[9-11]。然而目前尚不清楚氨曲南是否可通过与MBL结合而抑制MBL对头孢他啶的水解,从而增强头孢他啶杀菌活性。本研究以NDM-1为模型,分析在氨曲南存在的情况下,MBL水解其他β内酰胺类抗生素的活性[12-13]。
1 材料和方法
1.1 材料
美罗培南三水标准品购自国家食品药品监督管理局,青霉素G和氨曲南购自北京索莱宝科技有限公司,头孢硝噻吩购自Sigma公司(美国)。本研究中使用的所有抗生素的纯度均高于98%。由Steinachglas公司(施泰纳赫,德国)获得直径为125μm~140 μm且孔径为50 nm的丙氨基衍生的可控孔玻璃珠(CPG),化学试剂购自北京索莱宝科技有限公司或上海生工公司,分子生物学酶购自Takara Bio,blaNDM-1及其引物由上海生工合成。
1.2 蛋白表达和纯化
NDM-1的表达和纯化除了不去除重组蛋白N末端的His标签[14],其余步骤与前期发表的文章相同[15]。blaNDM-1全长模板合成于上海生工。随后,用一对引物(上游引物:5’GCCTGGTGCCGCGCGGCAGCCATATGGGTGAAATCCGCCCG ACG 3’;下游引物:5’CAGTGGTGG TGGTGGTGGTGCTCGAGTCAGCGCAGCTTGTCGG C 3’)通过PCR从全长blaNDM-1重组蛋白的N末端去除第1-28个氨基酸残基对应的核苷酸序列并在截短的blaNDM-1核苷酸序列中引入6个His标签核苷酸序列,然后将扩增产物插入pET-28a载体。具有N-末端标签的重组蛋白质在大肠杆菌菌株BL21(DE3)中于 22℃在异丙基 β-D-1-硫代半乳糖吡喃糖苷(IPTG)的诱导下产生。收集细菌并超声裂解菌体,收集上清。立即将上清液上样到Ni2+-NTA色谱柱(Qiagen)上,然后用40 mmol/L咪唑柱洗涤,用200 mmol/L咪唑洗脱。洗脱的NDM-1在4℃下用磷酸盐缓冲液透析两次。对于纯化的NDM-1,通过SDS-PAGE测定表达和纯度,通过BCA试剂盒(索莱宝)测定浓度。
1.3 NDM-1酶珠的制备
室温下将CPG玻璃珠在磷酸盐缓冲液中用戊二醛减压下活化30 min,然后在环境压力下再活化30 min。将CPG彻底洗涤,收集400 μL活化的CPG,并在室温下与100 IU NDM-1一起温育2 h,4℃上下翻转过夜。洗涤酶结合的CPG,加入1 mL BSA(10 mg/mL)阻断酶柱剩余活性位点。孵育2 h后,洗涤CPG,完成NDM-1酶固相。
1.4 抗生素浓度的测定
根据每种抗生素的标准曲线,通过UV/Vis分光光度计(安捷伦)测定用可溶性或固定化NDM-1预处理的溶液中抗生素的浓度。将1000 mg/L的抗生素溶液2倍连续稀释至1.83 mg/L,然后通过分光光度计在235 nm对头孢硝噻吩(Nitrocefin)及氨曲南(Aztreonam,ATM)分别在486 nm及292 nm波长下进行扫描,测量每个标准浓度下的吸光度,并根据吸光度值以确定以上抗生素进行定量分析的线性范围[16]。头孢硝噻吩及氨曲南的检测线性范围分别为 1.25 mg/L~125 mg/L 及 3.2 mg/L~125 mg/L。当对反应产物中的头孢硝噻吩进行检测时,氨曲南在254 nm的波长扫描下检测背景读数为0。
由于以分光光度计方法分析NDM-1水解氨曲南/美罗培南或氨曲南/青霉素G水解产物中美罗培南或青霉素G浓度时氨曲南会干扰美罗培南或青霉素G的检测,而氨曲南用中性羟胺法进行定量分析时,氨曲南不显色,不会对共存的其他抗生素的定量分析产生背景干扰,所以本研究中使用中性羟胺法来测定NDM-1水解氨曲南/美罗培南产物或氨曲南/青霉素G产物中美罗培南或青霉素G的浓度[17]。中性羟胺法检测β内酰胺类抗生素浓度的方法同前期报道[18],即取抗生素水解产物1份,先后加入相同体积的中性羟胺及体积比为95%的乙醇,反应3 min,再加入两份体积的硫酸铁铵混匀,最后用Nano Drop(Thermo公司)对抗生素/羟胺混合物在515 nm波长下进行扫描,检测水解产物中的美罗培南或青霉素G浓度。美罗培南或青霉素G浓度根据标准物用羟胺检测法建立的标准曲线进行计算。
1.5 抗生素水解实验及水解率的计算
1.5.1 头孢硝噻吩水解试验及水解率计算
以0.04、0.2或是1 IU/L的NDM-1处理5 mmol/L头孢硝噻吩与4.6 mmol/L、2.3 mmol/L、1.15 mmol/L、0.57 mmol/L或0.28 mmol/L氨曲南的混合物1 h或13 h。另外以NDM-1只处理头孢硝噻吩的样品为阳性对照。在反应1 h或13 h后取部分上清用Nanodrop检测头孢硝噻吩水解产物的浓度(486 nm)。头孢硝噻吩的水解率公式为(每个样品中头孢硝噻吩水解产物的数量/阳性对照样品中头孢硝噻吩水解产物的数量)×100。
1.5.2 美罗培南水解实验及水解率计算
以1 IU/L NDM-1处理4.6 mmol/L美罗培南与4.6 mmol/L、2.3 mmol/L、1.15 mmol/L、0.57 mmol/L或0.28 mmol/L氨曲南的混合物1 h或是13 h。另外,以无NDM-1的4.6 mmol/L美罗培南样品为阳性对照。反应1 h或13 h后取部分上清进行羟胺染色反应,后用Nanodrop检测染色液中美罗培南的剩余量(515 nm)。美罗培南的水解率公式为(1-每个反应中美罗培南的剩余量/阳性样品中美罗培南的量)×100。
1.5.3 青霉素G水解实验及水解率计算
以15 μL的NDM-1酶珠在存在或不存在4.6 mmol/L氨曲南的条件下处理5.4 mmol/L青霉素G 1 h,收集20μL反应上清作为第1次处理后样品待测。PBS清洗3次,然后向先前以青霉素G单独处理和青霉素G/氨曲南混合物处理的两份酶珠中都加入5.4 mmol/L的青霉素G重新处理1 h,收集20 μL反应上清作为第2次处理后样品待测。PBS清洗3次,然后再次向两份酶珠中加入5.4 mmol/L的青霉素G重新处理1 h,收集20 μL反应上清作为第3次处理后样品待测。以没有用NDM-1酶珠处理的5.4 mmol/L青霉素液作为反应的阳性对照。把3次收集的样品用羟胺染色法对其中青霉素G的剩余量进行检测。青霉素G的水解率公式为(1-每个样品中青霉素G的量/阳性对照样品中青霉素G的量)×100。
在以上3种水解实验中,样品中抗生素浓度以该抗生素标准品所绘制的标准曲线计算而来。
1.6 NDM-1酶稳态动力学参数测定
利用分光光度计的方法在30℃含有10 μmol/L ZnSO4的PBS缓冲液(pH=7.0)中分析NDM-1对美罗培南水解反应中的酶稳态动力学参数。用294 nm波长对NDM-1水解美罗培南活力进行5 min的持续检测,通过美罗培南吸光度的减少来计算美罗培南的浓度。通过测定不同美罗培南浓度下的反应初始速率获得动力学常数(Km、Kcat及Kcat/Km)。使用Graphpad Prism 5.0软件拟合和分析初始速率的浓度依赖性以产生米氏方程。
1.7 统计学分析
使用GraphPad Prism作图软件,对数据分组进行抗生素水解率差异分析。同时,进行未配对t检验以确定两组之间的差异。P<0.05被认为两组间差异显著。P<0.05及P<0.01分别用*及**进行表示。
2 实验结果
2.1 重组NDM-1的表达和活性验证
重组NDM-1的预测分子量为27.9 kDa,SDS PAGE凝胶中重组蛋白的位置略高于Marker中25 kDa蛋白带,从而从分子量大小上初步证实了NDM-1的表达(图1)。通过SDS PAGE凝胶扫描结果可确定纯化的蛋白的纯度>95%。纯化的蛋白在30℃及含有10 μmol/L ZnSO4的PBS缓冲液中对美罗培南的单位水解活性为108 IU/mg。在相同的条件下纯化的NDM-1对美罗培南水解的酶学常数,Km(μmol/L)、Kcat(s-1)和Kcat/Km(s-1μmol/L-1)平均值分别为47、86和0.55。这些数据表明纯化的蛋白与NDM-1在蛋白分子量和酶学活性上有相同的特征,且纯度很好,所以NDM-1表达、纯化成功。然而,即使以相对高浓度的NDM-1纯化酶(10 μmol/L)处理氨曲南(100 μmol/L)长达16 h也未观察到氨曲南发生水解(数据未提供)。
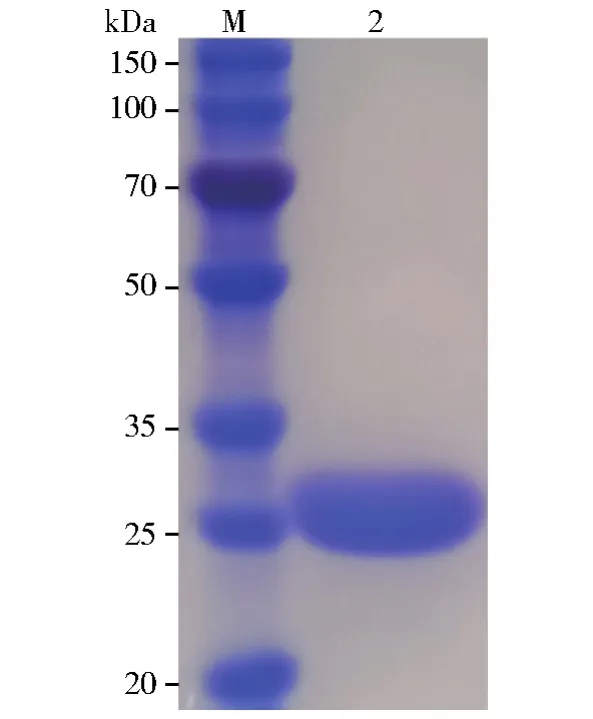
图1 以SDS-PAGE凝胶电泳确定重组NDM-1表达Fig.1 Confirmation of recombinant NDM-1 expression by SDS-PAGE
2.2 氨曲南抑制NDM-1水解头孢硝噻吩和美罗培南
首先研究氨曲南存在时NDM-1对头孢硝噻吩水解的影响。在由氨曲南、头孢硝噻及NDM-1组成的反应体系中,当NDM-1浓度在相对较低(0.04 IU/L)和中等水平(0.2 IU/L)的反应条件下,共处理1 h,头孢硝噻吩被NDM-1水解的百分率随着氨曲南浓度的减少而增加。且在氨曲南(4.6 mmol/L)和头孢硝噻吩浓度(5 mmol/L)相似时,头孢硝噻吩均未见显著的水解(图2A和2B)。当NDM-1浓度在相对高水平(1 IU/L)的反应条件下,只有氨曲南为4.6 mmol/L时,头孢硝噻吩未发生明显的水解。在其他氨曲南浓度条件下,头孢硝噻吩水解都达到80%以上,且各浓度间没有显著性差异(图2C)。当共处理的时间达到13 h,在所有3种NDM-1浓度条件下,当氨曲南浓度为4.6 mmol/L时,头孢硝噻吩均未发生明显水解。但氨曲南在其他较低浓度条件下,头孢硝噻吩都能达到75%以上的水解,而且在各浓度氨曲南之间,头孢硝噻吩水解未见显著区别(图2A,2B和2C)。即使NDM-1浓度高达1 IU/L,在共处理1 h和13 h两个时间点,浓度为4.6 mmol/L和2.3 mmol/L的氨曲南都能显著抑制4.6 mmol/L美罗培南的水解。且与头孢硝噻吩相似,当共处理的氨曲南浓度为4.6 mmol/L时,美罗培南几乎没有明显的水解(图2D)。综上所述,在高浓度氨曲南存在的条件下,NDM-1水解头孢硝噻吩和美罗培南的活性均被显著抑制。
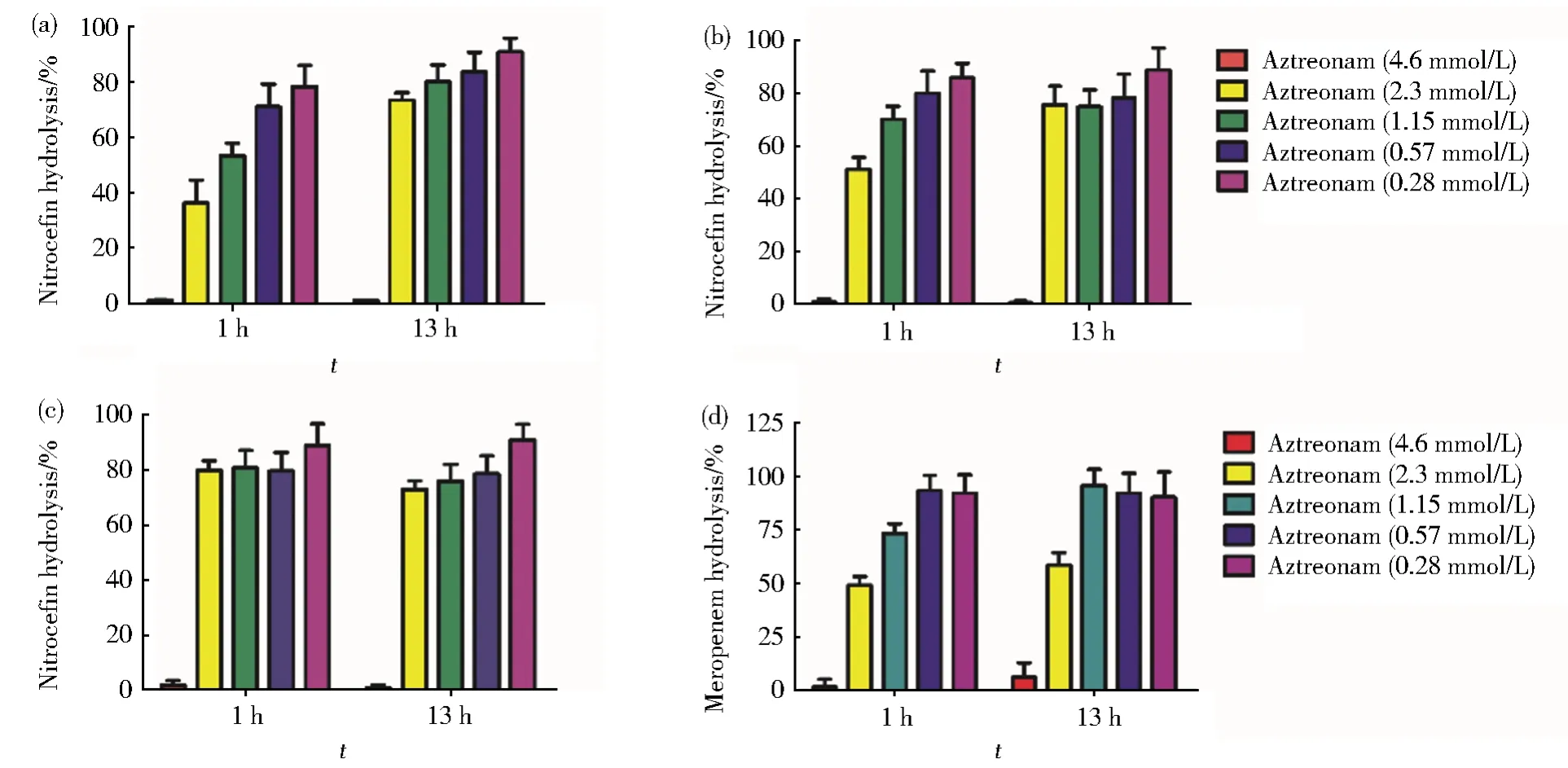
图2 评价氨曲南对NDM-1水解头孢硝噻吩和美罗培南的影响Fig.2 Evaluation of effect ofAztreonam on hydrolysis of Netrocefin and Meropenem by NDM-1
2.3 氨曲南与NDM-1稳定地结合抑制NDM-1对青霉素G的水解
为研究氨曲南抑制NDM-1水解头孢硝噻吩和美罗培南的机制,研究了氨曲南对固相在CPG玻璃珠上的NDM-1(以下简称NDM-1酶珠)对青霉素G(PG)水解的影响。发现以NDM-1酶珠处理5.4 mmol/L青霉素G和4.6 mmol/L氨曲南混合物时青霉素G的水解率只有(4.6±2.3)%,而以NDM-1酶珠处理无氨曲南共存条件下青霉素G的水解时青霉素G水解率高达(86.9±6.3)%(图3第1次处理数据)。以上数据说明NDM-1酶珠能够有效水解青霉素G,但在氨曲南与青霉素G以相似浓度共同存在的情况下,氨曲南能有效抑制NDM-1酶珠对青霉素G的水解。为进一步研究氨曲南抑制NDM-1水解头孢硝噻吩、美罗培南及青霉素G是否通过竞争性结合机制进行,第1次NDM-1酶珠处理的抗生素样品被充分洗掉,然后各NDM-1酶珠中再次加入5.4 mmol/L青霉素G进行反应。发现第1次处理时只加有青霉素G的NDM-1酶珠再次水解青霉素G后,青霉素G的水解率与第1次处理时相似高达(92.5±4.4)%。而第1次处理时共同加入青霉素G和氨曲南的NDM-1酶珠再次加入青霉素G进行反应后,虽然青霉素G水解率相对于第1次与氨曲南共处理时显著增加(54.7±13.3)% 相对于(4.6±2.3)%,但与第1次处理时只加入青霉素G的酶珠在第2次处理时对青霉素G的水解率(92.5±4.4)%相比仍然明显较低(图3中标记的第2次处理数据部分)。对第2次处理后的酶珠再次充分清洗后,并以与第2次处理酶珠相同的方式以5.4 mmol/L青霉素G第3次处理各酶珠,发现与第1次处理时只加入青霉素G处理的酶珠相比第1次处理时加入氨曲南共处理的酶珠对青霉素G的水解率仍然低30%左右(图3中标记的第3次处理数据部分)。这表明与青霉素G单独处理NDM-1酶珠不同,以氨曲南与青霉素G共同处理的NDM-1酶珠即使经过2轮的清洗仍然只能对新加入的青霉素G进行部分水解。氨曲南是通过与NDM-1形成稳定的复合物占据了头孢硝噻吩、美罗培南及青霉素G与NDM-1结合的位点从而对NDM-1水解这些抗生素起到了强烈的抑制作用。

图3 评价氨曲南对NDM-1酶珠水解青霉素G的影响Fig.3 Evaluation of effect ofAztreonam on hydrolysis of Penicillin G by NDM-1 immobilized CPG beads.
3 讨论
近年来联合应用氨曲南、头孢他啶-阿维巴坦治疗MBL表达的强耐药肠杆菌及假单胞铜绿杆菌在临床治疗和体外敏感性实验都观察到了好的结果[12-13]。然而其治疗机制仍然不完全清楚。本研究中首先以分光光度计的方法分析NDM-1对氨曲南的水解,但发现即使在相对高浓度NDM-1处理16 h的条件下氨曲南也没发生水解。氨曲南共处理能够显著抑制NDM-1对头孢硝噻吩和美罗培南的水解,且这种抑制呈剂量依赖性和时间依赖性(图2),这表明氨曲南可以抑制NDM-1对头孢类和碳青霉烯类β内酰胺类抗生素的水解。抑制活性随着氨曲南的浓度呈正相关说明氨曲南可能是通过竞争性结合NDM-1的活性位点而抑制NDM-1对两种抗生素的水解;抑制活性随着氨曲南处理酶水解反应的时间增加而减少说明这种抑制活性是可逆的。为了检验氨曲南抑制NDM-1对头孢硝噻吩和美罗培南的水解是否为竞争性抑制,研究氨曲南对固相化NDM-1水解青霉素G的影响,发现氨曲南同样可以抑制固相化NDM-1对青霉素G的水解,而且即使把固相化NDM-1外的游离氨曲南移除并经过多轮清洗后,固相化的NDM-1对青霉素G的水解活性仍然只有60%左右(图3)。这说明氨曲南可以通过与NDM-1强烈的结合而抑制NDM-1对青霉素G的水解。至此我们发现氨曲南不仅对NDM-1稳定,而且相对于其他三大类β内酰胺类抗生素有更强的NDM-1结合活性,从而还能作为NDM-1的抑制剂广谱性抑制NDM-1对β内酰胺类抗生素的水解,这意味着在氨曲南、头孢他啶及阿维巴坦联合治疗MBL表达的革兰氏阴性菌感染过程中,氨曲南还可能通过抑制MBL对头孢他啶的水解而增强该治疗方案的杀菌效率。本研究拓展了对联合应用氨曲南治疗广谱耐药菌机制的理解。

