枯草芽孢杆菌中胞壁肽的分离纯化及其对芽孢的影响
梁 栋,陈 芳,张 良,胡小松*
(1 中国农业大学食品科学与营养工程学院 北京100083 2 国家果蔬加工工程技术研究中心 北京100083)
芽孢是细菌在环境胁迫(如低温、干旱和营养缺乏等)下形成的休眠体。因其独特的结构特性而对高温、高压、干燥、辐射、低温、腐蚀性物质等具有极强的抗性。如何将芽孢杀灭一直是食品杀菌领域亟待突破的关键问题[1]。现阶段杀灭芽孢主要是靠传统的高温、高压的方法,然而高温、高压在杀灭芽孢的同时,也会引起食品营养流失,口感、风味等品质的严重下降。如何在常温下杀灭芽孢一直是食品领域研究人员的一大挑战。研究发现,当芽孢萌发后,其抗性消失,这也为杀灭芽孢提供了一个有效策略。如今,先萌发后杀灭是杀灭芽孢的一个最有效途径[2]。
肽聚糖是细菌细胞壁的主要成分,由N-乙酰葡萄糖胺(GlcNAc)和N-乙酰胞壁酸(MurNac)通过β-1,4 糖苷键连接聚合而成。与MurNac 相连的依次是L-Ala,γ-Glu,m-Dpm 和D-Ala。革兰氏阴性菌和阳性菌的主要区别在第3 个氨基酸,大多数阳性菌的第3 个氨基酸是L-Lys。胞壁肽是肽聚糖酶解后产物[3]。研究表明,含有Dpm 的胞壁肽是一种有效的萌发剂,能促进芽孢萌发。最小的有效结构单元的胞壁肽为二糖三肽,其二聚体或三聚体依然能诱导芽孢萌发[4]。现如今,国内还没有关于胞壁肽分离纯化的报道,也没有关于胞壁肽对芽孢萌发的影响研究。本文通过酶解等方法成功分离纯化了胞壁肽,研究胞壁肽对于芽孢萌发的影响,为后续研究奠定基础。
1 材料与方法
1.1 试验材料
枯草芽孢杆菌(Bacillus.subtilis 168),购自中国工业微生物菌种保藏管理中心(CICC)。
1.2 试验试剂
LB 液体培养基,北京索莱宝科技有限公司;Bacterial Agar(BD);α-淀粉酶、胰蛋白酶、变溶菌素,购买自美国Sigma 公司;其它试剂均为分析纯。
1.3 仪器及设备
倒置荧光显微镜,德国蔡司公司;高效液相色谱,日本岛津公司;超高效液相-质谱联用仪,美国沃特世公司;电热恒温培养箱,上海一恒科技有限公司;傅里叶变换红外光谱扫描仪,美国铂金埃尔默公司;500 兆核磁共振谱仪,瑞士布鲁克公司;压力蒸汽灭菌锅,上海申安医疗器械厂;多功能酶标仪,瑞士帝肯公司;均质破碎仪,美国Fastprep-24;冷冻离心机,日本日立公司。
1.4 试验方法
1.4.1 枯草芽孢杆菌芽孢的制备[5]菌种先用LB琼脂培养基活化3 代以上,接入2×SG 培养基中涂板培养。在37 ℃培养2 d 后,用相差显微镜镜检芽孢,当视野中大部分芽孢从母细胞中脱落后,用冷的无菌去离子水将培养基上的芽孢清洗收集到离心管中,离心条件为8 000 g、4 ℃、10 min,离心数次。离心过程中保证全程在低温条件中进行。离心后除去上清液,获得的芽孢沉淀重悬于ACES 缓冲液(0.05 mol/L,pH 7.0)中,最后用相差显微镜镜检,视野中≥95%的芽孢呈现明亮状方可使用。芽孢浓度约为1.0×108CFU/mL,存放于4 ℃冰箱,1个月内使用。
1.4.2 芽孢平板计数 将芽孢悬浮液进行梯度稀释,枯草芽孢杆菌芽孢采用营养琼脂培养基进行倾注平板计数,每个平板中加入1 mL 稀释菌液。枯草芽孢杆菌芽孢在37 ℃条件下进行培养,培养24 h。杀菌效果用芽孢减少的对数表示:lg(Nt/N0),其中,Nt为处理后存活的菌落数,N0为处理前菌落总数。
1.4.3 芽孢萌发试验 吸取适量芽孢液于离心管中,加入适量萌发剂。放置在摇床中培养1 h (37℃,200 r/min)。之后将芽孢液放入80 ℃水浴中加热20 min。平板计数计算芽孢萌发率。
1.4.4 肽聚糖的提取 采用枯草芽孢杆菌(Bacillus subtilis 168)的细胞壁提取肽聚糖[6-7]。购买的菌种在液体培养基中活化3 代后使用。将枯草芽孢杆菌接种到LB 琼脂培养基上,于37 ℃培养24 h。取新鲜单菌落接种到适量的LB 液体培养基中培养至OD600约1.0,离心收集菌体(8 000×g、4 ℃、10 min),用冷的无菌去离子水清洗2 次。将沉淀重新悬浮于8% SDS 溶液中,煮沸30 min,离心(13 000×g,15 min,25 ℃)收集沉淀,清洗数次直至除去残留的SDS。SDS 处理除去了菌体的其它蛋白质,非共价结合的脂蛋白和脂多糖。将沉淀溶于无菌去离子水中均质破碎仪破碎细菌,不溶性细胞壁组分再通过离心收集(40 000×g,30 min,25℃)。收集的不溶性细胞壁进一步用α-淀粉酶、胰蛋白酶进行酶解,以除去细胞壁上的糖原、共价结合的蛋白质。以上两步酶解均在缓冲液中进行(10 mmol/L Tris-HCl,pH 8.0),在胰蛋白酶中需要加入10 mmol/L CaCl2。将酶解液加入SDS(终质量分数1%)煮沸钝化胰蛋白酶,并清洗除去SDS。将细胞壁重新悬浮于氢氟酸(5 mg 细胞壁悬浮于2 mL 48% HF)中,4 ℃处理48 h。HF 可以除去肽聚糖上磷酸二酯键共价连接的次生细胞壁多糖,包括磷壁酸、poly-(β,1-6 GlcNAc)等。细胞壁组分再分别采用8 mol/L LiCl 和0.1 mol/L EDTA 清洗,无菌水清洗2 次,最后采用丙酮除去脂磷壁酸和脂多糖。将样品冻干,得到肽聚糖。
1.4.5 胞壁肽分离纯化 将提取的肽聚糖悬浮于12.5 mmol/L 磷酸盐缓冲液 (1 mmol/L MgCl2,pH 6.0,0.02% 叠氮化钠)中,加入5 μg/mL 变溶菌素,于37 ℃酶解24 h。酶解的胞壁肽需要采用硼氢化钠还原,防止Cl 的异构化。将胞壁肽悬浮于100 mL 0.5 mol/L 的硼酸盐缓冲液(pH 9.0)中。胞壁肽还原采用新鲜配制的25 mL,25 mg/mL NaBH4,在加入过程中使pH 保持在9.0。还原反应在室温中保持15 min 并不停地振荡,加入H3PO4使反应终止,将pH 调至4。所得样品保存在-20℃。还原的胞壁肽采用HPLC (Shimadzu)分离,ODS 色谱柱 (Hypersil octadecylsilane column,250 mm×4.6 mm,颗粒:5 μm,30105-254630,Thermo Fisher Scientific)。洗脱液分别是:A,40 mmol/L 磷酸钠(pH 4.5);B,40 mmol/L 磷酸钠(pH 4.0)并加入20%(体积分数)甲醇。A、B 流动相中加入0.00025%的叠氮化钠。色谱柱平衡柱子采用流动相A,柱温52 ℃,流速0.5 mL/min,平衡1 h。可溶性胞壁肽进样100 μL,进样5 min 后,洗脱程序为B 流动相以线性梯度从0 到100%,时间为5 min到270 min,流动相流速保持在0.5 mL/min。胞壁肽组分检测采用紫外检测器,波长为206 nm[8-9]。
1.4.6 胞壁肽组分脱盐[10]胞壁肽组分冻干后重新悬浮于无菌超纯水中,采用HPLC 法进行脱盐,色谱柱为前述分离柱。柱子采用0.007%(体积分数)三氟乙酸平衡,柱温35 ℃,流速1 mL/min,胞壁肽采用50%甲醇(0.0025%三氟乙酸)线性梯度(0~100%)洗脱,洗脱时间在30~50 min 之间,胞壁肽组分检测采用紫外检测器,波长为206 nm。
1.4.7 三重四级杆串联质谱鉴定 脱盐的胞壁肽组分采用三重四级杆串联质谱仪(Quattro Micro,Micromass)进行鉴定。全扫描模式(MS Scan)质谱条件:正离子(ESI+)数据采集模式产生准分子离子峰[M+H]+;m/z 扫描范围100~2 000 u;毛细管电压3.5 kV;锥孔电压40 V;萃取电压5.0 V;离子源温度110 ℃;脱溶剂温度450 ℃;脱溶剂气650 L/h;锥孔反吹气50 L/h;RF 透镜电压0.5 V。
1.4.8 红外扫描光谱 采用压片法将1.5 mg 冻干的GM-TriDAP 与200 mg 干燥的KBr 在玛瑙研钵中混合研磨均匀,置于磨具中,用压片机进行压片(压力为20~30 MPa)1 min,取下后得到透明的样品薄片,用傅里叶变换红外谱仪进行红外光谱的扫描,扫描范围4 000~500 cm-1。
1.4.91H NMR 将2 mg 冻干的GM-TriDAP 样品溶于1 mL D2O 中,冷冻干燥并重复3 次将糖肽中的活泼H 置换,溶于0.5 mL D2O 中后置于核磁管中,核磁共振分析采用500 兆核磁共振谱仪,室温20 ℃,500 MHz 作氢谱。
1.5 数据统计与分析
所有试验均重复3 次。绘图使用Origin 8.5软件。
2 结果与分析
2.1 胞壁肽HPLC 分析
肽聚糖是由N-乙酰葡糖胺 (GlcNAc)、N-乙酰胞壁酸(MurNAc)及肽单元组成的聚合体,肽链氨基酸的组成主要是Ala、Glu、DAP,还有极少量的Gly,大多数G-及产孢菌具有meso-DAP 残基。对枯草芽孢杆菌细胞壁的肽聚糖采用变溶菌素酶解,其片段经硼氢化钠还原后,采用HPLC 进行胞壁肽的分离,得到胞壁肽谱图(图1)。从图中可以看出,枯草芽孢杆菌的胞壁肽主要含有15 个胞壁肽组分,主要的峰8 个。肽聚糖经过变溶菌素酶解后,形成以GlcNAc-MurNAc-L-Ala-D-Glu-meso-DAP 为基本结构单元的二聚体、三聚体、四聚体等[3]。这些胞壁肽组分分子质量越大,保留时间越长,因此,单体目标峰出峰时间较早。Atrih 等[3]对枯草芽孢杆菌的胞壁肽进行分析,得到38 个组分,在20 min 保留时间内的前4 个组分均为胞壁肽单体,个别组分基团出现酰胺化而保留时间不同。此结果也与文献报道相一致。
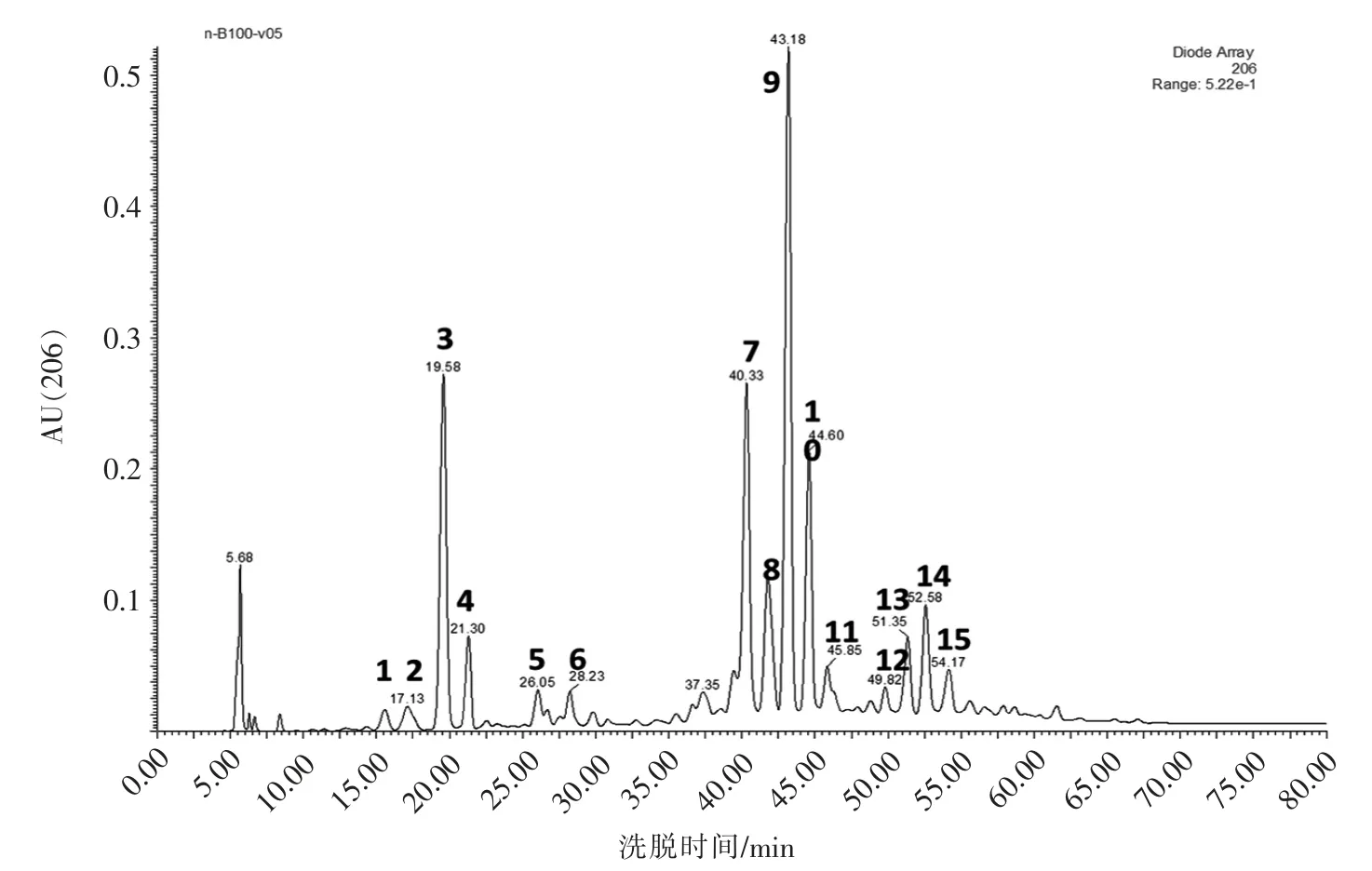
图1 枯草芽孢杆菌的胞壁肽HPLC 色谱图Fig.1 Peptidoglycan muropeptides from B.subtilis 168 separated by reversed-phase HPLC
2.2 胞壁肽ESI-MS 分析
对每个组分单峰收集,脱盐后进行ESI-MS分析,通过对3 号峰的MS 分析(图2),其分子离子[M]+为m/z 869,伴峰:[M+H]+为m/z 870,该分子质量组成与GlcNAc-MurNAc-L-Ala-D-GlumesoDAP(理论值:869.9)一致[11],伴峰的形成是因为在正离子模式下,目的片段会在电离过程中加一个氢,分子质量增加。因此,峰3 即为目标物二糖三肽(GM-TriDAP),其结构示意图如图2所示。
2.3 胞壁肽FTIR

图2 胞壁肽峰3 的质谱图Fig.2 MS analysis of muropeptides 3
对胞壁肽3 号峰单峰收集,冷冻干燥后进行傅里叶变换红外光谱分析,红外光谱图见图3所示,从图中可以看出,在2 个区域存在强吸收,一个是~3 447 cm-1,另一个是~1 020 cm-1。肽链的几个特征带包括酰胺A 带(~3 500 cm-1)、酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 510~1 580 cm-1)。酰胺A 带主要是N-H 伸缩振动,对氢键非常敏感;酰胺Ⅰ带是肽链的主要特征带,主要是C=O和C-N 的伸缩振动;而酰胺Ⅱ带主要是N-H 面内变角振动,以及C-N 和C-C 的伸缩振动[12]。糖环的特征峰集中在800 cm-1~1 200 cm-1之间,包括C-OH 的伸缩振动和糖苷键C-O-C 的振动叠加吸收信号。峰3 的红外光谱的吸收峰归类见表1所示,从表中可以看出,胞壁肽3 号峰包涵糖肽的典型基团振动特征,一个是肽链的酰胺吸收带,包括3 447 cm-1的酰胺A 带、1 647 cm-1的酰胺Ⅰ带;另一个是在1 200~800 cm-1,1 020 cm-1是糖环以及糖苷键的特征吸收峰[8]。因此,胞壁肽3 号峰具有典型的糖肽结构特征。
2.4 1H NMR
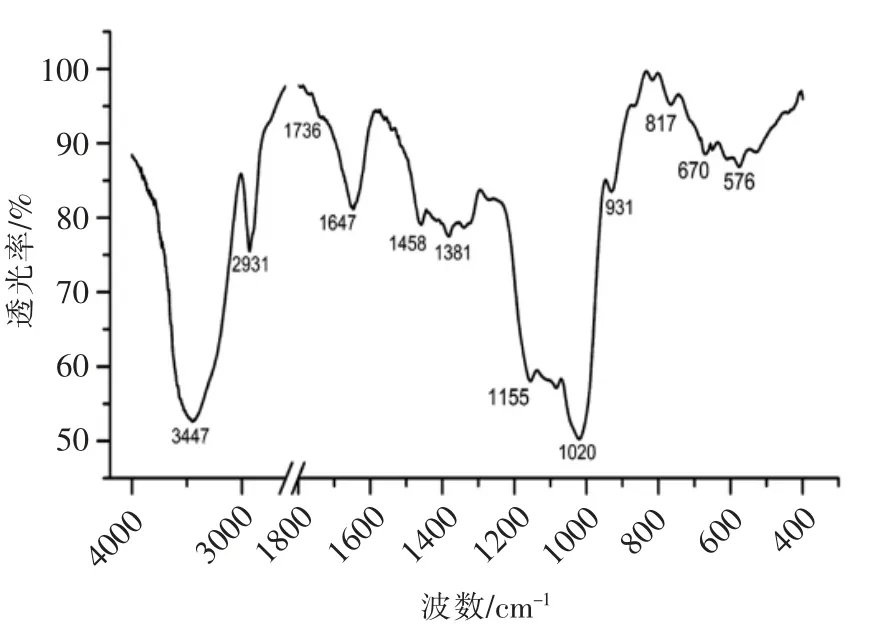
图3 胞壁肽峰3 的FT-IR 谱图Fig.3 FT-IR spectroscopy of muropeptides 3
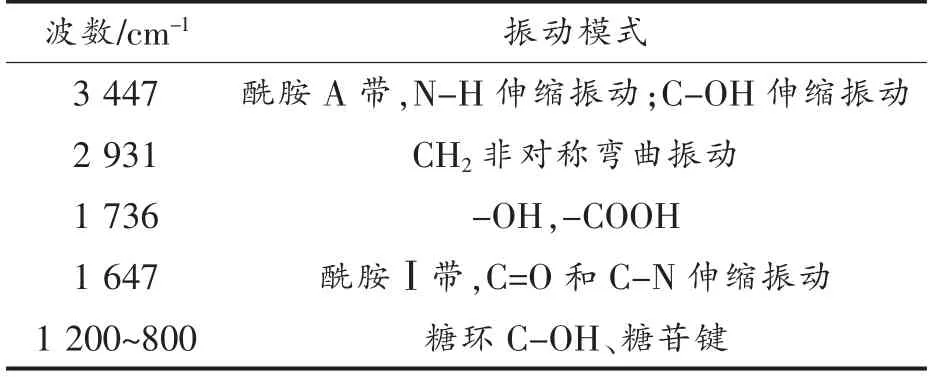
表1 红外谱的波数与基团振动模式Table 1 Wave number and group vibration mode in infrared spectrum
氢谱是所有核磁共振谱中灵敏度最高的,可以为化合物提供丰富的结构信息。对胞壁肽3 号峰的结构进行氢谱分析,检验其是否与GlcNAc-MurNAc-L-Ala-D-Glu-mesoDAP 结构相符。氢谱中各官能团的化学特性主要体现在化学位移上,氢原子核外电子云密度越大,化学位移越小,出峰位置越靠近右方。1H NMR 谱见图4所示,从图中可以看到典型的胞壁肽信号模式,糖肽官能团本身的性质、取代基等都会对物质的化学位移产生影响,从而改变官能团出峰位置,糖环和肽链表现不同的化学位移[13]。在前人针对肽聚糖片段核磁分析的基础上[14],对胞壁肽3 号峰氢谱的化学位移进行归属,GlcNAc、MurNAc 和肽链氨基残基的典型信号介于4.7×10-6~3.3×10-6之间,4.67 是GlcNAc 异头碳原子上的质子共振信号;对于甲基和脂肪烃的亚甲基质子化学位移介于2.5×10-6~1.1×10-6之间。综合上述分析,胞壁肽峰3 的1H NMR 与目标糖肽结构相符。
2.5 胞壁肽对芽孢萌发的影响
芽孢萌发后热抗性消失,湿热处理(80 ℃,20 min)不能直接杀灭芽孢,但可将萌发的芽孢杀灭[15-16]。因此,热抗性消失经常用来表征芽孢是否经历了萌发[5]。为验证本文中得到的胞壁肽是否具有萌发效果,将制备的胞壁肽加入到枯草芽孢杆菌168 芽孢液中混合均匀(胞壁肽终质量浓度为1 mg/mL),37 ℃振荡孵育1 h。随后,将胞壁肽处理后的芽孢进行湿热处理(80 ℃,20 min),利用平板计数法计算湿热处理前后芽孢数量的变化即为萌发芽孢的数量。胞壁肽对枯草芽孢杆菌168 芽孢萌发的影响如图5所示。未加入胞壁肽的处理组中,芽孢数经湿热处理后并未减少,说明芽孢仍保持原有的热抗性,并未发生萌发过程。而加入胞壁肽后的芽孢经湿热处理后数量减少了0.9 个对数,说明0.9 个对数的芽孢在胞壁肽处理后热抗性消失,发生了萌发,与前人研究结果相一致[17]。由此可知,本试验中制备的胞壁肽(二糖三肽)能诱导芽孢萌发,为后续进一步研究胞壁肽诱导芽孢萌发机理奠定基础。
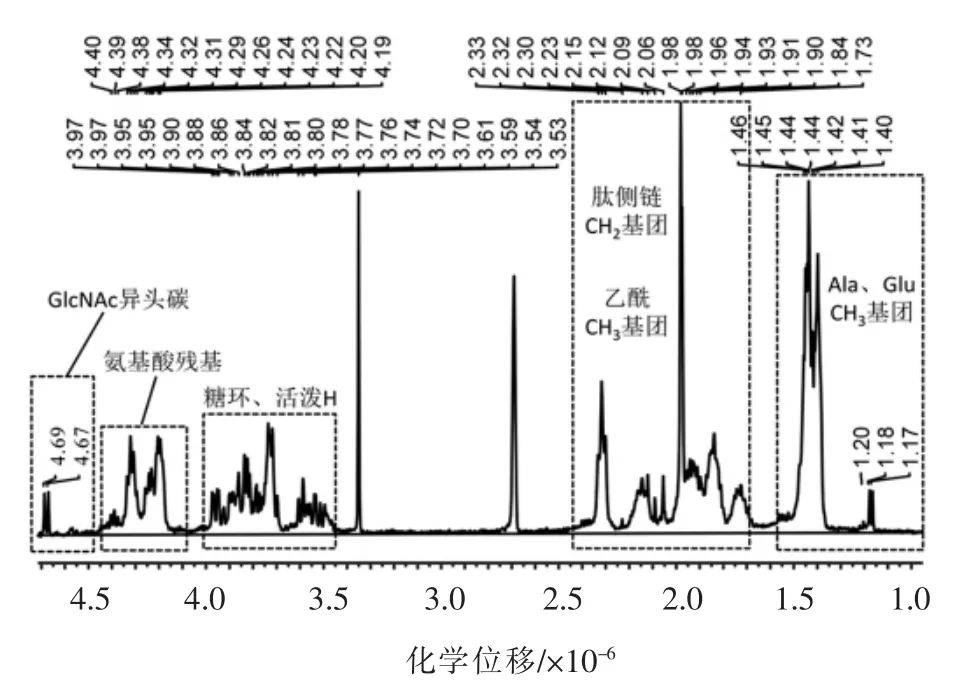
图4 胞壁肽峰3 的1H NMR 谱图Fig.4 1H NMR spectrum of muropeptides 3

图5 不同处理对枯草芽孢杆菌168 芽孢萌发的影响Fig.5 The effect of different treatments on the germination of B.subtilis 168 spores
3 结论
利用枯草芽孢杆菌为对象,制备、分离纯化细菌营养体细胞壁上的胞壁肽,得到的胞壁肽最小单位为二糖三肽,此胞壁肽可以有效促进芽孢萌发,为芽孢萌发的进一步研究奠定基础。

