土壤微生物群落对麻栎-刺槐混交林凋落物分解的影响
董学德,高 鹏,*,李 腾,张佳辰,董金伟 ,许景伟,囤兴建
1 山东农业大学林学院,泰山森林生态系统国家定位观测研究站, 泰安 271018 2 山东省林业科学研究院, 济南 250014
森林凋落物分解是一个由生物因素和非生物因素引起的物理、化学性质的变化[1-2]。影响凋落物分解的因素主要包括凋落物质量、气候因素等非生物因素和生物因素,其中,生物因素是影响凋落物分解的主导因子,非生物因素一部分是通过影响生物因素发挥作用[3]。土壤微生物作为连接植物和土壤的重要生物因子,不仅能通过产生各种酶水解和氧化凋落物,而且能够进行氨化、硝化、固氮等过程,改变凋落物的结构和化学组成[4]。土壤微生物多样性是指生命体在遗传、种类和生态系统层次上的变化,代表着微生物群落的稳定性。在凋落物分解过程中,土壤微生物群落会对外界环境的变化迅速作出响应,微生物多样性也会发生变化,进而影响凋落物的分解速率[5]。因此,关于土壤微生物群落多样性对森林凋落物分解过程的影响机制研究受到人们普遍关注[1,6]。
近些年,许多学者针对凋落物质量和环境因素对凋落物分解速率的影响进行了较为全面的研究[7-8]。但是,土壤微生物作为影响凋落物分解的关键因子尚缺少系统的研究,混交林土壤微生物多样性与凋落物分解速率的关系尚不明确。山东泰安市黄前流域是国家级水土流失重点治理区,麻栎林及其刺槐混交林是该区域重要的生态造林类型。开展麻栎-刺槐混交林凋落物分解过程中土壤微生物群落多样性变化特征及其对分解速率的影响的研究,可为该区域生态修复树种选择和综合效果评价提供重要理论依据。因此,以麻栎-刺槐混交林和麻栎纯林为研究对象,采用野外定点采样、室内分析和高通量测序相结合的方法,对麻栎-刺槐混交林和麻栎纯林凋落物分解过程中,土壤细菌、真菌群落多样性特征及其对凋落物分解速率的影响进行研究,有助于深入了解混交林凋落物分解速率与土壤微生物群落的关系。
1 材料与方法
1.1 研究区概况
研究区位于山东泰安市黄前流域(117°04′—117°22′E,36°17′—36°27′N),属于黄河下游大汶河流域,是国家级水土流失重点治理区,总面积292.2 km2,海拔310—950 m,平均海拔530 m。属暖温带大陆性半湿润季风气候,年平均气温为18.5℃,年平均降水量758 mm,75%的降水集中在6—9月,无霜期197 d,≥10℃的活动积温3819℃,多年平均日照时数2640 h,土壤类型为棕壤(表1)。研究区位于国家级重点生态防护林区,森林覆盖率为96%,植被类型为暖温带落叶阔叶林,主要树种为麻栎(QuercusacutissimaCarruth.)、刺槐(RobiniapseudoacaciaL.)、赤松(PinusdensifloraSieb. et Zucc.)、日本落叶松(Larixkaempferi(Lamb.)Carr)等。

表1 研究区标准地基本状况
1.2 研究方法
1.2.1凋落物采样
于2019年4月,选择立地条件相近的麻栎-刺槐林混交林和麻栎纯林林地,在每个林地随机设置3个20 m×20 m的标准样地,并在每个标准样地随机设置3个2 m×2 m采样样方。采样时为保证凋落物的新鲜程度一致,只收集样方内现存在的尚未分解的完整凋落叶和树枝(树枝数量极少且为细枝)作为试验样品。将试验样品带回实验室,剔除其中的泥土等杂质,并将树枝剪成5 cm左右,置于室内风干,然后在85℃下烘干至恒重。将凋落叶和树枝混合均匀后称取16 g(精确到0.001 g)烘干的原状样品,装入带有编号的分解袋(孔径0.2 mm,规格为16 cm×26 cm)中。取上述麻栎-刺槐和麻栎凋落物,测定凋落物初始TOC、TN、TP浓度。2019年5月将麻栎-刺槐混合凋落物(混合比例为:麻栎∶刺槐=12∶4)置于麻栎-刺槐混交林采样样方内,麻栎凋落物置于麻栎纯林采样样方内,用竹签固定,让其在自然条件下分解。在凋落物分解30、60、90、120、150、180、210、240 d时,在各个采样样方内随机取3个分解袋,带回实验室,将凋落物烘干、称重,测定分解速率;然后,用粉碎机粉碎,过0.149 mm筛子,测定TOC、TN、TP浓度。
1.2.2土壤微生物测定样品采样
土壤微生物测定样品的采样时间为凋落物初次放置及分解120、240 d时,采样点位于凋落物采样样方内。在每个采样样方内,采用五点取样法取0—20 cm的土壤混合均匀后装于试管,立即放于液氮内保存。每次采样麻栎-刺槐混交林和麻栎纯林各得9个(每种林分包括3块标准样地,每块标准样地包括3个采样区域)土壤样本,用于测定土壤细菌和真菌群落结构。
1.2.3样品测定
凋落物:TOC浓度测定采用K2Cr2O7容量法—外加热法;TN浓度测定采用半微量开氏法消煮法;TP浓度测定采用钼锑抗比色法测定[9]。
土壤微生物:采用CTAB方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度。土壤细菌多样性的检测:引物扩增区域为16S V3-V4;引物名称及序列:341F:CCTACGGGRBGCASCAG;806R:GGACTACNNGGGTATCTAAT[10]。土壤真菌多样性检测:引物扩增区域为ITS1;引物名称及序列:ITS5-1737F:GGAAGTAAAAGTCGTAACAAGG;ITS2-2043R:GCTGCGTTCTTCATCGA TGC[11]。PCR扩增体系:2*taq PCR mix:25.0 μL,Primer F (10 μM):1.0 μL,Primer FR(10 μM):1.0 μL,gDNA:2.5 μL,H2O:8.0 μL。PCR反应程序为:95℃预变性5 min,34个循环 (94℃,1 min; 57℃,45 s;72℃,1 min);72℃,10 min;16℃,5 min[10]。使用New England Biolabs 公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR。产物纯化试剂盒使用的是Thermo Scientific 公司GeneJET 胶回收试剂盒。使用Thermofisher 公司的Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。
1.3 数据处理与分析
凋落物质量残留率:凋落物分解一段时间后剩余的质量与凋落物初始质量比值[12],即:
RM=Mt/M0×100%
式中,RM为凋落物质量残留率(%);Mt为凋落物分解t时刻的质量(g);M0为凋落物的初始质量(g)。
凋落物分解的Olson模型:凋落物分解是一个动态过程,凋落物质量残留量与分解时间存在负指数函数关系[13],即:
Mt/M0=ae-kt
式中,a为修正参数;k为凋落物分解速率;t为凋落物分解时间(a)。凋落物分解50%(t50%)和分解95%(t95%)所需的时间分别为:
t50%=-ln0.5/k
t95%=-ln0.05/k
凋落物元素释放率:凋落物分解一段时间内释放的元素量与凋落物初始元素含量比值的百分数,即:
E=[(E0-Et)/E0]×100%
式中,E为凋落物元素释放率(%);Et为凋落物分解t时刻凋落物质量与元素浓度的乘积(g);E0为凋落物的初始质量与元素浓度的乘积(g)。当百分数大于0时,说明凋落物中的元素发生了净释放;当百分数小于0时,说明凋落物中的元素发生了净积累[14]。
土壤微生物Alpha多样性:微生物菌群Alpha多样性可以分为菌群丰富度指数(Community richness index)和菌群多样性指数(Community diversity index)。菌群丰富度指数主要包括Chao1和ACE,用于评估群落中含有的微生物物种总数,菌群多样性指数主要包括Simpson和Shannon,用于评估微生物的多样性[15]。
使用Uparse软件对所有样品的全部有效数据在97%相似度水平下进行聚类,获得Operational Taxonomic Units(OTU),统计各个土壤样品每个OTU中的丰度信息。使用Qiime 1.9.1软件计算两种林分土壤细菌、真菌群落的Alpha多样性指数值。使用R 3.5.1进行数据分析,麻栎-刺槐混交林和麻栎纯林分解过程中土壤微生物优势类群间的差异采用单因素方差分析;采用T检验分析微生物菌群丰富度指数和菌群多样性指数值在麻栎-刺槐混交林和麻栎纯林之间的差异;对麻栎-刺槐混交林和麻栎纯林凋落物的分解速率与土壤微生物菌群丰富度指数和菌群多样性指数值之间的相关性进行Spearman相关分析。其余相关图的制作使用R 3.5.1的“ggplot2”包完成。
2 结果与分析
2.1 麻栎-刺槐混交林和麻栎纯林凋落物分解动态特征
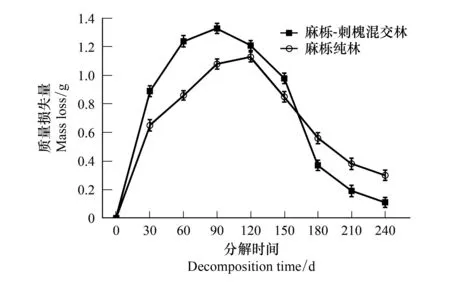
图1 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中的质量损失量动态变化Fig.1 Dynamics changes of mass loss during litter decomposition of QR and QAC图中数据为平均值±标准差(n=3)
在凋落物分解期间(2019年5月至2020年1月),麻栎-刺槐混交林和麻栎纯林凋落物质量损失量均表现出先增加后减小的趋势(图1)。麻栎-刺槐混交林凋落物质量损失量在0—90 d逐渐增大,此后逐渐降低,累积质量损失6.32 g;麻栎纯林凋落物质量损失在0—120 d逐渐增大,120 d后逐渐降低,累积质量损失6.21 g。麻栎-刺槐混交林凋落物质量损失量在0—150 d高于麻栎纯林凋落物质量损失量,此后低于麻栎纯林。
麻栎-刺槐混交林和麻栎纯林凋落物质量残留率与分解时间符合Olson负指数模型(图2)。麻栎-刺槐混交林凋落物分解速率高于麻栎纯林的,麻栎-刺槐混交林凋落物分解速率0.70,分解240 d后质量残留率为60.2%,分解50%所需时间为0.99 a,分解95%所需时间为4.28a;麻栎纯林凋落物分解速率0.62,分解240 d后质量残留率62.8%,分解50%所需时间为1.12 a,分解95%所需时间为4.83 a。

图2 麻栎-刺槐混交林和麻栎纯林凋落物残留率与时间的Olson负指数回归关系Fig.2 Olson negative index regression relation between litter residues and time of QR and QAC
在凋落物分解过程中,凋落物的TOC、TN、TP浓度在麻栎-刺槐混交林和麻栎纯林之间存在差异(图3)。麻栎-刺槐混交林凋落物TOC浓度低于麻栎纯林的,麻栎纯林平均TOC浓度是麻栎-刺槐混交林的1.2倍,并且两种林分TOC浓度总体呈波动降低的趋势(图3)。麻栎-刺槐混交林凋落物TN浓度高于麻栎纯林的,麻栎-刺槐混交林凋落物平均TN浓度是麻栎纯林的1.2倍,两种林分TN浓度总体呈波动升高趋势(图3)。麻栎-刺槐混交林凋落物TP浓度高于麻栎纯林的,麻栎-刺槐混交林凋落物TP浓度是麻栎纯林的1.1倍,两种林分TP浓度在0—120 d逐渐升高,此后至240 d逐渐降低(图3)。

图3 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中TOC、TN、TP浓度变化特征Fig.3 Dynamics of TOC, TN and TP concentrations during litter decomposition of QR and QAC图中数据为平均值±标准差(n=3)
在凋落物分解240 d后,麻栎-刺槐混交林和麻栎纯林凋落物TOC、TN、TP均发生净释放,且麻栎-刺槐混交林释放率高于麻栎纯林(表2)。麻栎-刺槐混交林和麻栎纯林凋落物TOC释放率表现为逐渐增大的趋势,在分解第240 d时释放率达到最大值,分别为47.4%和46.3%。TN释放率在麻栎-刺槐混交林凋落物中表现为逐渐增加的趋势,在240 d达到最大值,为26.3%;TN释放率在麻栎纯林凋落物中表现为先增加后减小的趋势,在120 d时达到最大值,为22.8%。TP在麻栎-刺槐混交林和麻栎纯林凋落物中表现出先积累后释放的趋势,麻栎-刺槐混交林发生积累的时间比麻栎纯林的长,并且均在240 d时达到最大值。

表2 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中TOC、TN、TP释放率变化特征 (平均值±标准差)
2.2 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中土壤微生物群落变化特征
土壤微生物群落结构的变化主要是优势类群的变化引起的[16],因此,本试验只对土壤细菌和真菌优势类群进行重点分析。在麻栎-刺槐混交林和麻栎纯林凋落物的分解过程中,土壤细菌优势类群为放线菌门(Acidobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)(图4)。两种林分四种细菌优势类群相对含量之间存在显著差异(P<0.05),放线菌门的相对含量显著高于变形菌门、酸杆菌门和疣微菌门。土壤细菌优势类群的相对含量在麻栎-刺槐混交林和麻栎纯林之间存在显著差异(P<0.05),麻栎-刺槐混交林的放线菌门、变形菌门和疣微菌门的相对含量高于麻栎纯林,酸杆菌门相对含量低于麻栎纯林。土壤真菌优势类群为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和被孢霉门(Moritierellomycota)(图4)。两种林分3种真菌优势类群相对含量之间存在显著差异,担子菌门的相对含量显著高于子囊菌门和被孢霉门(P<0.05)。土壤真菌优势类群的相对含量在麻栎-刺槐混交林和麻栎纯林间存在显著差异(P<0.05)。麻栎-刺槐混交林中担子菌门的相对含量高于麻栎纯林的,两种林分土壤担子菌门的相对含量为70.4%—85.1%和41.9%—64.2%;麻栎-刺槐混交林土壤子囊菌门的相对含量显著低于麻栎纯林的(P<0.05),两种林分土壤子囊菌门的相对含量为6.6%—8.0%和24.5%—29.8%;麻栎-刺槐混交林被孢霉门的相对含量显著高于麻栎纯林,其土壤被孢霉门的相对含量为1.4%—2.8%和1.5%—3.9%。

图4 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中土壤细菌和真菌优势类群相对含量变化Fig.4 Relative content changes of soil bacterial and fungal dominant communities during litter decomposition of QR and QACQR:麻栎-刺槐混交林Mixed Quercus acutissima Carruth. and Robinia pseudoacacia L. forest; QAC:麻栎纯林Pure Quercus acutissima Carruth forest; QR1、QR2、QR3分别代表麻栎-刺槐混交林凋落物初次放置、分解120、240 d时土壤微生物取样,QAC1、QAC2、QAC3分别代表麻栎纯林凋落物初次放置、分解120、240 d时土壤微生物取样;图中数据为样本平均值(n=3)
在麻栎-刺槐混交林凋落物分解过程中,微生物菌群丰富度指数和菌群多样性指数发生显著变化(表3)。细菌菌群丰富度指数(Chao1指数和ACE指数)呈现先增大后减小的趋势,在分解120 d时达到最大值,在分解240 d时显著降低。细菌菌群多样性指数(Shannon指数和Simpson指数)均呈先增大后减小的趋势,在分解240 d时显著降低。真菌菌群丰富度指数呈先减小后增大的趋势,在初次放置时达到最大值,此时显著高于凋落物初分解120、240 d时,分解中期达到最小值。真菌菌群多样性指数呈逐渐减小的趋势,但在不同分解时间差异不显著。
在麻栎纯林凋落物分解过程中,微生物菌群丰富度指数和菌群多样性指数发生显著变化(表3)。细菌菌群丰富度指数呈先增加后减小的趋势,不同分解时间存在显著差异,在分解120 d时达到最大值,分解240 d时达到最小值。细菌菌群多样性指数呈先增大后减小的趋势,在分解240 d时显著降低。真菌丰富度指数呈逐渐减小的趋势,凋落物初次放置时显著高于分解120、240 d,在分解240 d时达到最小值。真菌多样性指数呈先减小后增加的趋势,凋落物初次放置时显著高于分解120、240 d。
麻栎-刺槐混交林土壤微生物菌群丰富度指数和菌群多样性指数变化范围小于麻栎纯林(表3)。麻栎-刺槐混交林细菌Chao1和ACE指数的最大值是最小值的2.2倍和2.1倍,麻栎纯林细菌Chao1和ACE指数最大值是最小值的3.0倍和2.9.倍;麻栎-刺槐混交林细菌Shannon和Simpson指数的最大值是最小值的1.1倍和1.0倍,麻栎纯林细菌Shannon和Simpson指数最大值是最小值的1.3倍和1.0倍。麻栎-刺槐混交林真菌Chao1和ACE指数最大值均是最小值的1.1倍,麻栎纯林真菌Chao1和ACE最大值均是最小值的1.5倍;麻栎-刺槐混交林真菌Shannon和Simpson指数最大值是最小值的1.1倍和1.0倍,麻栎纯林细菌Shannon和Simpson指数最大值是最小值的1.3倍和1.1倍。
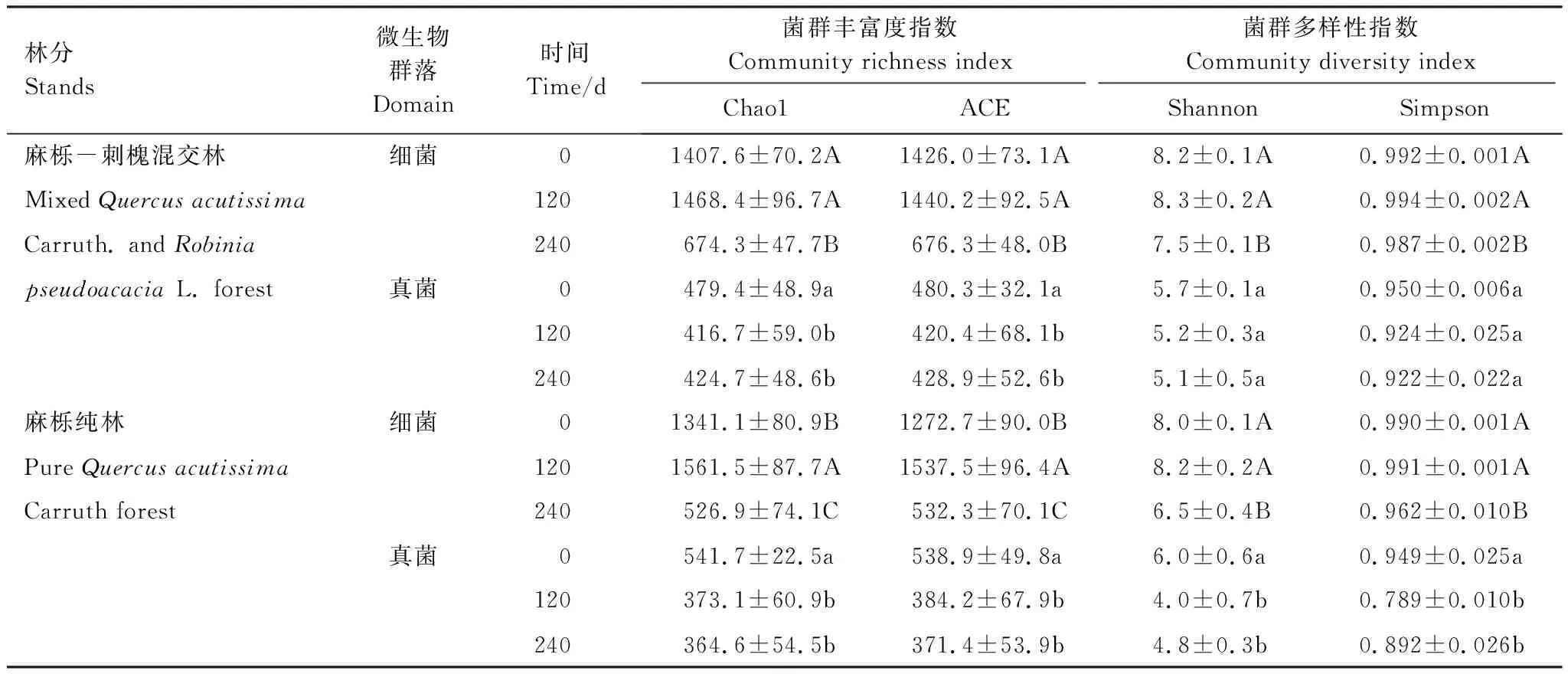
表3 麻栎-刺槐混交林和麻栎纯林土壤细菌、真菌菌群丰富度指数和多样性指数(平均值±标准差)
2.3 麻栎-刺槐混交林和麻栎纯林凋落物分解速率与土壤微生物多样性的关系
试验观测时间为2019年5月—2020年1月。为研究两种林分凋落物分解速率与土壤微生物多样性的关系,以2019年5—7月,2019年8—10月,2019年11月到2020年1月的凋落物月平均质量损失量分别代表3次土壤微生物取样时凋落物的分解速率,然后与土壤微生物菌群丰富度指数、菌群多样性指数值之间进行Spearman 相关分析。结果表明,两种林分凋落物分解速率与细菌菌群丰富度指数(Chao1和ACE指数)呈显著正相关,与细菌菌群多样性指数(Shannon和Simpson指数)呈显著正相关(表4)。两种林分凋落物分解速率与真菌菌群丰富度指数(Chao1和ACE指数)呈显著正相关,与真菌菌群多样性指数(Shannon和Simpson指数)呈正相关但未达到显著水平。

表4 麻栎-刺槐混交林和麻栎纯林凋落物分解速率与土壤微生物菌群丰富度指数、多样性指数的相关系数
3 讨论
3.1 麻栎-刺槐混交林和麻栎纯林凋落物分解过程中元素迁移特征
在凋落物分解过程中会伴随着元素含量的变化,这与凋落物类型、分解环境、分解时间以及元素本身的特点有关[17-18]。碳是组成植物干物质的重要元素,凋落物分解后,碳一部分会被植物根系吸收后重新利用,一部分会固定在土壤团聚体中[19]。本研究发现,在凋落物分解过程中,麻栎-刺槐混交林和麻栎纯林凋落物的TOC浓度整体呈现出下降的趋势(图3),而且TOC残留率小于100%(表2)。这是因为在凋落物分解初期,由于可溶性物质的淋溶作用,凋落物TOC含量会迅速减少;随分解的进行,大分子有机物逐渐降解为小分子有机物,并被微生物和土壤动物等吸收转换,凋落物TOC含量继续减少,所以TOC在整个分解过程中表现出净释放[20]。
氮是植物氨基酸、蛋白质、核酸的重要组成元素,凋落物中的氮元素通过土壤微生物的氨化和硝化作用转化成可被植物吸收的NH4+和NO3-,引起凋落物TN含量发生变化[21]。在本研究中,麻栎-刺槐混交林和麻栎纯林凋落物TN浓度随分解的进行表现出增加的趋势(图3),但是TN含量表现为净释放(表2)。凋落物TN的释放或积累与凋落物中TN浓度有关,在TN浓度满足微生物生长时表现为净释放,反之,表现为净积累[22]。本研究中,麻栎-刺槐混交林凋落物TN平均浓度为16.6 g/kg,麻栎纯林凋落物TN平均浓度为13.6 g/kg,两种林分的凋落物TN浓度均高于全球平均水平10.9 g/kg[23],认为凋落物TN浓度处于较高水平,可以满足微生物正常生长、发育、繁殖的需求,微生物物会不断分解凋落物中的含氮有机物,所以TN表现为净释放[20]。
磷是组成植物遗传物质的重要元素,磷的释放和积累对维持植物正常的生长代谢具有重要意义[24]。本研究发现,凋落物分解过程中,麻栎-刺槐混交林和麻栎纯林凋落物TP浓度表现出先升高后降低的趋势(图3),TP在前期表现出净积累的过程中,随后表现出净释放的过程(表2)。这是因为在凋落物分解前期TP浓度较低,还不能被微生物利用,所以会发生暂时的性积累。随着分解的进行,凋落物内部结构发生变化,TP浓度逐渐升高,此时凋落物内的TP在微生物作用下被矿化,再表现出TP净释放[20,25]。
研究发现,麻栎-刺槐混交林凋落物TOC、TN、TP释放率高于麻栎纯林(表2)。这是因为混交林与纯林相比,凋落物的分解环境往往会发生改变,使混交林土壤微生物群落具有较高的代谢强度和丰富度导致的[26]。李英花等[27]对落叶松人工混交林凋落物分解过程进一步进行了研究,发现落叶松和红松混交林对凋落物养分释放表现出促进作用,这与本研究研究结果一致,她认为混交林对凋落物养分释放的影响与树种组成和凋落物混合比例有关。因此,在今后的研究中应加大不同混交树种及混交比例对凋落物养分释放影响的研究。
3.2 麻栎-刺槐混交林和麻栎纯林土壤微生物多样性变化分析
森林生态系统会因林分结构、凋落物性质、季节更替产生差异,这些差异可能会对土壤细菌和真菌群落多样性产生影响[28]。表征土壤微生物多样性常用的指标有菌群丰富度指数(Chao1和ACE)和菌群多样性指数(Shannon和Simpson)[29]。在麻栎-刺槐混交林和麻栎纯林凋落物分解过程中,土壤微生物菌群丰富度指数和菌群多样性指数发生显著变化。土壤温度的差异可能是导致土壤微生物群落结构变化最重要的原因[30]。本试验土壤微生物三次采样时间分别为2019年5月,2019年9月和2020年1月,土壤温度在2019年9月最高,2020年1月最低。一般来说,每种微生物都有其生存的最适合温度,土壤温度的变化会影响微生物的生长、繁殖过程,进而影响菌群丰富度和多样性[31]。有研究表明,温度在3—25℃范围内,温度升高后会使部分微生物群落代谢低温时不能代谢的物质,增强微生物活性、菌群丰富度和多样性[32]。另外,低温可能会降低微生物膜脂质流动性,导致细胞内液冰冻、细胞破裂和死亡,从而降低微生物多样性[33]。研究发现,麻栎-刺槐混交林土壤微生物菌群丰富度指数和菌群多样性指数变化范围小于麻栎纯林,这可能是混交林能为土壤微生物生长提供更加稳定的微生态环境引起的。王凌云等[34]对枫香-木荷混交林和马尾松纯林土壤微生态环境差异进行了研究,发现香枫-木荷混交林对改善土壤微生物生存环境的改善效果更明显。黄雅丽等[35]研究认为混交林能从宏观上改变植被类型和林内植被群落, 也从微观上改变土壤微生物群落, 使混交林较纯林更加稳定,进而为微生物生长提供一个稳定的微生态环境。
3.3 土壤微生物群落对麻栎-刺槐混交林和麻栎纯林凋落物分解速率的影响
森林生态系统中,凋落物分解虽然受多种因子影响,但多是土壤微生物作用下对诸多生态因子综合效应的反应[3]。在土壤微生物群落中,细菌数量最大,种类最多,许多群落具有分解凋落物木质素、半纤维素和纤维素的能力,细菌菌群丰富度和菌群多样性会对凋落物的分解进程产生影响[36]。研究发现,凋落物分解速率与土壤细菌菌群丰富度指数和多样性指数呈显著正相关(表4),表明高的细菌丰富度和多样性对凋落物分解具有促进作用。许多学者对凋落物分解速率与细菌群落多样性的关系进行了研究,得出了类似的结论。李俊等[37]对方枝柏和康定柳凋落物分解进行了研究,发现凋落物分解速率与细菌菌群丰富度呈正相关。路颖等[16〗在研究泰山4种优势造林树种凋落物分解对细菌群落结构的影响时,发现凋落物分解速率与细菌菌群多样性指数具有很大的相关性。土壤真菌是土壤微生物的另一大类,本研究中麻栎-刺槐混交林和麻栎纯林凋落物的分解速率与真菌菌群丰富度指数呈显著正相关,表明真菌菌群丰富度影响凋落物的分解速率。真菌的营养方式为分解吸收式,在凋落物分解过程中能够产生大量促进凋落物分解的酶,进而有效促进凋落物的分解[38]。
混交林作为一种常见的营林类型,能够改善森林群落结构,增强森林生态服务功能,会对凋落物有机碳、全氮、全磷以及土壤温度、土壤水分等方面产生一些独特的变化,这会对土壤微生物多样性产生影响,进而会影响凋落物的分解速率[39-40]。大多数研究认为,混交林与纯林相比,往往能增加环境异质性和为微生物提供多样性的食物,从而增加土壤微生物多样性,提高凋落物分解速率[41]。但Hooper等[42]研究发现,一些凋落物混合会与微生物发生拮抗作用,降低微生物多样性,对分解起抑制作用。而Nielsen等[43]研究发现,混交林对土壤微生物多样性并无直接影响,对分解速率的影响不明显。研究发现,麻栎-刺槐混交林凋落物分解速率高于麻栎纯林,这可能与凋落物质量差异引起的土壤微生物菌群丰富度和多样性的差异有关。一般认为,当初始C/N高于30时,随C/N的增高,氮元素会成为限制性因素,凋落物的微生物分解过程因受抑制而减慢[44]。本研究中,凋落物初始C/N在麻栎-刺槐混交林中为31.3,麻栎纯林中为39.5,麻栎-刺槐混交林较低的C/N会为微生物生长和繁殖创造有利条件,增加土壤微生物多样性[45]。与麻栎纯林相比,麻栎-刺槐混交林可溶性氮源种类及含量更加丰富,能为土壤微生物提供较为丰富和多样的食物,增加土壤微生物多样性,提高凋落物分解速率[46]。
4 结论
两种林分土壤微生物优势类群相同,细菌优势类群为放线菌门、变形菌门、酸杆菌门和疣微菌门,真菌优势类群为担子菌门、子囊菌门和被孢霉门。凋落物分解过程中,麻栎-刺槐混交林土壤微生物菌群丰富度指数和菌群多样性指数变化范围小于麻栎纯林。
麻栎-刺槐混交林凋落物分解速率高于麻栎纯林,土壤微生物多样性对凋落物分解速率具有重要影响。凋落物分解速率与土壤细菌菌群丰富度指数和菌群多样性指数呈显著正相关,与土壤真菌菌群丰富度指数呈显著正相关。

