基于16S rRNA技术分析当归超微粉对小鼠肠道菌群多样性的影响
白雪松,刘鹤,宋岩,律广富,林贺,林喆,李银清
(1.长春中医药大学药学院,吉林长春 130117)(2.长春中医药大学临床学院,吉林长春 130117)(3.长春中医药大学人参科学研究院,吉林长春 130117)
当归(Angelica sinensis)在中国已被用作治疗营养不良和贫血的草药2000多年,在欧洲和美洲也被用作营养剂[1]和功能性食品[2]。由于其治疗妇科疾病的优势,被称为“女性人参”[3]。关于当归等 6种新增按照传统既是食品又是中药材的物质公告(2019年第8号)也有抗血栓及改变血液流变学、对心血管系统、利胆保肝、润肠通便、增强免疫等功效[4],主要含有多糖类成分[5]。随着中医药现代化飞速发展,超微粉碎技术成为改善传统中药饮片应用的重要途径[6]。中药材被加工成中药超微粉饮片,即可以作为功能保健食品,又可以作为药用,能有效提高中药材中有效成分溶出和吸收[7]。
现代中药是传统现代制药技术和中医药理论的结合产物,是祖国的中医药走出国门和走向世界的载体,中药超微粉作为药品和食品,其应具有安全、有效、质量一致的基本属性[8]。药物和保健食品安全性评价是其应用的首要步骤,是应用和获得批准上市前的必要程序和重要步骤[9]。国家药监部门始终没有准许中药粉末药材进入市场,主要为安全性和临床用量的有效性。分析中药材的安全性主要包括四个方面,一是中药材毒性是客观存在的,经过超微粉碎后,细胞壁被打破,有效成分溶出速率提高的同时,也增加了中药本身包含的内源性毒性物质的释放[10]。二是细胞壁打破造成的潜在特殊成分的释放和利用,形成新的毒性或引起不良反应[11]。三是由于超微粉颗粒具有表面效应等,使其对物质的吸附性较大,中药对肠壁的黏附作用增强,使中药粉粒增加了在肠内的停留时间,可能会造成肠道的物理损伤[12]。四是其释放的内源性物质,可能会引起肠道菌群的失衡[13]。
本研究通过药理学与分子生物学技术,观察比较当归超微粉饮片、其粗粉饮片和传统饮片对小鼠胃肠道组织的影响,对当归超微粉的安全性提供科学依据。基于 16s RNA测序技术探讨当归超微粉对肠道菌群多样性及物种组成的影响,重点分析了不同浓度当归超微粉对肠道益生菌、潜在有害菌的促进或抑制作用,从而选择出调节肠道菌群的最佳浓度,为当归超微粉安全应用的剂量问题打下基础。
1 材料与方法
1.1 原料
当归超微粉饮片、原药材及传统粗粉由东方红(通化)生物医药有限公司提供,长春中医药大学大学药学院生药教研室鉴定为伞形科植物当归(Angelica sinensis(Oliv.) Diels)的干燥根。当归超微粉制备方法为选取伞形科植物当归的根部。春季采挖,除去根须和泥沙,待水分稍蒸发后,困成小把,上棚,用烟火慢慢熏干,切成片状,制成的当归饮片。取当归饮片,洗净,干燥灭菌,粉碎成细粉;将细粉进行低温超微粉碎得破壁粉体,混匀,即得。雄性C57BL/6小鼠,8周龄,18~22 g,生产许可证号为 SCXK(吉)-2015-0005,长春市亿斯实验动物技术有限责任公司。动物饲养于长春中医药大学医学实验动物中心,日光灯照明,适应性喂养5 d后用于实验。
1.2 实验试剂与仪器
1.2.1 实验试剂
切片石蜡,北京索莱宝科技有限公司;Power Soil DNA分离试剂盒,Mo Bio Laboratories公司;RNeasy mini试剂盒,美国Qiagen公司;Trizol,美国Invitrogen公司;Quant-iT™dsDNA HS试剂盒,美国 Thermo Fisher Scientific公司;二甲苯、无水乙醇,北京化工厂;切片石蜡60~62 ℃、苏木素伊红(HE)染色试剂盒,北京索莱宝科技有限公司。
1.2.2 主要仪器设备
分析天平(CP12 4S),德国Sartorius公司;Sorvall Evolotion RC型高速冷冻离心机,美国Thermo公司;D-1320型无菌操作台,东联哈尔仪器制造厂;精密电子天平,美国双杰兄弟有限公司;光学显微镜(BX 50),日本 Olympus公司;石蜡切片机,德国 Leica公司;DW-86L490J型-80 ℃超低温冰箱,青岛海尔集团;BT-2001激光粒度分布析仪,丹东百特仪器有限公司。
1.3 实验方法
1.3.1 粒度的测试
采用光散射法-激光粒度分布仪测定超微粉粒度[14],首先清洗粒度测试仪,使用标准粒子校正仪器。再次清洗仪器后,加入蒸馏水作为混悬介质,打开超声,使用药匙缓缓加入超微粉饮片,使其遮光率在15.00左右,停止加入。保存测试结果。读取D90值,测试十批当归超微粉饮片样品的粒度,计算其平均值。
1.3.2 动物分组与药物的配制
雄性C57BL/6小鼠60只,适应性喂养,随机分为当归超微饮片高剂量组(2.0 g/kg),DA;中剂量组(1.0 g/kg),DB;低剂量组(0.5 g/kg),DC;传统饮片组(2.0 g/kg),DY;和传统粉末组(2.0 g/kg),DF;空白组,K。当归药典规定的临床常用剂量为2.0 g/kg,中剂量和和低剂量为临床常用量逐级减半而来。空白组给温开水,传统饮片采用煎煮法,粗粉组和超微粉组为开水冲泡,混匀给药,连续给15 d,每天一次,给药体积是 20 mL/kg。在同一时间对小鼠体质量测量。
于实验的第15 d每组随机选取5只小鼠,乙醚麻醉后,75%的乙醇溶液给小鼠腹部消毒,在超净环境解剖,取位于结肠处的内容物,放置无菌EP管中,液氮速冻后保存于-80 ℃冰箱。
1.3.3 胃肠组织病理学检查及肠道微生物多样性检测
取上述胃肠道组织,进行病理切片,HE染色后观察胃肠道的病理变化。取上述肠道内容物,根据说明书,使用Power Soil DNA分离试剂盒从样品中提取总DNA。分光光度计用260 nm的波长测定DNA的浓度和纯度。总体积为20 μL的PCR扩增,使用10 μL KOD FX Neo 缓冲液和 0.4 μL KOD FX Neo 以及4 μL dNTP,每种引物(10 μM)和 50 ng DNA 为 1 μL。使用27正向引物 5"-AGAGTTTGATCCTGGCTCAG-3"和1492反向引物5"-GGTTACCTTGTTACGACTT-3",通过PCR扩增16S rRNA基因的V3-V4区(95 ℃持续5 min,然后进行30个循环,然后分别是95 ℃持续30 s,55 ℃持续 30 s,72 ℃持续 1 min/1 kb,并在 72 ℃下放置 7 min),纯化 PCR产物。所有 PCR产物均用Quant-iT™dsDNA HS试剂进行定量。数据库的选择,细 菌 使 用 16S:Silva[15]( Release132,http://www.arb-silva.de),而真菌使用 ITS:Unite[16](Release 8.0,https://unite.ut.ee/)。
采用Illumina测序平台进行测序,测序结果进行Alpha和Beta多样性分析[17];基于其注释结果,可以得到各水平的物种组成信息[18]。
1.4 统计学分析
用均值±标准差(x±SD)表示,用 IBM SPSS Statistics 20的软件分析数据,单因素因素方差分析组间差异,β多样性和α多样性的检验方法为Bray-Curtis算法,p<0.05表示有统计学意义。
2 结果与讨论
2.1 粒度测试结果
十批当归超微粉饮片样品D90测定结果,粒径结果为21.67±0.49 μm。后续使用的为该粒度下,符合超微粉饮片粒度标准[19],使用该粒径的样品进行的动物实验。
2.2 超微粉饮片对 C57BL/6小鼠体质量的影响

图1 当归超微粉饮片对小鼠体重的影响Fig.1 Effect of ultrafine powder of Angelica sinensis on body weight of mice
在超微粉颗粒具有表面效应等,使其对物质的吸附性较大,中药对肠壁的黏附作用增强,使中药粉粒增加了在肠内的停留时间,可能会造成肠道的物理损伤。前人研究表明了超微粉有类似的毒性[20]。给药期间,小鼠的体重变化如图1所示。各组无明显差异,且趋于平稳,维持在23 g左右,当归超微粉与传统饮片、传统粗粉一样,均对C57BL/6小鼠体质量无显著影响。
2.3 C57BL/6小鼠剖检与组织病理学变化
从剖检后小鼠各组织器官来看,当归给药后各组均没有观察到任何异常和可疑病变。经HE病理学检查小鼠小肠、胃组织(图2、3),结果显示当归超微粉各组小鼠胃粘膜无变薄、固有层也炎症浸润现象、胃部腺体形态正常;当归超微粉各组小鼠肠道粘膜无明显病变;肠壁下层没有显著炎症浸润现象。综上,口服给药15 d,当归参超微粉各组均对小鼠胃肠道无肉眼明显损害,故常用的口服给药方式对小鼠胃肠道组织没有明显的伤害作用。可为当归以超微粉的方式使用的安全性,提供科学依据。
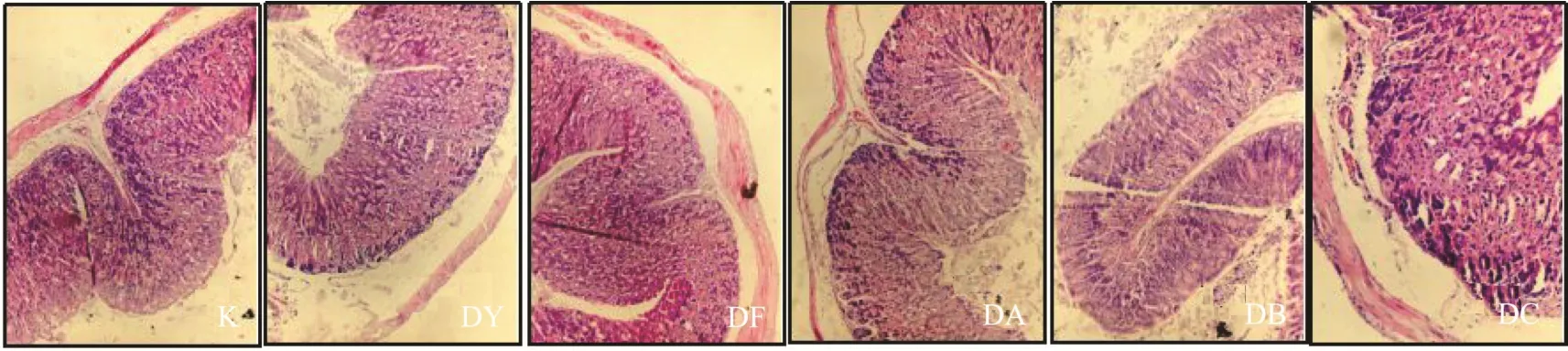
图2 当归超微粉对C57BL/6小鼠胃组织病理学的影响(×100)Fig.2 Effect of Angelica supermicron powder on histopathology of C57BL/6 mice stomach (×100)

图3 当归超微粉对C57BL/6小鼠肠组织病理学的影响(×100)Fig.3 Effect of Angelica supermicron powder on intestinal histopathology in C57BL/6 mice (×100)
图4 C57BL/6小鼠肠道菌群PCR产物电泳图Fig.4 Electrophoresis of PCR products of intestinal microflora in C57BL/6 mice
2.4 肠道微生物多样性分析
2.4.1 小鼠肠道内容物
超微粉碎后的药材,释放的内源性物质,可能会引起肠道菌群的失衡[21],故以小鼠实验进行论证。各处理组每组取5只小鼠肠道内容物基因组提取,图4为PCR扩增结果,分为第一次扩增和第二次复检。扩增条带大小为465 bp,扩增后产物条带位置正确和清晰明亮,样品的质量全部达到了我们后续建库和测序的要求。
2.4.2Alpha多样性分析
Alpha多样性(Alphadiversity)反映的是单个样品物种丰度及物种多样性。有Chao1、Ace、Shannon以及Simpson四种衡量指标。Chao1和Ace指数评价物种数量的多少。Shannon及Simpson指数评价物种多样性。相同物种丰度的情况下,群落中各物种具有较大的均匀度,认为群落具有较大的多样性,Simpson指数值小,Shannon指数值大,说明样品物种多样性高[22]。统计OTU覆盖率(Coverage),发现其比率均大于99.00%以上,表示样本中物种被测出的概率高,未被测出的概率低,反映出了测序结果代表样本中微生物真实情况。
稀释性曲线[23],从样本中随机抽取一些序列,统计所抽取序列代表的物种数目,以序列数和物种数构建曲线,检验出测序数据量足够反映出样品中的物种多样性,反映样品中物种的丰富程度(图5)。
结果表明,随着抽取数量的加大,曲线趋于平缓,表示环境中的物种并不会随测序数量的增加而明显增加,测序量足够反映样品物种多样性。等级丰度曲线[24],是将各样品的 OTU丰度按大小排序并基于其相对丰度绘制的曲线图,主要用于同时解释样品所含物种的丰富度和均匀度,物种的丰富度由曲线在横轴上的长度来反映,曲线较宽,表示物种的组成足够丰富,物种组成的均匀度由曲线的形状来反映,曲线平坦,表明物种组成的均匀程度高(图6)。
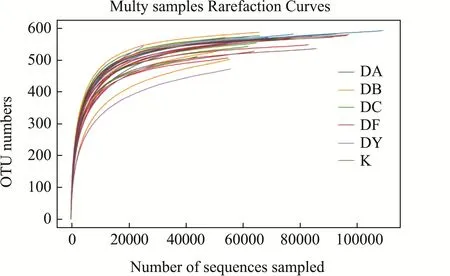
图5 C57BL/6小鼠肠道微生物样品稀释曲线Fig.5 Multy samples rarefaction curve of intestinal microflora in C57BL/6 mice
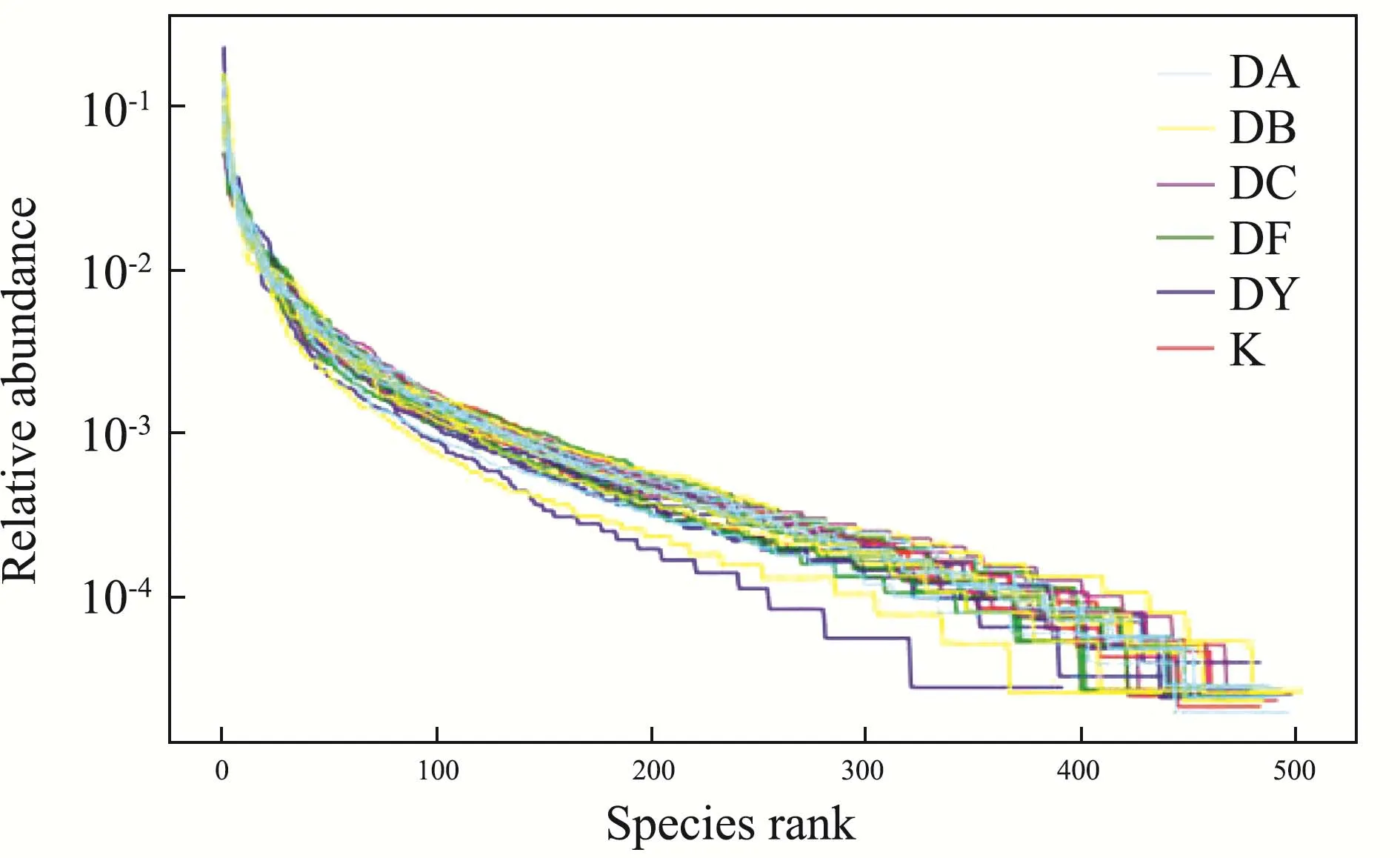
图6 C57BL/6小鼠肠道微生物等级丰度曲线Fig.6 Rank abundance curves of intestinal microflora in C57BL/6 mice
2.4.3Beta多样性分析
β多样性主要分析了样本与样本间微生物群落组成的相似性。比较不同样品在物种多样性方面存在的相似程度。采用加权的方式,Bray-Curtis算法计算样品间的距离从而获得样本间的β值,加权方法,需要同时考虑物种有无以及物种丰度两个问题。
主坐标分析法[25](Principal coordinates analysis,PCoA),是一种与PCA类似的降维排序方法,通过主坐标分析可以实现多个样品的分类,进一步展示样品间物种多样性差异。在小鼠饲养第15 d时,空白组主成分分析显示(图7),相聚较为紧密组间差异小,和当归给药组有明显的分界线;当归超微粉饮片等临床剂量组,也显示出明显调节趋势;此时当归超微粉起到生物活性作用,对肠道菌群结构产生了影响,使给药组组与空白组组区分显著。当归传统饮片给药,对小鼠肠道菌群有明显的调节趋势,显示出独特的优势;中剂量组和低剂量组的当归超微粉介于超微粉等临床剂量组和传统饮片之间,应为超微粉应用重点关注剂量。粗粉组最为分散,无明显趋势。置换多元方差分析,它主要是用于分析多维度数据组间相似性的统计方法。可以对不同分组的样品之间beta多样性是否显著差异进行检验。测试结果显示,各处理组,组内差异很小,组间差异都不明显,表明没有改变菌群的大体结构。
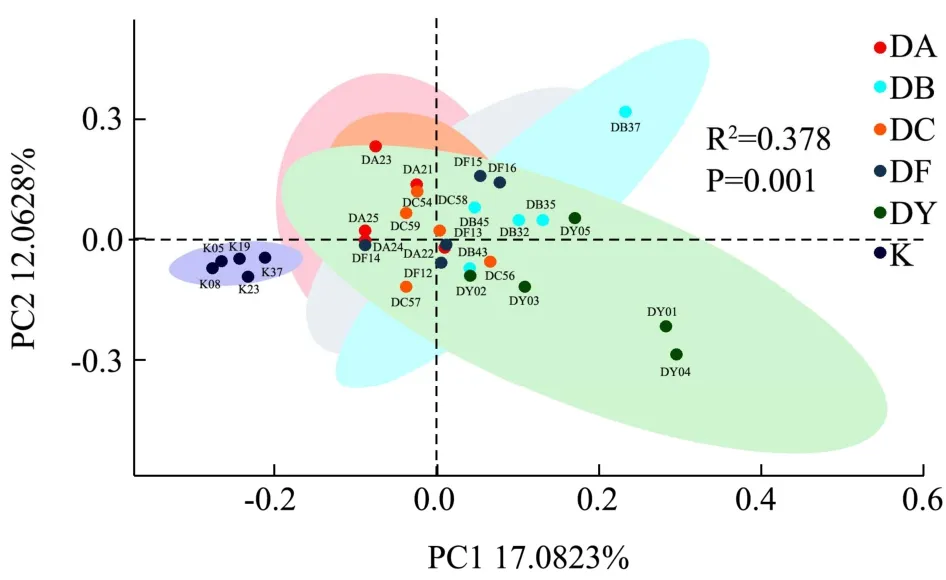
图7 C57BL/6小鼠肠道微生物主坐标分析Fig.7 Principal coordinates analysis of intestinal microflora in C57BL/6 mice
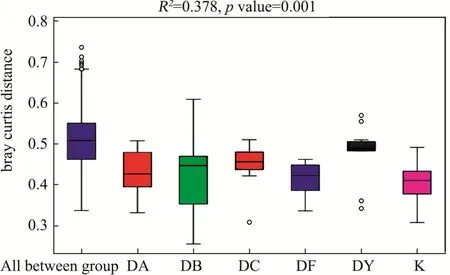
图8 小鼠肠道微生物置换多元方差分析Fig.8 Permanova analysis of intestinal microflora in C57BL/6 mice
2.4.4 肠道微生物物种分布情况
经物种组成分析可得知各处理组在各分类水平上的分类学比对情况。组间差异显著性分析,用来发现不同组间具有统计学差异的肠道菌落。本实验采用统计学的分析方法,重点分析了门水平和属水平的。在物种分布柱状图中,一种颜色代表一个肠道菌群的物种,色块长度代表物种所占相对含量比例。门水平所以物种,属水平显示含量前20的物种。并将含量低于前20的微生物合并为Others在图中显示,Unclassified为没有进行分类学注释的微生物。
2.4.4.1 基于门水平差异性分析
经过15 d的各种方式处理,结果发现(由表1和图9显示),当归超微粉饮片高剂量组的疣微菌门(Verrucomicrobia)含量显著增加(p<0.05),放线菌门(Actinobacteria)含量减少(p<0.01)。另外当归超微粉饮片中剂量组拟杆菌门(Bacteroidetes)含量降低最为显著,厚壁菌门(Firmicutes)增加最为显著。其中厚壁菌门和拟杆菌门在肠道菌群中占绝对主导地位。肠道菌群和机体互相影响,互相依赖和共生,口服药物通过胃肠道,对胃肠道的作用既可以是胃肠道组织,也可以是肠道微生物。在肠道微生物的门水平,高剂量组可调节疣微菌门 Verrucomicrobia和Actinobacteria,二者皆为优势菌群[26]。表明了中剂量的当归超微粉对小鼠肠道菌群有一定的调节作用,可以考虑该剂量进行日常保健应用或者临床应用,能减少药材的用量,减少药物在体内蓄积过多而产生的副作用。
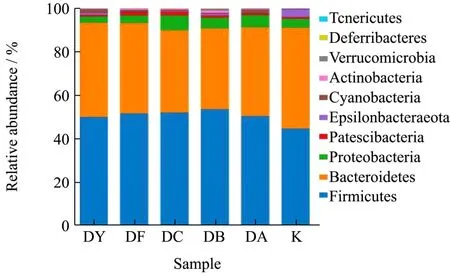
图9 当归超微粉对小鼠肠道菌群门水平物种分布的影响Fig.9 Effects of Angelica superfine powder on the distribution of intestinal phylum level in mice
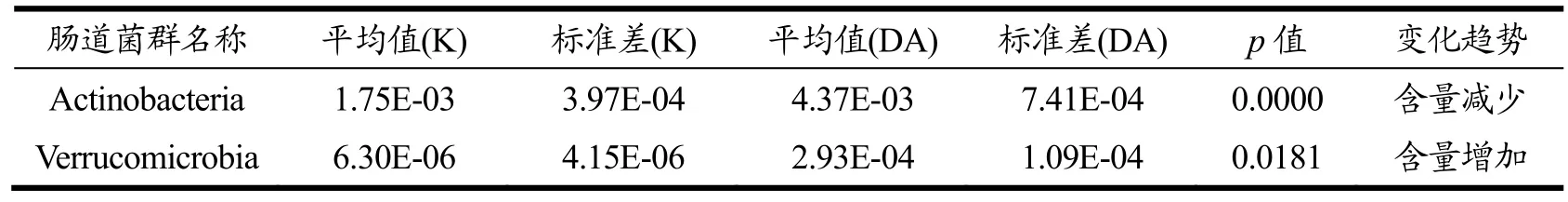
表1 当归超微粉和空白组门水平差异菌群Table 1 Different flora of Angelica superfine powder and blank group
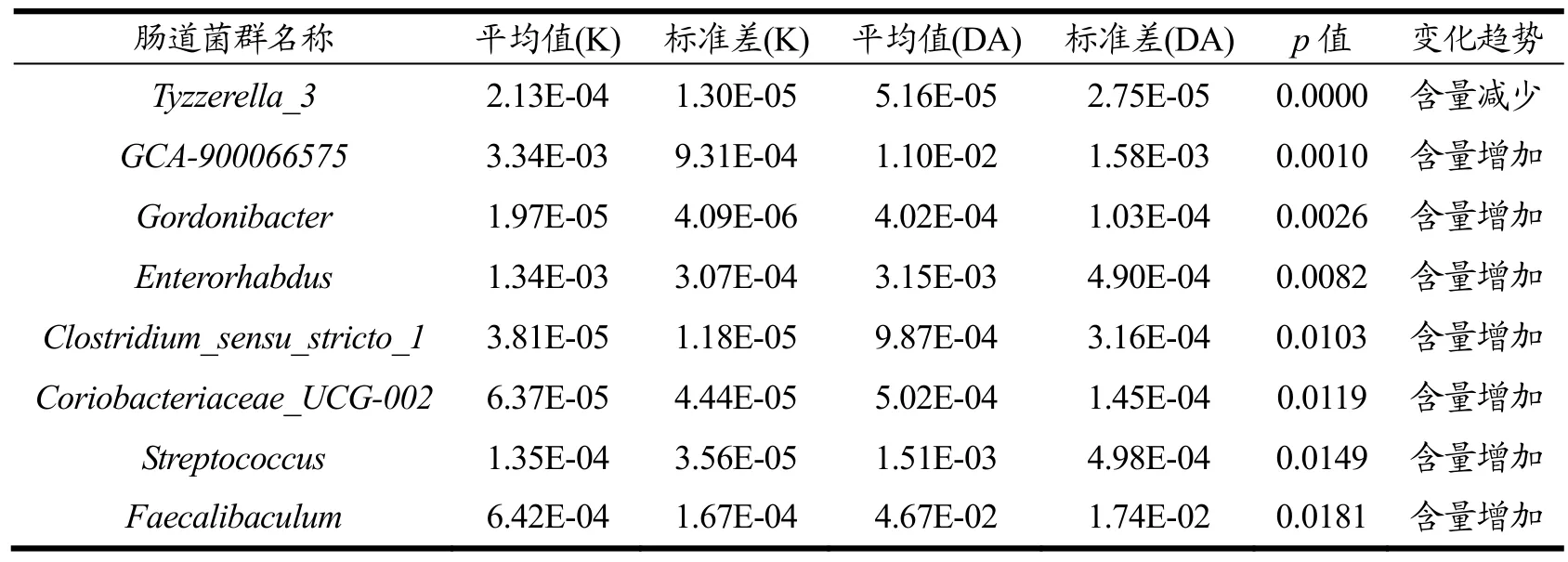
表2 当归超微粉和空白组属水平差异菌群Table 2 Different flora of Angelica superfine powder and blank group
2.4.4.2 基于属水平差异性分析
当归经过适度的微粉化能促进当归有效成分阿魏酸的溶出速率、累积溶出率和溶出总量[27]。所以临床用量必须进行调整。临床用量调整的依据可为其传统疗效的强弱,调节肠道菌群的新疗效等。为了研究两组样品间微生物群落丰度的差异,利用 Metastats[28]软件对组间的物种丰度数据进行T检验,重点筛选出等临床剂量当归超微粉和空白组有差异的菌群结构。为Tyzzerella_3、GCA-900066575、Gordonibacter、Enterorhabdus、Clostridium_sensu_stricto_1、Coriobacteriaceae_UCG-002、Streptococcus以及Faecalibaculum。其中含量排在前 20的为Faecalibaculum,含量增加(p<0.05),其中中剂量组对小鼠肠道菌群Faecalibaculum增加最明显,可能高剂量抑制该菌落生长,低浓度有一定的促进生长的作用。另外,在对Dubosiella水平的增加有明显的增加作用,在 other为其他物种合并显示出有明显的增加作用。在属水平高剂量主要调节Faecalibaculum,肠道内Faecalibaculum可抑制肠道肿瘤生长,无其他不良副作用[29]。另外发现,中剂量组(1.0 g/kg)对小鼠肠道菌群的调节较为柔和,推荐该剂量为保健用量。所以,使用中剂量组的超微粉饮片可能最为合适,与在门水平结果是相似的。
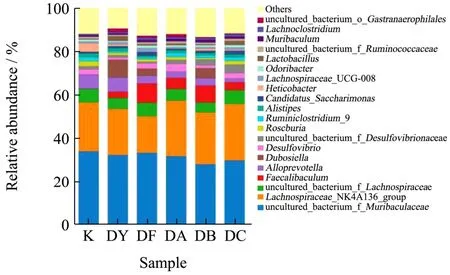
图10 当归超微粉对小鼠肠道菌群属水平物种分布的影响Fig.10 Effects of Angelica superfine powder on the distribution of intestinal genus level in mice
3 结论
当归经超微粉碎后,破壁率大大提高,微粉较普通粉粒度分布均匀。另外,溶出试验表明,由于当归超微粉碎后比表面积增大,其成分溶出速度加快,溶出量增加,从而提高了中药的生物利用度和治疗效果。但并不是粒径越小越好,粒径越小,粒子表面会更易吸附空气和带有电荷,影响有效成分的吸收。或者会引起相应的毒性。本次研究,以当归超微粉饮片为研究对象,通过药理学与分子生物学技术和基于 16s RNA测序技术,考察对C57BL/6小鼠肠道菌群、胃肠道组织的影响,评价其安全性。为当归超微粉以保健食品或者药材饮片的方式进行应用,提供科学的理论依据。另外,可以找出当归超微粉口服给药对小鼠肠道菌群,为今后当归超微粉饮片与肠道菌群相关的药效学研究提供了技术支持。针对当归超微粉对肠道菌群的研究可以为临床相关疾病的研究提供线索,为人类的健康保驾护航。

