致病性尖孢镰刀菌毒力因子的研究进展
李 英,杜春梅
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨150500 2黑龙江大学生命科学学院黑龙江省普通高校微生物重点实验室,哈尔滨150080)
0 引言
尖孢镰刀菌(Fusarium oxysporum)是一种物种复合体(Species complex),包括非致病性和致病性的分离菌株。非致病性尖孢镰刀菌分离株通常作为腐生菌存在于土壤中,也可以在植物组织中分离到,是常见的植物内生菌,一些非致病分离株可作为生物防治剂来使用[1]。致病性尖孢镰刀菌具有广泛的寄主范围,能够造成100多种植物物种枯萎或者腐烂,目前已被列为世界上第五大植物病原真菌(前4种分别为稻瘟病菌Magnaporthe oryzae,灰霉病菌Botrytis cinerea,禾柄锈菌Puccinia spp.,禾谷镰刀菌F.graminearum)[2]。根据其宿主特异性尖孢镰刀菌被划分为120多种专化型(F.spp.)[3],在不同植物上引起的症状最常见的是维管束萎蔫,有时引发组织腐烂,一些植物可能会同时发生这两种症状[4-5]。有腐烂症状的疾病称为基腐病、镰刀菌茎腐病或冠根腐病。目前对尖孢镰刀菌还没有理想的防治方法,而充分了解尖孢镰刀菌的致病机制是对抗这种疾病的先决条件,是研究和实施有效控制策略从而限制宿主植物感染的必要基础[6]。目前对于尖孢镰刀菌的致病机理的研究主要为导管阻塞及产生的致病毒素对其宿主植物的侵染,而对于其调控因子及信号传递通路研究甚少。本文对尖孢镰刀菌侵染的毒力因子、信号途径等进行了总结,包括致病性尖孢镰刀菌产生的细胞壁降解酶、毒素,以及与侵染过程相关的调控基因、转录因子和信号转导,以期为开发有效的尖孢镰刀菌防治技术提供靶点和思路。
1 毒力因子
尖孢镰刀菌的致病作用主要由侵染结构的附着和穿透[4,7]、细胞壁降解酶、毒素三部分组成。其中在病害的发生发展进程中,细胞壁降解酶和毒素的作用是非常重要的。
1.1 细胞壁降解酶
尖孢镰刀菌在穿透根细胞壁直到在宿主植物定殖期间会分泌一系列的细胞壁降解酶(Cell wall degrading enzymes,CWDEs),在降解植物细胞壁以及宿主与病原体相互作用中起着核心作用[8-9],包括多聚半乳糖醛酸酶(Polygalacturonases,PGs)、果胶和果胶酸裂解酶(Pectatelyases,PLs)、木聚糖酶(Xylanase)和蛋白酶(Protease)[10]。其中PGs存在于所有真菌基因组中,通常由果胶底物诱导表达,能有效地浸渍植物组织,PG1是果胶生长和番茄植株感染期间尖孢镰刀菌番茄专化型(F.oxysporum f.sp.lycopersici)分泌的主要内生细胞壁降解酶,也是在番茄细胞壁的尖孢镰刀菌培养物中检测到的第一个酶[11],此外,还检测到了PG2和PG3。外切PGs进一步降解由细胞壁释放的寡聚半乳糖醛酸。编码外切PGs的pgx4基因在番茄植物感染期间表达,外切PGS基因pg5在柑橘果胶和植物感染早期的腐生生长过程中表达,但pg5和pgx4的靶向失活不会导致果胶的生长减少或毒力的改变。Ruiz等[12]研究尖孢镰刀菌番茄专化型感染番茄植株时发现,在缺乏pg1编码的内切PGs和pgx6基因编码的外切PGs的双突变体中,果胶生长期间分泌的PGs活性显著降低,对番茄植株的毒力也降低。PLs在维管束枯萎病的发展中也很重要,可以在受感染的番茄根和茎组织内检测到。在疾病周期的不同阶段观察到编码尖孢镰刀菌的内切PLs的pl1基因的转录。尖孢镰刀菌的xyl3基因编码一种木聚糖酶,催化木聚糖的水解,导致植物细胞壁的降解,xyl3在尖孢镰刀菌感染的开始直至疾病症状出现期间的整个疾病周期都表达[13]。艾聪聪等[14]发现尖孢镰刀菌胞内和胞外蛋白酶活性均较高,尖孢镰刀菌可能通过分泌蛋白酶来参与对宿主植物的侵染系统。
1.2 毒素
尖孢镰刀菌在感染过程中分泌与致病相关的真菌毒素,以促进感染并抑制宿主防御。这些毒素主要是低分子量的次生代谢物,如镰刀菌酸(Fusaric acid,FA)、伏马菌素 (Fumonisins,FBs)、白僵菌素(Beauvericin,BEA)、恩镰孢菌素(Enniatins,ENs)和单端孢霉烯族毒素(Trichothecenes)等[15]。这些毒素引起植物坏死、萎黄,抑制生长和种子萌发。FA是导致多种作物枯萎病的原因,诱导植物细胞早期去极化。改变细胞膜渗透性或膜电势,导致跨膜电位去极化,产生活性氧,影响细胞膜完整型。Tan等[16]表明患病植物中FA的浓度与尖孢镰刀菌的毒力呈正相关,Bouizgarne等[17]证明FA在大枣枯萎病菌(F.oxysporum f.sp.albedinis)感染的早期阶段发挥了重要作用。Wang等[18]研究表明邻苯二甲酸(Phthalic acid,PA)是兰州百合根系分泌物中的主要自毒素,通过诱导自毒作用参与土壤病害。PA能够刺激FA的产生和蛋白酶、果胶酶、纤维素酶和淀粉酶等水解酶活性的提高,从而促进百合枯萎病的发展。Wu等[19]报道了肉桂酸、芥子酸、对羟基苯甲酸、阿魏酸、水杨酸和苯甲酸也能刺激尖孢镰刀菌西瓜专化型(F.oxysporum f.sp.niveum)的FA产生。除此之外,FBs是聚酮化合物衍生的霉菌毒素,可抑制鞘氨醇生物合成途径中的关键酶神经酰胺合酶[20]。单端孢霉烯族化合物是真核生物中蛋白质翻译的有效抑制剂,抑制植物的生长[21]。BEA和ENs的毒性与它们促进阳离子通过膜运输的能力有关,影响细胞的正常生理水平和体内离子平衡,细胞内阳离子(例如Ca2+)的增加会激活钙依赖性核酸内切酶,并导致随后的DNA片段化,从而使细胞凋亡[22]。Moretti等[23]研究表明,尖孢镰刀菌产生的BEA对被测植物(西瓜、番茄、小麦和大麦)的根部均未引起任何症状,但它对所有被测植物的原生质体均表现出高毒性。
2 信号传导与感染进程
尖孢镰刀菌通过信号刺激启动特定的信号转导途径。促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)模块处理接收细胞内的信号,并将其分配到适当的细胞内靶标。该级联的第一个模块MAPK激酶激酶(MAPKKK)磷酸化并由此激活MAPK激酶(MAPKK),MAPK激酶又磷酸化并激活MAPK。一旦被激活,MAPK通过磷酸化细胞中的各种蛋白质,包括基因调控蛋白和其他蛋白激酶,将信号传递到下游[24](图1)。
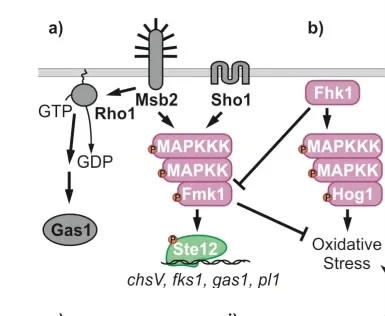
图1 尖孢镰刀菌的MAPK信号传导途径
MAPK渠道信息是赋予尖孢镰刀菌完全毒力所必需的。Fmk1、Mpk1和Hog1是MAPK途径中的3种关键酶[25],调控着尖孢镰刀菌对宿主的感染进程,如尖孢镰刀菌与宿主植物根的粘附、穿透、感染菌丝的形成、维管束定植和在活体组织上的侵袭性生长。Fmk1在番茄果实组织浸渍和表面产生气生菌丝方面也起着重要作用。高度糖基化的跨膜蛋白Msb2与四跨膜蛋白Sho1共同作用于Fmk1上游,使其完全磷酸化,调节Fmk1途径参与植物感染[26]。尖孢镰刀菌的RHO型GTPase Rho1蛋白是正确组装细胞壁和毒力所必需的。Rho1蛋白正调节葡聚糖合成酶翻译后的活性,并在维持菌丝结构中发挥重要作用,从而阻止其被宿主防御[27]。GTP结合蛋白是介导细胞对环境刺激反应的重要组分,当细胞外信号分子与G蛋白偶联受体结合时,受体构象发生变化,使其能够激活G蛋白,G蛋白附着于质膜的细胞表面,由α、β和γ三个蛋白质亚基组成。尖孢镰刀菌具有编码Gα蛋白的FGA1和FGA2基因以及编码Gβ蛋白FGB1的基因,FGA1和FGA2基因调节腺苷酸环化酶活性,并改变与致病性相关的cAMP水平[28],FGA1和FGA2基因的突变体菌株导致致病性降低和菌落形态改变。
膜蛋白(Sho1和Msb2)与Fmk1共同调控细胞壁降解酶pl1、chsV、fks1、gas1等基因的表达。Pietro等[29]发现,Fmk1基因靶向失活突变体的致病性显著降低,不能在番茄果实疏水表面产生气生菌丝,使番茄植株细胞壁的酶降解能力和在果实组织上的侵袭性生长能力均显著降低,证明MAPK-FMK1是尖孢镰刀菌侵染菌丝形成、根系附着和穿透以及在活体植物组织上入侵生长的信号转导途径的一部分。Cristina等[30]研究表明F-box蛋白Fbp1是Fmk1完全磷酸化所必需的,Fbp1通过Fmk1途径调节尖孢镰刀菌的毒力和侵袭性生长,Fbp1突变体对十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)过敏,经SDS处理后的植物细胞壁完整性提高。
组氨酸激酶Fhk1是通过募集几种信号传导途径促成毒力、氧化应激和杀真菌剂敏感性的另一个关键因素。Fhk1调节尖孢镰刀菌穿透宿主植物途径并增强其疾病症状[31]。Fhk1也能通过募集MAPK途径中Hog1和抑制氧化应激反应负调节剂Fmk1来控制宿主植物的应激反应。在一些植物病原真菌中,Hog1通过影响有性生殖、附着胞形成和宿主组织的渗透来降低致病性。Pareek等[32]利用基因沉默技术RNA干扰(RNAi)构建尖孢镰刀菌Fmk1-RNAi和Hog1-RNAi基因工程菌株,研究结果表明Fmk1-RNAi工程菌株菌落表面疏水性丧失,侵染番茄植株时,侵染力降低,对番茄幼苗的毒力降低,Hog1-RNAi工程菌株的分生孢子大小改变,对番茄植株的侵袭性生长和发病率降低。
3 毒力的调控
3.1 毒力控制基因
尖孢镰刀菌的毒力具有多基因特性,其遗传调控是一个复杂的过程。F.oxysporum 4287的基因组大小为61 Mb,由分布在15条染色体上的17735个基因组成[33],整个基因组的1/4为特异性表达谱区域,该区域富含转座子及与致病相关的基因,涉及毒力和宿主特化的基因位于致病性染色体上。
尖孢镰刀菌在番茄木质部系统的定殖与SIX(secreted in xylem)家族蛋白质的分泌有关。编码Six1、Six3、Six5、Six6和Six7的基因以及编码植物分泌的氧化还原酶的基因都位于14号染色体上,该染色体存在于导致番茄枯萎病的所有致病菌株中,但在无毒菌株中不存在。编码具有保守F-box基序的蛋白质的fRp1基因在尖孢镰刀菌感染宿主的第一阶段起重要作用[34]。基因ARG1(编码精氨酸琥珀酰酶)、Fow1(编码线粒体载体蛋白)、Fow2(编码Zn(II)2Cys6转录调节因子)和SNF1(编码组蛋白激酶)共同促成致病性。此外,Clc1基因(编码氯离子通道)调节尖孢镰刀菌中的漆酶活性和毒力[35],真菌漆酶在尖孢镰刀菌感染过程中也很重要,在植物病原形态发生和保护尖孢镰刀菌抵御宿主防御方面具有重要意义。Velvet蛋白家族复合物(VeA、VelB、VelC、Lae A)和LaeA也通过促进菌丝生长、无性孢子形成来调节尖孢镰刀菌生长发育过程,López-Berges等[36]研究表明Velvet蛋白家族复合物编码基因veA、velB、velC的缺失对尖孢镰刀菌菌丝的生长发育和入侵番茄植株的毒力产生深远影响,而laeA基因编码的LaeA在尖孢镰刀菌番茄专化型侵染番茄植株后期起着关键作用,是在木质部导管成功定植和使维管束萎蔫症状发展的关键。
3.2 转录因子对毒力的影响
毒力在宿主植物细胞中的表达受很多基因转录水平和转录因子的调控。至少有7个系列的转录因子参与了毒力基因的调控。
(1)Con7-1调节参与许多不同功能基因的表达,包括宿主与病原体之间的相互作用、形态发生和发育、信号感知和转导、基因表达的调节和细胞代谢。Con7-1具有核定位信号结合结构域Cys2His2DNA,负责蛋白质与蛋白质相互作用的卷曲螺旋区域和富含脯氨酸/谷氨酰胺的C末端反式激活结构域。调控内切聚半乳糖醛酸酶、纤维素酶等蛋白的表达。Carmen等[37]研究表明Con7-1是尖孢镰刀菌形态发生和毒力的一般调节因子,其靶向缺失突变体的形态发生明显改变,且致病性丧失。(2)多拷贝基因ftf1编码仅存在于高毒力尖孢镰刀菌菌株中的转录因子,调控尖孢镰刀菌早期感染进程中的毒力。该基因推定编码转录因子Zn(II)2Cys6,并且首先在菜豆枯萎病原菌(F.oxysporum f.sp.phaseoli)的高毒力菌株中发现[38],在尖孢镰刀菌定殖的植物中富含从ftf1的多个拷贝或其中至少一些拷贝转录的mRNA,但在真菌培养物中几乎检测不到。ftf1转录因子的上调与效应子编码基因SIX1和SIX6的最高表达水平相关,调控尖孢镰刀菌侵染宿主植物维管束进程。(3)Sge1基因调控尖孢镰刀菌进入宿主植物木质部后启动致病力的SIX蛋白,由Sge1基因编码的核蛋白Sge1是尖孢镰刀菌在宿主植物细胞和木质部的广泛生长所必需的。Michielse等[39]发现,Sge1基因缺失突变株中的镰刀菌酸、白僵菌素和许多未知代谢物的产生量减少,且枯萎症状相对于野生型来说显著降低。Sge1基因的缺失不影响其营养生长,但能调节真菌病原体分生孢子的形成并影响致病性,Sge1基因缺失突变体对宿主植物的穿透和定殖能力受到损害甚至丧失,在活细胞或木质部系统中的广泛生长受到限制,致病性基本丧失,Sge1转录因子的表达受ftf1转录因子的调控[40-41]。(4)Sge1基因编码一个同源结构域的转录因子,调控Fmk1通路下游的侵袭性生长。(5)XlnR基因编码木聚糖酶基因xly3、xly4和xyl5的主要转录激活因子,调控植物细胞壁降解酶的表达[42]。(6)基因ctf1和ctf2编码的转录因子调控编码角质酶和脂肪酶的基因的表达[43]。(7)最后,pacC通过结合通用序列5'-GCCAAG-3'来抑制酸性表达的毒力基因和多聚半乳糖醛酸酶pg1和pg5的表达,从而编码作为尖孢镰刀菌毒力的负调节因子的转录因子[44-45]。
3.3 小分子RNA对毒力的调控
尖孢镰刀菌致病过程中大量高表达的小分子RNA(microRNA-like RNAs,milRNAs)对致病的调控作用是最近的研究热点[46-47],milRNAs是真菌中产生的一类小RNA[48-49],在病原真菌与植物互作过程中发挥重要的调控作用。而AGO蛋白是真菌milRNA生物合成过程中的重要蛋白,在香蕉枯萎病菌中,QDE2基因是编码AGO蛋白的基因之一,林漪莲等[50]发现QDE2基因敲除突变体的气生菌丝、产孢量和致病力与野生型菌株相比均明显减弱,而在互补转化子中这些表型有所恢复;QDE2基因敲除突变体的milRNA的表达量明显下降,在互补转化子中恢复到野生型水平;说明QDE2基因除了参与部分milRNA的合成外,还影响着病原菌的生长、产孢和对寄主的致病力,这一发现为尖孢镰刀菌的致病机理解析提供了新的见解。
4 展望
目前,尖孢镰刀菌细胞壁降解酶、感染进程的信号转导和基因调控已取得了重要进展。但由于尖孢镰刀菌的毒力是由复杂的多基因控制的,仍然有很多未知基因及毒力调控机制等待我们去发现。今后可从以下两个方面开展后续研究:(1)探索尖孢镰刀菌致病过程中关键致病因子将为人类开发更有效的防控策略提供作用靶标。(2)利用蛋白质组学、转录组学等技术对尖孢镰刀菌的致病机理进一步解析,从而将尖孢镰刀菌入侵植物的过程、致病性和非致病性种族的蛋白质差异、宿主植物抗性和易感品种的蛋白质表达的全局变化等将更完整的被呈现出来。
深入探究尖孢镰刀菌致病机理,将为人类制订尖孢镰刀菌病害的综合防控措施提供更充足的科学依据,为减少该类病害的发生奠定理论基础。

