基于DNA荧光探针的T4多聚核苷酸激酶免标记荧光检测
中南大学
生命科学学院
湖南 长沙 410013
0 引言
T4多聚核苷酸激酶(T4 polynucleotide kinase,T4 PNK)于1965年被发现,可以催化γ-磷酸从三磷酸腺苷(adenosine triphosphate,ATP)转移到核酸分子的5’-OH末端[1-2]。研究表明T4 PNK活性与核酸的复制、重组、修复密切相关[3-5]。异常T4 PNK行为会抑制由于DNA异常或损伤而引发的细胞免疫,从而引起人类患病如Werner综合症、Loom’s 综合症和Rothmund-Thomson 综合症等重大疾病[6]。因此,T4 PNK在开发药物、疾病诊断等方面均具有重要现实意义。有关T4 PNK的研究已经引起研究人员的广泛关注[7-10]。而发展检测T4 PNK 活性的可靠、简单方法,更是当下重要的研究方向之一。
传统的检测T4 PNK活性方法有放射自显影法、放射性同位素32P标记法以及聚丙烯酰胺凝胶电泳法等[11-12]。虽然这些方法的精确度较高、检测丰度较低,但仍然存在一些缺陷,例如操作程序复杂、费时费力,甚至有潜在的辐射危害,这极大地限制了其应用。为克服这些缺点,研究人员提出了电化学、荧光法、生物发光法和比色分析法等多种分析技术用于T4 PNK活性的高灵敏检测[13-17]。在这些方法中,基于荧光的分析策略因其高灵敏度和操作简易受到了研究人员的广泛青睐。Sun N.N.等[18]基于荧光标记核酸探针开发了氧化石墨烯生物传感平台,该平台能用于T4 PNK活性检测。Tang Z.W.等[19]利用分子信标探针和T4 DNA连接酶检测DNA磷酸化。尽管上述研究人员在DNA磷酸化测定中做出了许多努力,但这些方法主要取决于荧光染料或特定染料标记的核酸探针的使用,其中双标记分子信标修饰成本较高,样本稳定性较差。由此可见,提高定量检测T4 PNK活性的灵敏度、优化检测步骤和方法、降低检测成本等将是研究人员研发T4 PNK检测试剂盒时所面临的挑战性问题。
近年来,生物传感技术不断发展,免标记型荧光生物传感器引起了研究人员的广泛关注。免标记型核酸探针的构建避免了繁琐的标记过程及假阳性等不利因素,该探针具有特异性较强、稳定性较好,使样品活性保持时间较长等优点,因而在生物传感领域有很好的应用潜力。Zhao H.等[20]基于单链纳米铜荧光探针和核酸外切酶III(exonuclease III,Exo III)辅助的信号放大策略实现了多聚核苷酸激酶的免标记检测分析。Chen M.J.等[21]基于末端脱氧核苷酸转移酶和G-四链体-ThT体系建立了前列腺抗原的免标记荧光检测方法。基于上述研究,本课题组利用功能核酸探针,基于G-四链体的荧光转化,发展了一种对T4 PNK进行高灵敏度和特异性检测的免标记荧光法。该方法的成功构建可潜在地筛选T4 PNK抑制剂,为药物发现和疾病治疗提供有力工具。
1 实验
1.1 材料与试剂
T4 PNK(10 U/μL)、λ核酸外切酶(λexo)均采购自New England Biolabs公司;DNA 探针PNKTb(序列为5′- CCTAACCCTTTTTAGGGTTAGGGT TAGGGTTAGGG -3′)合成纯化于Sangon Biological Engineering Technology & Services公司,DNA探针用 Tris-EDTA 缓冲液配备成溶液后置于-20 ℃下保存,待用;TbCl3、ATP、二磷酸腺苷(adenosine diphosphate,ADP)均采购自美国Sigma-Aldrich公司;MgCl2采购自Sinopharm Chemical Reagent公司;实验所用缓冲液均是Tris-HCl缓冲液(70 mmol/L,pH 8.0);实验所使用的超纯水是通过18.25 MΩ·cm-1的Milli-Q净水系统所获得。
1.2 实验仪器
荧光分光光度计,F-2700型,日本高新技术公司;漩涡振荡器,MX-E型,大龙兴创实验仪器(北京)有限公司;恒温水浴锅,CH1015型,上海恒平科学仪器有限公司;微量进样器,瑞士Hamilton公司。
1.3 实验方法
1.3.1 实验原理
图1阐述了基于 DNA 荧光探针的T4 PNK活性检测的基本反应原理。首先,本课题组设计了可以形成发卡结构的DNA探针PNK-Tb,在发卡探针3’末端具有一段富含G-的碱基序列(图中的蓝色结构)。正常情况下,PNK-Tb探针通过形成发卡结构,使探针3’末端富含G的碱基序列大部分被封闭在发卡结构的茎部双链中,因此导致与Tb3+结合形成的G-四链体结构减少,最终只能检测到微弱的荧光信号。当加入T4 PNK之后,T4 PNK可在ATP提供磷酸基团的情况下,在PNK-Tb探针形成的发卡结构5’-羟基末端加上磷酸基团,转变成5’磷酸化末端,然后在工具酶λexo(一种能够特异性水解5’磷酸化双链末端的核酸外切酶)的作用下,将发卡结构5’磷酸化末端水解,从而使发卡结构打开,释放出其3’末端富含G的碱基序列,通过与Tb3+结合使荧光信号提升[22-23]。对比加入T4 PNK前后的荧光变化,可以对T4 PNK活性进行定量检测分析。
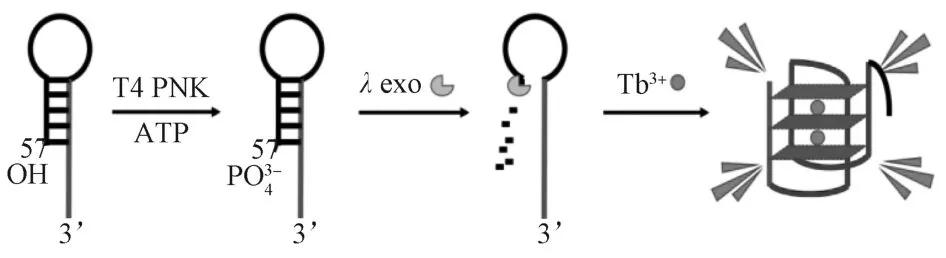
图1 实验原理图Fig.1 Schematic illustration for T4 PNK activity detection

彩图
1.3.2 荧光测定与其信号处理
实验选用的荧光染料Tb3+的激发波长为260 nm,发射波长为545 nm。发射波长区间设置为460~560 nm,激发狭缝为5.0 nm,发射狭缝为10.0 nm,测量电压为700 V。测量时,应极其注意玻璃皿的清洁程度。测量体系应为100 μL。多次测量,直至观测到荧光值稳定后,取该值作为本轮测量的最终数据。实验数据均通过多次重复试验(n≥3)。
1.3.3 反应条件的优化
为了获得实验最佳的灵敏度、节约试剂用量,本课题组对Mg2+浓度、ATP 浓度、λexo浓度、Tb3+浓度多个核心反应条件进行了优化。
1)Mg2+浓度优化
首先,在100 μL Tris-HCl缓冲液(70 mmol/L,pH 8.0)中加入200 nmol/L PNK-Tb 探针和不同浓度的Mg2+(1.0, 5.0, 10.0, 15.0, 20.0 mmol/L),在 37 ℃水浴反应5 min;然后,将20 U/mL T4 PNK、1 mmol/L ATP以及8 Uλexo加入上述反应体系中并继续在37℃水浴反应30 min;最后,加入150 μmol/L荧光染料 Tb3+,常温下避光反应15 min;随后进行荧光测定。
2)ATP浓度优化
首先,在100 μL Tris-HCl缓冲液(70 mmol/L,pH 8.0)中加入200 nmol/L PNK-Tb 探针和最佳浓度的 Mg2+,在37 ℃水浴反应5 min;然后,分别将20 U/mL T4 PNK、不同浓度的ATP(0.2, 0.5, 1.0, 3.0, 5.0 mmol/L)以及8 Uλexo加入上述反应体系中并继续在37 ℃水浴反应30 min;最后,加入150 μmol/L 荧光染料Tb3+,常温下避光反应15 min;随后进行荧光测定。
3)λexo 浓度优化
首先,在100 μL Tris-HCl缓冲液(70 mmol/L,pH 8.0)中加入200 nmol/L PNK-Tb 探针和最佳浓度的Mg2+,在37 ℃水浴反应5 min;然后,分别将20 U/mL T4 PNK、最佳浓度的ATP以及不同浓度的λexo(1.0, 5.0, 8.0, 12.0, 16.0 U)加入上述反应体系中并继续在37 ℃水浴反应30 min;最后,加入150 μmol/L 荧光染料Tb3+,常温下避光反应15 min;随后进行荧光测定。
4)Tb3+浓度优化
首先,在100 μL Tris-HCl缓冲液(70 mmol/L,pH 8.0)中加入200 nmol/L PNK-Tb 探针和最佳浓度的Mg2+,在37 ℃水浴反应5 min;然后,分别将20 U/mL T4 PNK、最佳浓度的ATP以及最佳浓度的λexo加入上述反应体系中并继续在37 ℃水浴反应30 min;最后,加入不同浓度的荧光染料Tb3+(20.0,50.0, 100.0, 200.0, 300.0 μmol/L),常温下避光反应15 min;随后进行荧光测定。
1.3.4 T4 PNK活性分析
本文根据所测定的最优实验条件,对T4 PNK进行定量分析。在100 μL反应缓冲液中加入200 nmol/L PNK-Tb探针和最佳浓度Mg2+,在37 ℃水浴反应5 min后加入一系列的T4 PNK(0~100 U/mL);然后,将最佳浓度的ATP、T4 PNK以及λexo加入上述反应体系中,继续在37 ℃水浴反应30 min;最后,加入最佳浓度的荧光染料Tb3+,常温下避光反应15 min后进行荧光测定。
1.3.5 T4 PNK抑制剂分析
以ADP作为T4 PNK 活性的抑制剂。在100 μL反应缓冲液中加入200 nmol/L PNK-Tb探针和10 mmol/L Mg2+,置于37 ℃水浴反应5 min后加入50 U/mL T4 PNK;然后,将最佳浓度的ATP、T4 PNK以及λexo加入上述反应体系中,并加入一定量的ADP,继续置于37 ℃水浴反应30 min;最后,加入最佳浓度的荧光染料Tb3+,置于常温下避光反应15 min后进行荧光测定。
2 结果与讨论
2.1 实验条件优化结果
为了获得最佳的实验结果,本课题组对可能影响检测性能的条件进行了优化。其中,Mg2+浓度对发卡结构的稳定性有重要作用。ATP为T4 PNK磷酸化反应提供磷酸基团。λexo可以特异性切割DNA双链磷酸化末端,从而释放富含G的碱基序列,因此其浓度的变化对切割效率有重要的影响。Tb3+可以与G-四链体结合产生显著的荧光信号,其浓度的变化直接影响荧光强度。基于上述因素,在下文中对Mg2+、ATP、λexo及Tb3+浓度分别进行了优化。
2.1.1 Mg2+浓度优化
根据实验结果绘制图2。

图2 反应放大比随Mg2+浓度变化的曲线图Fig.2 The effect of the concentration of Mg2+
图2中,F0为不加T4 PNK的荧光强度,F为加入T4 PNK后的荧光强度。由图可知,随着Mg2+浓度的增强,反应效果不断增大,当浓度为10 mmol/L时达到峰值,继续增加Mg2+浓度,反应的放大效果反而降低。因此,10 mmol/L是Mg2+的最佳浓度,用于后续实验。
2.1.2 ATP浓度优化
ATP在本实验中主要是提供PO43-。ATP浓度优化结果如图3所示。由图可知,随着ATP浓度增加,反应效果逐渐提高,并在ATP浓度为1 mmol/L处达到最大值,然后随着ATP浓度的增加,反而会抑制反应的进行,导致反应的放大比例降低。因此,选择浓度为1 mmol/L的ATP用于之后的反应。

图3 反应放大比随ATP浓度变化的曲线图Fig.3 The effect of the concentration of ATP
2.1.3 λ exo浓度优化
根据实验结果绘制图4。

图4 反应放大比随λ exo浓度变化的曲线图Fig.4 The effect of the concentration of λ exo
由图4可知,随着λexo浓度的提高,其切除DNA双链磷酸化末端的作用逐渐增强,在λexo活性达到8 U时,反应的荧光放大比例达到最大值;但再继续提高λexo浓度,反应的放大比例反而有所减小,说明高浓度的λexo对该反应有一定的抑制效果。因此,将8U的λexo加入反应体系,用于后续实验。
2.1.4 Tb3+浓度优化
Tb3+主要是用来与反应生成的G-rich序列形成G-四链体结构,从而产生荧光。根据实验结果绘制图5。由图可知,随着Tb3+浓度的增强,荧光强度的放大比例不断增大,当浓度为200 μmol/L时达到最大值,继续增加Tb3+浓度,反应的放大效果反而降低。因此,将浓度为200 μmol/L的Tb3+用于后续实验。
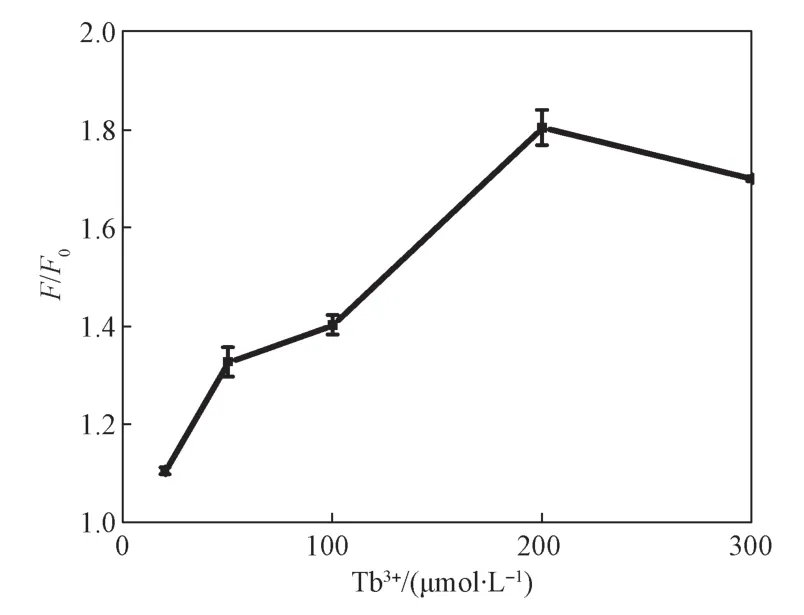
图5 反应放大比随Tb3+浓度变化的曲线图Fig.5 The effect of the concentration of Tb3+
2.2 T4 PNK的活性分析及标准曲线绘制
取得最优实验条件后,本课题组对不同浓度T4 PNK(0, 2, 4, 6, 8, 10, 50, 100 U/mL)活性进行了分析。T4 PNK的考察区间为0~10 U/mL。图6是不同的DNA聚合酶浓度与反应荧光放大倍数的对应关系。

图6 T4 PNK浓度与荧光放大倍数的关系曲线Fig.6 The relationship of fluorescence magnification to concentration of T4 PNK
由图6可知,当T4 PNK的浓度为0~10 U/mL 时,两者呈线性关系,其线性方程式为
Y=109.158 34+11.790 46X,R2=0.997 8。
另外,本实验的检测下限为2.0 U/mL。
图7是不同浓度T4 PNK酶的荧光光谱图。由图可知,随着T4 PNK浓度的增加,同一时间内荧光强度增加的量也逐渐增加。因此,通过使用廉价又简单的荧光染料,本课题组成功地构建了一种低成本和高灵敏的DNA聚合酶活性实时监测方法。

图7 不同T4 PNK浓度下的荧光光谱图Fig.7 Fluorescence intensity of different concentrations of T4 PNK
2.3 T4 PNK特异性分析
为了进一步评估本文分析方法的特异性,本实验选取了4种酶UDG、BSA、EcoRⅠ和ExoⅠ用作特异性实验分析,结果如图8所示。

图8 特异性分析Fig.8 Selectivity study
由图8可知,含有UDG、BSA、EcoRⅠ和ExoⅠ的实验样品与空白组相比,荧光值没有明显变化,这说明4种酶在整个反应体系没有发挥作用,并不能导致上述反应的发生,而加入T4 PNK的实验样品中荧光强度的变化非常明显。可见,本实验方法对T4 PNK具有良好的选择特异性。
2.4 T4 PNK 抑制剂的筛选
在药物筛选上T4 PNK抑制剂分析有着重要意义。ADP是一种常见的T4 PNK抑制剂。本实验之所以选择ADP作为模式抑制剂,是因为大量研究表明10 mmol/L以下的ADP对λexo的活性没有影响。根据实验结果绘制图9,其中横坐标代表实验所加ADP的浓度,纵坐标代表相对活性。由图可知,相对活性随ADP浓度升高而下降,说明抑制效果随ADP浓度升高而增大,当ADP浓度为4 mmol/L时,抑制率可达到90 %以上,说明ADP作为T4 PNK的抑制剂,具有良好的抑制效果。因此,本文方法能应用于T4 PNK抑制剂的筛选,且在小分子药物筛选甚至生物化学机理研究中皆具有应用前景,可以为以后生产抑制T4 PNK活性的药物打下基础。

图9 ADP对T4 PNK活性的影响Fig.9 The effect of ADP on T4 PNK activity
3 结语
T4 PNK是DNA 复制和损伤修复中的重要角色。T4 PNK活性异常与许多疾病有关,因此开发出一种快速、经济、灵敏、操作简单的检测方式对T4 PNK活性进行检测并且筛选其抑制剂,对临床诊断研究以及现代医药研究具有重大意义。因此,本课题组基于免淬灭标记荧光探针对T4 PNK的活性进行了荧光检测以及抑制剂分析,创新性地将稀土元素Tb3+应用到 T4 PNK活性的检测中,构建并验证了一种快速地检测T4 PNK新方法,探究了该实验方法的最佳实验条件,同时为该实验找了合适的抑制剂ADP,使得反应可控、高效进行。根据实验结果,本课题组绘制了一定浓度范围内的T4 PNK标准曲线,以实现在一定范围内快速测定T4 PNK浓度,为T4 PNK的后续研究提供一些思考。
本文检测方法的反应时间较短(不超过60 min),所需的试剂价格低廉,在很大程度上降低了实验检测成本。因此,该方法在生物药物开发以及生物化学研究中具有良好的应用前景。

