消痰化瘀利窍方防治阻塞性睡眠呼吸暂停合并高血压的临床疗效及对内皮损伤的保护作用*
河北中医学院
李文瑾 吉恩生 田小超△ 张睦清△△ 张一昕 郭秋红(石家庄 050200)
提要 目的:研究消痰化瘀利窍方对痰瘀互结型阻塞性睡眠呼吸暂停(OSA)合并高血压患者治疗效果及内皮损伤的保护作用。方法:将60例患者随机分为观察组和对照组,每组30例。对照组予口服降压药常规治疗,观察组在对照组的基础上服用消痰化瘀利窍方治疗。3个月后观察患者体质量指数(BMI)、睡眠呼吸暂停低通气指数(AHI)、夜间最低血氧饱和度(LSaO2)及血清或血浆肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、血浆内皮素1(ET-1)、NO和血管内皮生长因子(VEGF)水平的变化情况。结果:治疗3个月后,观察组BMI、AHI显著下降,LSaO2升高,TNF-α、IL-6、ET-1和VEGF均较治疗前明显下降,NO升高(P<0.05或P<0.01)。治疗后观察组各项指标均明显优于对照组,差异具有显著性(P<0.05或P<0.01)。结论:消痰化瘀利窍方能有效改善OSA患者AHI和BMI,提高LSaO2,显著提高临床疗效,且具有一定抗炎、保护内皮损伤作用。
阻塞性睡眠呼吸暂停(OSA)已被证实是高血压的独立危险因素,其可增加诸多疾病的发病率与死亡率,诱发糖尿病、肺动脉高压、心衰、冠心病、中风、认知功能障碍等并发症。OSA合并高血压的相关机理较为复杂,主要包括肾素血管紧张素系统激活、交感神经兴奋性增强、内皮损伤及氧化应激等。对于OSA的治疗,现代医学多采用戒烟限酒、减肥、呼吸机治疗、口腔正畸及矫治器、局部手术等方法。鉴于OSA多系统、多器官、多靶点的致病特点,西医药物治疗仍在探索阶段,没有系统的治疗方案。
中医学将OSA归属“鼾症”范畴,对其病因、病机已有深入认识,通过辨证论治可有效缓解临床症状,减少多种并发症的发生。鼾症研究分型众多,但目前缺少针对每个证型的有效方剂进行系统临床观察及机制探讨。消痰化瘀利窍方是由我校OSA中医药防治团队在总结多年临床经验的基础上得出的治疗肺气失宣、脾虚失运、痰瘀互阻型鼾症的经验方,长期服用能明显改善OSA患者睡眠呼吸暂停或憋醒、昏沉嗜睡、精神不振、肥胖进行性加重以及合并高血压的头晕头痛等临床症状。前期动物实验研究表明消痰化瘀利窍方可显著调控慢性间歇性低氧诱发大鼠血压升高,有效保护血管内皮细胞及心肌细胞形态和功能[1-2]。本研究拟通过观察消痰化瘀利窍方对OSA合并高血压患者临床疗效及机制探讨,为痰瘀互结型鼾症提供有效治疗方药,并为临床应用提供理论依据。
1 临床资料
1.1 一般资料 选取2017年1月至2020年11月河北中医学院门诊部等收治的OSA合并高血压患者60例作为研究对象,随机分为观察组和对照组,每组30例。观察组:男性25例,女性5例;年龄范围在42~57岁,平均年龄(49±7)岁;病程范围为5~10年,平均病程7年。对照组:男性26例,女性4例;年龄范围在41~57岁,平均年龄(48±8)岁;病程范围在5~11年,平均病程8年。通过比较2组患者年龄、病程等资料显示,差异无显著性(P>0.05)。
1.2 临床诊断标准
1.2.1 西医诊断标准:OSA诊断参照《OSA低通气综合征诊治指南( 2011 年修订版)》:多导睡眠监测( PSG) 显示每夜7 h睡眠中低通气及呼吸暂停反复发作30次以上或睡眠低通气指数和呼吸暂停≥5次/h者,呼吸暂停主要为阻塞性;高血压诊断标准依据《中国高血压防治指南2010》:在未使用降压药物的情况下,收缩压(SBP)≥140 mmHg和(或)舒张压(DBP)≥90 mmHg。
1.2.2 中医辨证分型标准:参考《中药新药临床研究指导原则》及《中医内科学》。睡则打鼾,鼾声响亮,时断时续;睡眠不实,反复出现呼吸暂停及憋醒;舌质紫黯,舌下静脉紫,或舌体胖大、边有齿印、苔厚腻或黄或白,脉弦滑或沉涩;经至少2位中医医师辨证属痰瘀互结型。
1.3 纳入标准 符合西医OSA及高血压诊断标准;符合中医痰瘀互结型辨证标准;年龄在40~60岁之间;一直应用口服降压药控制血压,且血压比较平稳;愿意接受并配合治疗、观察者。
1.4 排除标准 合并急性心脑血管疾病或有肝肾功能不全病史;正在服用镇静安眠药;依从性差,不能及时随诊者。
2 治疗方法
2.1 对照组 继续接受西医常规口服降压药治疗,临床研究过程中患者服用的降压药种类、剂量保持稳定,基本不做调整。
2.2 观察组 在常规降压药治疗基础上配合消痰化瘀利窍方治疗:丹参30 g,桔梗20 g,生黄芪、茯苓、枳壳、赤芍各15 g,法半夏、郁金、石菖蒲、炒白术、射干、川芎、地龙各12 g,陈皮、白芥子各10 g。水煎分早、晚2次服用。2个月为1个疗程。
3 疗效观察
3.1 观察指标
3.1.1 体质量指数(BMI):记录2组患者用药前后身高、体质量,计算BMI变化情况。
3.1.2 多导睡眠图(PSG)监测:应用美国ResMed公司睡眠呼吸监测仪(MODEL 8000SM)进行夜间睡眠时不少于7 h的呼吸监测,记录2组患者用药前后睡眠呼吸暂停低通气指数(AHI)、夜间最低血氧饱和度(LSaO2)指标变化情况。
3.1.3 血液指标检测:治疗前后采用酶联免疫吸附法(ELISA)检测血清白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)及血浆内皮素1(ET-1)、血管内皮生长因子(VEGF)含量;硝酸还原酶法测定血清NO含量。
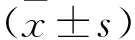
4 结果
4.1 2组患者BMI、AHI和LSaO2情况 2组患者治疗前BMI、AHI和LSaO2差异无显著性(P>0.05)。治疗后观察组BMI、AHI较治疗前明显下降,LSaO2显著升高(P<0.05或P<0.01);对照组则差异均无显著性(P>0.05);治疗后观察组BMI、AHI较对照组显著下降,LSaO2显著升高(P<0.05或P<0.01)。详见表1。
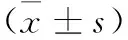
表12组患者治疗前后BMI、AHI和LSaO2情况比较
4.2 2组患者血清IL-6、TNF-α情况 2组患者治疗前血清IL-6、TNF-α差异无显著性(P>0.05)。治疗后观察组IL-6、TNF-α较治疗前明显下降性(P<0.05或P<0.01),对照组则差异无显著性(P>0.05);治疗后观察组2项指标较对照组均显著降低(P<0.05或P<0.01)。详见表2。

表2 2组患者治疗前后血清TNF-α、IL-6比较
4.3 2组患者血浆ET-1、VEGF和血清NO情况 2组患者治疗前血浆ET-1、VEGF和血清NO差异无显著性(P>0.05)。治疗后观察组ET-1、VEGF较治疗前明显下降,NO显著升高(P<0.05或P<0.01);对照组则差异无显著性(P>0.05);治疗后观察组ET-1、VEGF较对照组显著下降,NO显著升高(P<0.05或P<0.01)。详见表3。

表3 2组患者治疗前后血浆ET-1、VEGF和血清NO情况比较
5 讨论
OSA为现代医学病名,中医将其归属为“鼾症”范畴,早在诸多古籍中已有对此病的相关表述,《黄帝内经》称其为“息有音”,《伤寒论》记载“风温为病,鼻息必鼾”。隋代巢元方在《诸病源候论》中描述:“鼾眠者,眠里咽喉间有声也……其有肥人眠作声者,但肥人气血沉厚,迫隘喉间,涩而不利亦作声。”此处定义的打鼾,与临床常见的OSA患者大多肥胖,夜间睡眠时打鼾、呼吸不规律以及白天嗜睡、乏力、睡不解乏、头痛头昏等症状相一致。历代医家虽对此病具有不同见解,但均认为鼾症病位在喉,与肺、脾、肾三脏功能失司相关,主要致病因素为痰、瘀、虚,属虚实夹杂之证[3]。根据中医治疗OSA证治分布规律研究发现脾虚痰湿、痰热阻肺、痰瘀互结、痰湿瘀结、湿瘀互结为OSA常见的分型,可见,痰瘀为OSA最主要的致病因素。脾主运化,脾胃的运化功能失司,则水谷精微不得上输于肺,聚而成痰,痰湿困脾,久而累及于肺,痰气互结阻滞气机,引发OSA相关症状,气机郁久化热耗伤津液,入络成瘀。在疾病的早期,主要以痰浊为主且贯穿病程的始终,中期渐生瘀血,痰瘀互结,后期累及脏腑导致脏腑虚损与痰瘀并存,形成本虚标实之证。
OSA的治疗根据正虚邪实的偏胜偏衰,采用祛邪与扶正两种治疗原则,标实者祛痰化瘀、清热开窍;本虚者则健脾益肺、固本培元、化痰通窍。消痰化瘀利窍方以二陈汤为基础方,法半夏、陈皮、茯苓燥湿化痰;郁金、石菖蒲祛痰开窍;炒白术、生黄芪健脾益气、燥湿利水;桔梗、枳壳、白芥子、射干宣肺利咽、祛痰理气;川芎、丹参、赤芍活血祛瘀、通经活络;地龙清热息风通络。全方既能扶正,又兼具补虚,符合OSA的病因病机。在此次的研究结果中发现,与对照组相比,观察组可有效降低体质量指数,改善肥胖。
既往研究表明,AHI与血压水平呈正相关,且AHI的增加会引发血压的升高[4]。OSA可引起夜间血压升高,导致血压水平变异性增加,引发肌体糖脂代谢紊乱,影响患者左心结构,甚至造成靶器官损害。另外,OSA的严重程度与控制的血压水平相关,血压水平调控不佳也可能会引起OSA的加重,有研究表明,与单纯高血压患者相比,高血压合并OSA患者可随OSA的严重程度有所升高[5],因此,改善OSA对于调控血压具有重要的临床意义。当前,对于OSA的临床治疗多以经鼻持续气道正压通气疗法进行治疗[6],但效果并不理想;若单纯口服降压药难以达到改善OSA患者临床症状及并发症的目的。近几年,中医以其整体观念、辨证论治的诊疗体系在改善OSA方面展现出广阔的应用前景。本研究在口服常规降压药的同时服用消痰化瘀利窍方,结果显示AHI显著下降,LSaO2显著升高,说明消痰化瘀利窍方可有效改善OSA患者临床体征。
除此之外,OSA的病理过程还与炎性因子的释放与血管内皮细胞的损伤具有内在联系。OSA合并高血压发病机制较为复杂,涉及肾素血管紧张素系统的激活、交感神经兴奋性增强、内皮损伤、氧化应激等病理过程[7]。ET-1与NO均为血管内皮活性物质,在诱发心血管疾病过程中起着至关重要的作用,ET-1是目前公认的血管内皮细胞分泌与合成的强有力的血管收缩物质[8],其需要与特异性受体ETA与ETB结合才能发挥生物活性;在生理状态下,NO可起到舒张血管的作用,与ET-1处于一种动态平衡之中,当血管内皮发生障碍时,ET-1水平升高,NO生物利用率降低,导致ET-1/NO比列失衡。VEGF是一种可特异性作用于血管内皮并参与调节血压的生长因子[9],OSA患者睡眠过程中低通气与反复呼吸暂停可导致肌体缺氧,诱发低氧诱导因子(HIF-1)上调,进一步激活VEGF家族,正常生理状态下VEGF可促进血管新生,增加血供,缓解缺氧状态,但过度表达的VEGF通过与其受体VEGFR结合诱导血管内皮细胞、血管平滑肌细胞增殖或迁移,引起血管壁加厚,管腔狭窄,导致内皮细胞功能障碍[10]。
OSA合并高血压患者由于睡眠时呼吸道狭窄或阻塞引起的缺氧可刺激中枢和外周化学感受器,导致交感神经兴奋,从而使血压升高。一方面,体内炎性因子与黏附分子的刺激可通过损伤血管内皮,增加血管阻力,导致水盐代谢紊乱升高血压;另一方面OSA也可诱导如TNF-α、IL-6等炎性因子的释放和黏附分子ICAM-1、VCAM-1的表达,使血管变性升高血压。此次研究中治疗后观察组ET-1、VEGF较对照组显著下降,NO显著升高,IL-6、TNF-α表达显著下调,表明消痰化瘀利窍方可显著降低OSA合并高血压患者炎性因子表达,改善内皮功能障碍。
综上所述,消痰化瘀利窍方具有化痰祛湿的作用,可有效降低OSA合并高血压患者体质量指数,改善肥胖;可通过降低炎性因子的表达,调节血压,维持ET-1/NO舒缩平衡,保护血管内皮损伤,从而达到治疗痰瘀互结型OSA合并高血压目的。

