废弃电子垃圾拆解地野生鱼类卤系阻燃剂残留
吴江平,冯文露,吴思康,胡 钰,麦碧娴
废弃电子垃圾拆解地野生鱼类卤系阻燃剂残留
吴江平1*,冯文露1,吴思康1,胡 钰1,麦碧娴2
(1.安徽师范大学生态与环境学院,安徽 芜湖 241002;2.中国科学院广州地球化学研究所,广东 广州 510640)
为了解废弃拆解地环境中电子垃圾相关污染物的含量水平及其生态风险,本文测试了华南某废弃电子垃圾拆解地野生鲮鱼和鲫鱼体内多溴联苯醚(PBDEs)、多溴联苯(PBBs)、得克隆(DP)和替代型溴系阻燃剂(ABFRs)等卤系阻燃剂(HFRs)的含量和组成,评估了这些污染物对于野生鱼类及食鱼野生动物的生态风险.电子垃圾拆解地鲮鱼和鲫鱼体内∑HFRs的含量范围分别为1230~1680和141~650ng/g,高于对照区1~2个数量级,表明虽然粗犷的电子垃圾回收活动已禁止多年,当地野生鱼类仍然受到HFRs严重污染.PBDEs是鱼体内最主要的HFRs,鲮鱼和鲫鱼体内其分别占∑HFRs的96%和89%.鲮鱼和鲫鱼体内HFRs含量和组成均存在显著差异,可能与其生活习性、营养级和脂肪含量不同有关.风险评估结果显示,PBDEs对野生鱼类及食鱼野生动物均具有较大的生态风险.
卤系阻燃剂;多溴联苯醚;电子垃圾;野生鱼类;生态风险
卤系阻燃剂(HFRs)是一类具有阻燃能力的含卤素(主要为溴和氯)有机化合物,被广泛添加于塑料、纺织品和电子电器等产品中以降低其发生火灾的风险[1].多溴联苯(PBBs)、多溴联苯醚(PBDEs)和得克隆(DP)是使用量较大的HFRs.由于这些化合物在环境中具有持久性、可生物蓄积性、长距离迁移性和较强的生物毒性,PBBs和PBDEs已经自动退出生产或被政府(组织)禁用或限用,DP最近也被斯德哥尔摩公约持久性有机污染物(POPs)审查委员会认定符合POPs标准[2].然而,这些化合物还将从已添加的产品及污染的环境介质(土壤和沉积物等)中持续释放到环境.此外,为了达到严格的消防标准,生产厂家逐渐使用一些非PBDE类溴系阻燃剂替代已禁用的PBDEs[3].与PBDEs相似,这些替代型溴系阻燃剂(ABFRs)在产品的使用过程中和产品废弃后处置不当很容易释放到环境[3],这些新型污染物对区域和全球环境的不利影响及其潜在的生态风险也引起了高度关注[3-4].
废弃电子电器产品(电子垃圾)拆解地是HFRs典型污染地[5-6].由于严重的环境污染,我国在2010年前后开始禁止酸洗和焚烧等粗犷的电子垃圾回收方式,并取缔家庭作坊式手工拆解活动,许多电子垃圾拆解地被废弃[6].然而,废弃电子垃圾拆解地环境中HFRs含量仍然较高[6].野生鱼类在食物网上既是捕食者,又是被捕食者,对于生态系统的物质循环和能量流动起着重要作用.PBDEs等HFRs暴露对野生鱼类从个体和种群水平都可以产生不利影响[7-8],从而可能损害生态系统的正常功能[9].此外,野生鱼体内的HFRs可以通过食物链传递在食鱼野生动物体内蓄积,并对这些野生生物产生毒害作用.最近的研究显示,废弃电子垃圾拆解地野生鱼体内HFRs含量较高[10-11],这些废弃场地中野生鱼类HFRs的含量、组成及暴露风险尚需深入研究.
广东省清远市龙塘镇是我国主要的电子垃圾拆解地之一.该地电子垃圾拆解活动始于20世纪90年代初,高峰时期约有1300个手工作坊式拆解工厂,每年电子垃圾拆解量超过170万t,是我国最大的电子垃圾拆解地之一.由于严重的环境污染,当地政府于2014年前后取缔了粗犷的电子垃圾拆解活动.为了探寻电子垃圾拆取缔后当地环境中HFRs残留水平,本研究测试了该废弃电子垃圾拆解地野生鲮鱼和鲫鱼体内PBDEs、PBBs、DP和6种ABFRs(十溴二苯乙烷(DBDPE)、1,2-双(2,4,6-三溴苯氧基)乙烷(BTBPE)、六溴苯(HBB)、五溴甲苯(PBT)、五溴乙苯(PBEB)和二甲基四溴苯(pTBX))等HFRs的含量与组成,并评估了这些污染物暴露对野生鱼类及食鱼野生动物的生态风险.
1 材料与方法
1.1 样品采集
鲮鱼(=10)和鲫鱼(=10)于2015年采集于广东省清远市龙塘镇废弃电子垃圾拆解地一自然池塘(23°36′N,113°04′E).所有鱼类样品的体长均<15cm.同时,在非电子垃圾拆解地(离该电子垃圾拆解地以北约100km)一自然池塘采集了大小相似的鲮鱼(=6)和鲫鱼(=6)作为对照样品.样品采集后冰袋保存,运回实验室后置-20°C保存.
1.2 HFRs含量测定
样品经真空冷冻干燥48h后,每条整鱼样品用粉碎机粉碎、混匀.准确称取约2g混匀后样品,用无水硫酸钠研磨并添加回收率指示物(BDE-77、BDE-181和13C-BDE-209).样品经丙酮/正己烷混合溶剂(1/1,/)索氏抽提48h.抽提液浓缩至10mL,取1mL进行脂肪含量测定(重量法).剩余9mL抽提液浓缩后经凝胶渗透色谱柱去除脂肪,并经多层硅胶氧化铝色谱柱进一步净化.净化后的抽提液旋转蒸发浓缩后转换溶剂为正己烷.氮吹至近干,用异辛烷定容至200μL,加入定量内标(BDE-118和BDE- 128)后利用气相色谱/质谱(GC/MS)测试.样品前处理具体过程参见文献[12].
使用GC-MS-NCI(Agilent 7890A-5975MS)测定HFRs含量[10,12].采用DB-XLB毛细色谱柱(30m× 250mm i.d.×0.25μm;J&W Scientific)分离低溴代PBDE同系物(BDE-28、BDE-47、BDE-66、BDE- 99、BDE-100、BDE-138、BDE-153、BDE-154和BDE-183)、BB-153、BB-209、-DP、-DP、HBB、PBT和PBEB.高溴代PBDE同系物(BDE-196、BDE-197、BDE-202、BDE-203、BDE-206、BDE-207、BDE-208和BDE-209)、DBDPE和BTBPE采用DP-5HT毛细色谱柱(15m×0.25mm i.d.×0.10μm;J&W Scientific)分离.载气为高纯氦气,反应气为甲烷.离子源压力为2.4× 10-3Pa,离子源温度为230℃,界面温度280℃.采用无分流进样,进样量为1 μL,进样口温度290℃.GC升温程序参照文献[10,12].MS采用选择性离子模式(SIM),目标化合物扫描离子荷质比(/):DP为653.8和651.8,13C-BDE-209为486.7和488.7,其它目标化合物为79和81.
1.3 质量保证与质量控制(QA/QC)
质量控制和保证措施包括回收率指示物添加、程序空白、基质加标和样品重复样分析等.真实样品中回收率指示物BDE-77、BDE-181和13C-BDE- 209的平均回收率分别为94.3%、98.9%和89.8%.基质加标(4种ABFRs、-DP、-DP和11个PBDE同系物)得到的加标物的回收率范围为75.9%~104%.每批11个样品设置1个程序空白样品.程序空白中检测到DP和一些PBDE同系物,但含量低于真实样品中该化合物含量的1%.样品最终含量经空白校正.3个鲮鱼样品重复样中目标化合物(除BDE-209)测定值的相对标准偏差(RSD)均<10%, BDE-209的RSD为28%.
目标化合物的检测限(LOD)按程序空白中的含量加3倍标准偏差计算.对于程序空白中未检出的化合物,其LOD按5倍信噪比(S/N)计算.鱼体样品中PBDEs和PBBs、DPs和ABFRs的检测限分别为0.04~0.11、0.01~0.05和0.01~0.11ng/g湿重.
2 结果与讨论
2.1 鱼体中HFRs含量
废弃电子垃圾拆解地及对照区野生鲮鱼和鲫鱼样品中∑PBDEs(17个PBDE同系物含量之和)、∑PBBs(BB-153和BB-209含量之和)、∑DPs(- DP和-DP含量之和)和∑ABFRs(DBDPE、BTBPE、HBB、PBT、PBEB和pTBX含量之和)含量见表1.电子垃圾拆解地鱼类样品中∑PBDEs、∑PBBs和∑DPs的含量高于对照区1~3个数量级, ∑ABFRs含量也是对照区的2~3倍,表明当地野生鱼类已受到HFRs严重污染.鲮鱼体内∑PBDEs脂肪归一化含量(均值:24.8μg/g)与2010年(整鱼,32~ 39μg/g)[13]、2014年(肌肉,18μg/g)[11]和2016年(整鱼,12μg/g)[10]采集于同一电子垃圾拆解地鲮鱼体内∑PBDEs含量相当.鲫鱼体内∑PBDEs脂肪归一化含量(均值:22.3μg/g)和∑ABFRs含量(均值:430ng/g)也与2016年采集于该废弃电子垃圾拆解地鲫鱼体内这些污染物含量(∑PBDEs:20.6μg/g,∑ABFRs: 130μg/g)[10]相近.然而,废弃电子垃圾拆解地鲮鱼体内∑PBDEs、∑DPs和DBDPE脂肪归一化含量高于华南非电子垃圾拆解地野生鲮鱼体内这些污染物的报道值(∑PBDEs:9.3~170ng/g,∑DPs:1.9~36ng/g, DBDPE:0.09~1.3ng/g)[11]1~4个数量级.这些研究表明,尽管粗犷的电子垃圾拆解活动已经取缔,当地野生鱼体中HFRs含量仍然极高.废弃电子垃圾拆解地野生鱼体内较高的HFRs含量可能与下列因素有关:(一)这些污染物在环境中的自然降解速度较慢;(二)早期电子垃圾拆解过程中随意丢弃的塑料等不可回收部分在南方常年气温较高的条件下,这些废弃物中HFRs等挥发性有机污染物很容易释放到环境,从而在生物体内蓄积;(三)已经受到HFRs污染的环境介质(如早期焚烧迹地土壤)是废弃电子垃圾拆解地重要的污染源[6],这些介质中的HFRs在合适条件下经淋溶、挥发等方式再次进入到环境并在野生鱼体内蓄积.电子垃圾拆解地废弃后,当地传统的农业生产活动(如水产养殖和水稻种植等)仍在进行,当地环境中极高的HFRs等电子垃圾相关污染物对野生生物及居民的健康影响应引起高度关注.
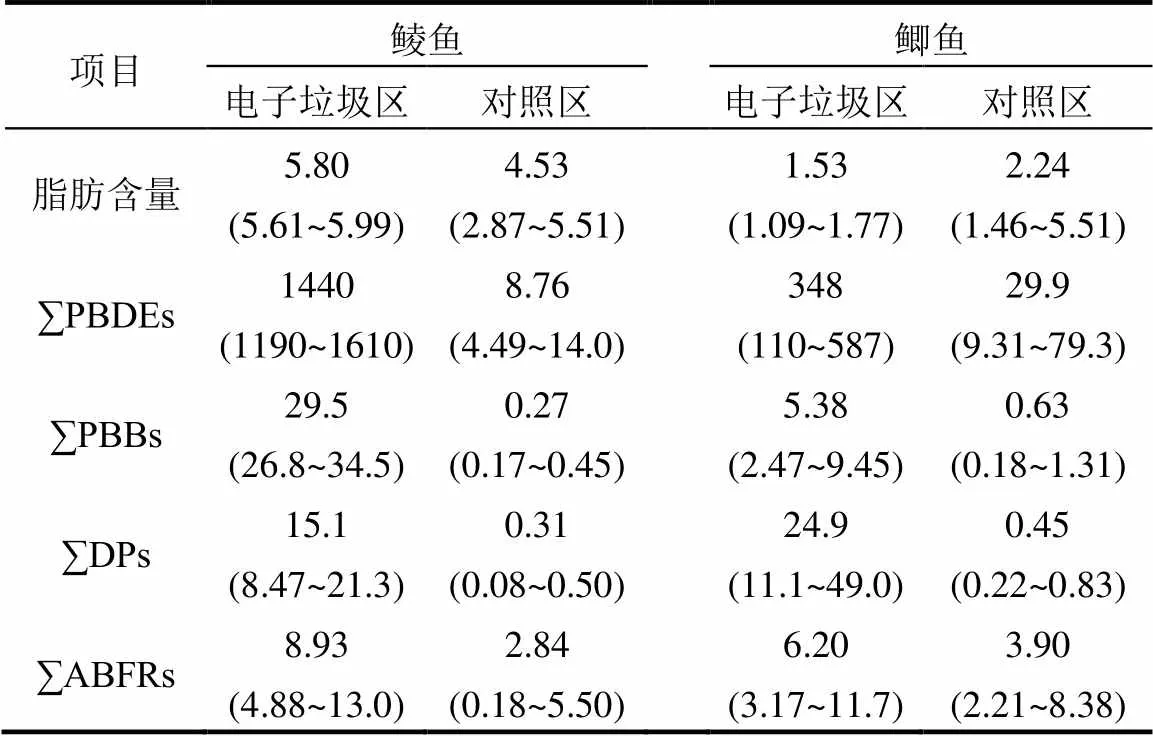
表1 废弃电子垃圾拆解地和对照区野生鲮鱼和鲫鱼脂肪(%)及HFRs含量(ng/g)
注:括号内为范围,括号外为均值.

*< 0.05, **< 0.0001
鲮鱼体内∑PBDEs、∑PBB和∑ABFRs等HFRs的含量均显著高于鲫鱼(检验,<0.05)(图1(a)).鲮鱼是一种底层鱼类,主要以藻类、高等植物残体及有机碎屑为食,摄食时喜用下颌在沉积物表面刮取着生藻类.HFRs是一类憎水性有机污染物,其在水体中主要分布于沉积物及有机颗粒物中[2-4],鲮鱼独特的生活和摄食习性可能导致了其体内HFRs的高蓄积.此外,生物的脂肪含量也是影响HFRs等亲脂性有机污染物生物蓄积的重要因素.本研究鲮鱼体内脂肪含量(5.8%)显著高于鲫鱼(1.5%)(图1(b)),从而导致了鲮鱼体内HFRs含量较高.鱼类的食量也影响其体内HFRs等污染物的蓄积.鲫鱼因肠道较细、肠壁较薄,其对食物的机械性消化能力及食量均低于鲮鱼,也可能是鲫鱼体内HFRs较低的原因之一.然而,鲫鱼体内∑DPs含量却显著高于鲮鱼(图1(a)),可能与DP在水生食物链上具有较高的生物放大能力有关. 前期关于淡水食物网上DPs的营养级放大因子(TMF)研究发现,-DP和-DP在本池塘食物网中具有较大的生物放大能力(TMF分别为11.3和6.5)[14],而鲫鱼的营养级(TL=3.30)高于鲮鱼(TL= 3.07)[15].
2.2 鱼体中HFRs组成
鲮鱼和鲫鱼体内均以PBDEs为最主要的HFRs,两种鱼类PBDEs含量分别占∑HFRs含量(∑PBDEs、∑PBBs、∑DPs和∑ABFRs含量之和)的96.4%和88.7%(图2).然而,鲫鱼体内DPs的相对含量(7.3%)显著高于鲮鱼(1.0%)(检验,< 0.0001),可能是由于鲫鱼对DPs具有较大的生物放大能力.前期关于淡水食物网上DPs的营养级放大因子(TMF)研究发现,-DP和-DP在本池塘食物网中具有较大的生物放大能力(TMF分别为11.3和6.5)[14],而鲫鱼的营养级(TL = 3.30)高于鲮鱼(TL = 3.07)[15].与对照区相比,废弃电子垃圾拆解地鱼体内PBDEs相对含量较高,而ABFRs的相对含量较低(图2),表明近年来ABFRs在华南地区已替代PBDEs大量使用,这与前人的研究结果相符[16].最近的研究显示,ABFRs在全球范围内(如亚洲、欧洲和北美)广泛检出[17-20],其含量甚至超过了PBDEs,这类新型污染物的环境行为及其生态毒理学和健康效应应引起高度关注.
鲮鱼和鲫鱼均以BDE-28、BDE-47、BDE-100、BDE-153、BDE-154和BDE-209为主要的PBDE单体,这些单体的总含量约占∑PBDEs的97%(图3).鲮鱼和鲫鱼体内PBDEs组成模式与前期电子垃圾拆解地这些鱼体内PBDEs同系物组成报道相符[10-13].这种同系物组成模式与电子电器产品中添加的PBDE工业品同系物组成、PBDEs在环境及生物体内的降解及PBDE单体的生物蓄积能力有关[10-13,15].与鲮鱼相比,鲫鱼体内BDE-100和BDE-154的相对含量显著升高(检验,<0.0001),而BDE-28的相对含量显著降低(检验,<0.0001) (图4),可能与BDE-100和BDE-154在鲫鱼体内的生物放大能力较高而BDE-28的生物放大能力较低有关.前期研究证实[15],在本池塘水生生物食物网上, BDE-100和BDE-154的生物放大能力高于BDE-28.

图2 研究区和对照区鲮鱼和鲫鱼体内HFRs组成
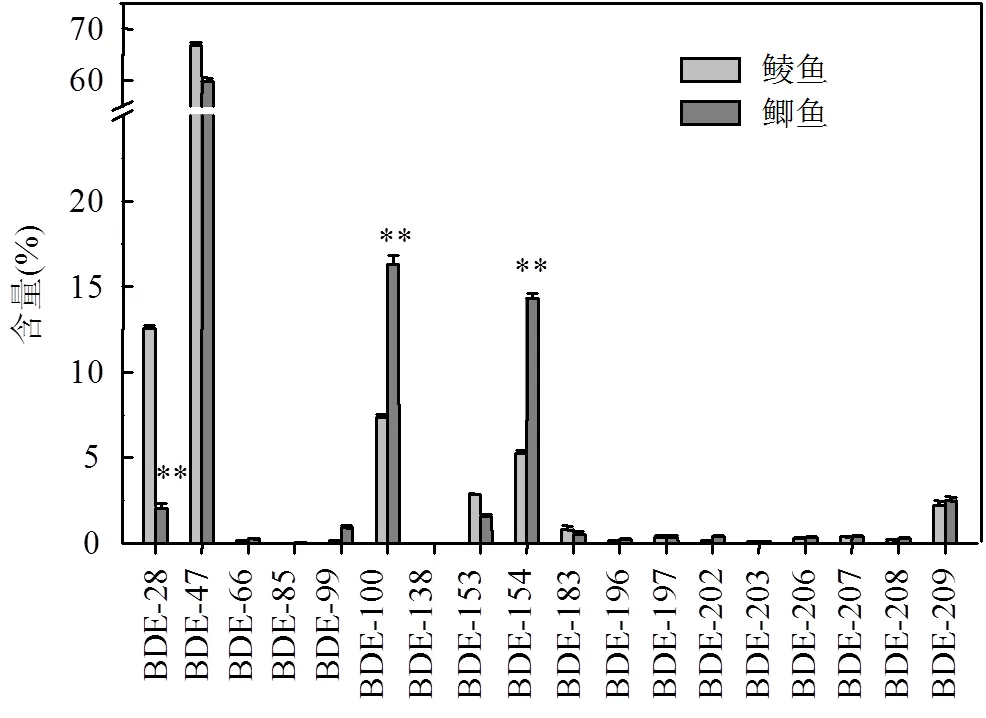
图3 研究区鲮鱼和鲫鱼体内PBDEs同系物组成
**<0.0001
本文采用anti(-DP与∑DPs的含量比值)表征鱼体内DP的异构体组成.废弃电子垃圾拆解地鲮鱼体内的anti值(均值:0.81)显著高于鲫鱼(均值:0.68)(检验,<0.0001)(图4),表明鲮鱼较鲫鱼对-DP具有更强的选择性蓄积作用.鲮鱼体内较高的anti值可能与其独特的生活习性及较低的营养级有关.前期研究证实,-DP因具有较-DP更大的辛醇-水分配系数(OW)而在水体底泥中选择性富集[21],鲮鱼的底层生活习性导致了其体内anti值相对较高.此外,我们的前期研究发现,鱼体内anti值与其营养级负相关[14],鲮鱼较鲫鱼相对较低的营养级也可能是其体内anti值较高的原因.与对照区相比,废弃电子垃圾拆解地鲮鱼体内anti值显著升高(检验,= 0.001),而鲫鱼体内anti值显著降低(= 0.001).废弃电子垃圾拆解地与对照区鱼体内anti值的差异可能与不同样点鱼体内∑DPs含量有关.anti值与∑DPs含量的相关分析结果显示,鲮鱼体内anti值与∑DPs负相关(= -0.57,= 0.09),而鲫鱼呈显著的正相关关系(= 0.81,= 0.004)(图5).电子垃圾拆解地鱼体内较高的DPs含量可能导致了该地鲮鱼体内较高的anti值和鲫鱼体内较低的anti值.前人的研究也发现鱼类及鸟类体内DP的anti值与∑DPs含量具有相关性[22–24],但不同物种及不同∑DPs含量范围对anti值的影响不尽相同.
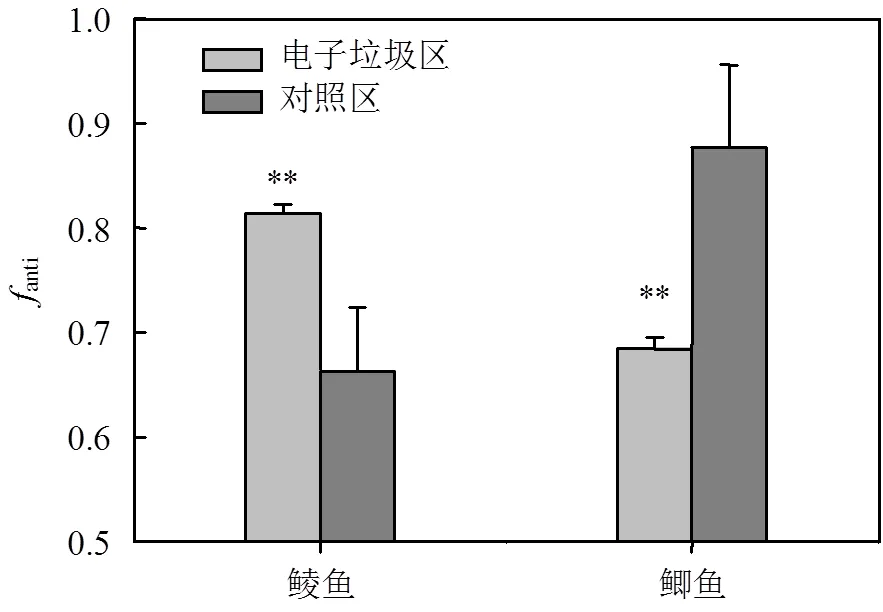
图4 研究区和对照区鲮鱼和鲫鱼体内anti-DP的相对含量(fanti)
**< 0.0001
鱼体内ABFRs以DBDPE、HBB和BTBPE为主,其含量之和占∑ABFRs含量的96%以上(图6).前人的研究也发现,DBDPE和BTBPE是电子垃圾拆解地生物体内主要的ABFRs[10,25-26],可能与DBDPE和BTBPE是PBDEs的主要替代品有关.两种鱼类对ABFRs的蓄积存在种间差异性:鲮鱼体内DBDBE相对含量显著高于鲫鱼(检验,<0.0001),而BTBPE和HBB的相对含量却显著低于鲫鱼(检验,<0.05)(图6).鲮鱼和鲫鱼对这些ABFRs的种间差异性蓄积可能与这两种鱼类不同的生活习性及营养级有关.DBDPE是一种极端憎水的有机物,其在水体中主要分布于沉积物中[4].鲮鱼的水体底层生活习性使得其较鲫鱼对DBDPE的高蓄积.BTBPE和HBB的logOW值分别为7.8和7.07[27],化合物在这一OW范围通常具有较强的生物放大能力[15],从而导致较高营养级的鲫鱼体内这些化合物的相对含量较高.
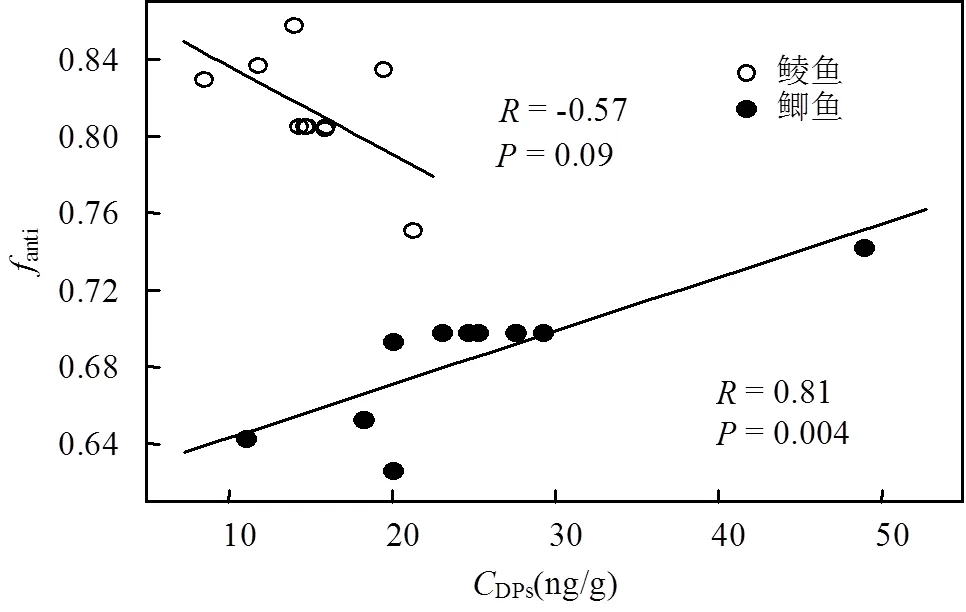
图5 鲮鱼和鲫鱼的fanti值与DP总含量(CDPs)的相关性

图6 废弃电子垃圾拆解地鲮鱼和鲫鱼体内ABFRs组成
*< 0.05, **<0.0001
2.3 生态风险评估
我国尚无野生鱼类HFRs含量标准.本文根据加拿大联邦环境质量指南(CFEQG)中关于野生鱼体内PBDEs含量标准及鱼体内PBDEs含量对食鱼野生动物产生危害的含量标准[28],计算了废弃电子垃圾拆解地鲮鱼和鲫鱼体内PBDEs中值含量和第95个百分位含量的危害熵值(HQ),评估PBDEs中值暴露和高值暴露对野生鱼类及对食鱼野生动物的生态风险.HQ按式(1)计算
HQ=BDE/FEGQBDE(1)
式中:BDE和FEGQBDE分别为鱼体内某PBDE单体含量和该化合物的含量标准(FEQG).当HQ <1时,表示风险较低;1< HQ < 10时,表明有一定风险;当HQ >10时,表明具有较高生态风险.
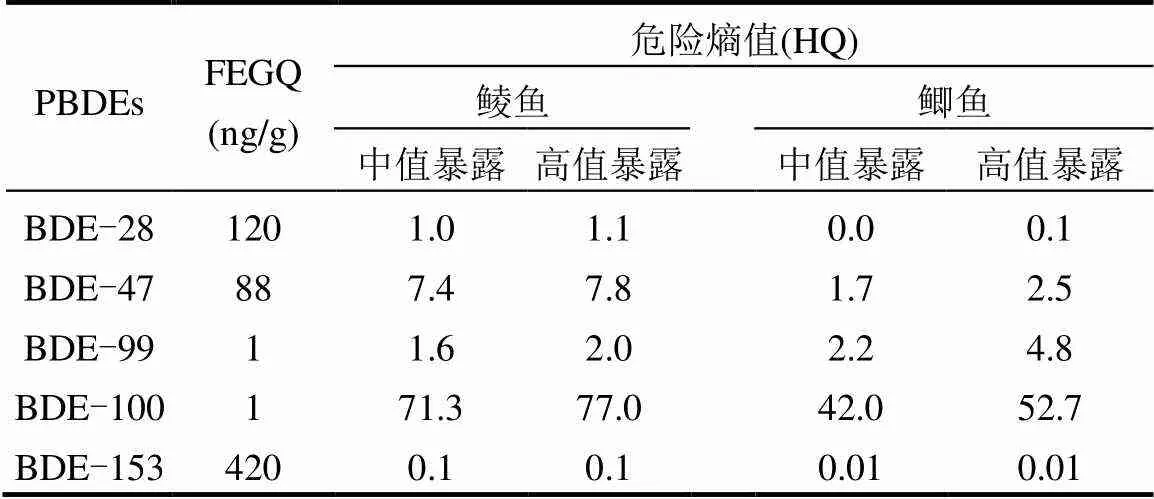
表2 废弃电子垃圾拆解地野生鲮鱼和鲫鱼PBDEs暴露的危害熵值(HQ)
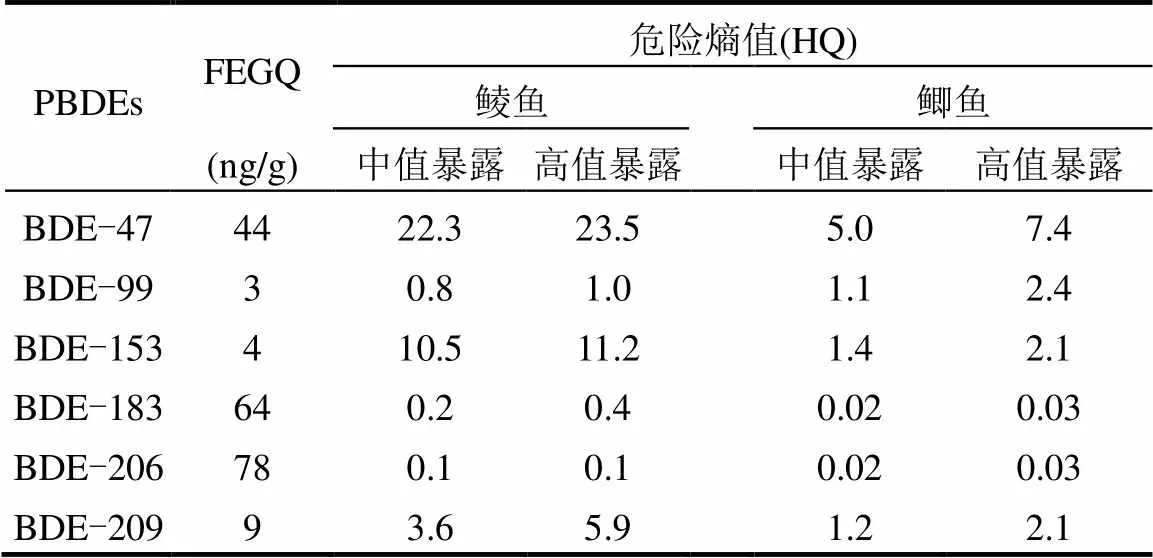
表3 废弃电子垃圾拆解地野生鱼体内PBDEs对食鱼野生动物的危害熵值(HQ)
结果显示,废弃电子垃圾拆解地野生鲮鱼和鲫鱼BDE-47和BDE-99暴露对鱼体健康有一定风险(HQ:1.7~7.8),而BDE-100暴露具有较高生态风险(HQ:42~77)(表2).鲮鱼体内BDE-209含量对食鱼野生动物具有一定生态风险(中值暴露和高端暴露HQ分别为3.6和5.9),而BDE-47和BDE-153含量对食鱼野生动物具有较大生态风险(HQ值为10.5~23.5) (表3).鲫鱼体内BDE-47、BDE-99、BDE-153和BDE-209含量对食鱼野生动物均具有一定生态风险(HQ:1.1~7.4)(表3).
3 结论
3.1 废弃电子垃圾拆解地野生鲮鱼和鲫鱼体内HFRs的含量范围分别为1230~1680和141~650ng/g,高于对照区1~2个数量级.这一结果表明,尽管粗犷的电子垃圾回收活动已禁止多年,当地野生鱼类仍然受到这些HFRs严重污染.
3.2 鲮鱼体内PBDEs、PBB和ABFRs含量均显著高于鲫鱼,但DPs含量显著低于鲫鱼.此外,两种鱼体内PBDEs、DP及ABFRs组成不尽相同.HFRs在鱼体内的种间差异性蓄积与两种鱼类不同的生活习性、营养级及脂肪含量不同有关.
3.3 鲮鱼和鲫鱼体内的BDE-47和BDE-100对鱼类(HQ = 1.7~77)具有较高的生态风险,鱼体内BDE-47、BDE-153和BDE-209对食鱼野生动物也具有较大生态风险(HQ = 1.2~23.5).这些废弃场地的生态修复及管理应引起关注.
[1] Alaee M, Arias P, Sjödin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release [J]. Environment International, 2003,29:683–689.
[2] POPs Review Committee. Proposal to list Dechlorane Plus (CAS No. 13560-89-9) and its syn-isomer (CAS No. 135821-03-3) and anti- isomer (CAS No. 135821-74-8) in Annexes A, B and/or C to the Stockholm Convention on Persistent Organic Pollutants [R]. POPs Review Committee, 2019.
[3] Covaci A, Harrad S, Abdallah M A E, et al. Novel brominated flame retardants: A review of their analysis, environmental fate and behaviour [J]. Environment International, 2011,37:532–556.
[4] Xiong P, Yan X, Zhu Q, et al. A review of environmental occurrence, fate, and toxicity of novel brominated flame retardants [J]. Environmental Science & Technology, 2019,53:13551–13569.
[5] 王 涛,陶 林,曾 源,等.工业园及电子垃圾区大气中的溴代阻燃剂(BFRs) [J]. 中国环境科学, 2019,39(9):3691–3700. Wang T, Tao L, Zeng Y, et al. Brominated flame retardants (BFRs) in the atmosphere of urban and e-waste recycling regions in South China: concentrations, distributions, compositions, and emission [J]. China Environmental Science, 2019,39(9):3691–3700.
[6] Wu Q, Leung J Y S, Du Y, et al. Trace metals in e-waste lead to serious health risk through consumption of rice growing near an abandoned e-waste recycling site: Comparisons with PBDEs and AHFRs [J]. Environmental Pollution, 2019,247:46-54.
[7] Horri K, Alfonso S, Cousin X, et al. Fish life-history traits are affected after chronic dietary exposure to an environmentally realistic marine mixture of PCBs and PBDEs [J]. Science of the Total Environment, 2018,610:531–545.
[8] Hamilton P B, Cowx I G, Oleksiak M F, et al. Population-level consequences for wild fish exposed to sublethal concentrations of chemicals – a critical review [J]. Fish Fishery, 2015,17:545–566.
[9] Lynch A J, Cooke S J, Deines A M, et al. The social, economic, and environmental importance of inland fish and fisheries [J]. Environmental Reviews, 2006,24:1–7.
[10] Tao L, Zhang Y, Wu J P, et al. Biomagnification of PBDEs and alternative brominated flame retardants in a predatory fish: Using fatty acid signature as a primer [J]. Environment International, 2019,127: 226–232.
[11] Sun R X, Luo X J, Tang B, et al. Persistent halogenated compounds in fish from rivers in the Pearl River Delta, South China: Geographical pattern and implications for anthropogenic effects on the environment [J]. Environmental Research, 2016,146:371–378.
[12] Wu J P, Luo X J, Zhang Y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China [J]. Environment International, 2008,34:1109–1113.
[13] Zeng Y H, Luo X J, Yu L H, et al. Using compound-specific stable carbon isotope analysis to trace metabolism and trophic transfer of PCBs and PBDEs in fish from an e-waste site, South China [J]. Environmental Science & Technology, 2013,47:4062–4068.
[14] Wu J P, Zhang Y, Luo X J, et al. Isomer-specific bioaccumulation and trophic transfer of Dechlorane Plus in the freshwater food web from a highly contaminated site, South China [J]. Environmental Science & Technology, 2010,44:606–611.
[15] Wu J P, Luo X J, Zhang Y, et al. Biomagnification of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls in a highly contaminated freshwater food web from South China [J]. Environmental Pollution, 2009,157:904–909.
[16] Zhu B, Lai N L S, Wai T C, et al. Changes of accumulation profiles from PBDEs to brominated and chlorinated alternatives in marine mammals from the South China Sea [J]. Environment International, 2014,66:65–70.
[17] Lee H K, Lee S, Lim J E, et al. Legacy and novel flame retardants in water and sediment from highly industrialized bays of Korea: Occurrence, source tracking, decadal time trend, and ecological risks [J]. Marine Pollution Bulletin, 2020,16:111639.
[18] Peng C, Tian H, Guo Y, et al. Emerging and legacy flame retardants in indoor dust from East China [J]. Chemosphere, 2017,186:635–643.
[19] Chen Y, Cao Z, Covaci A, et al. Novel and legacy flame retardants in paired human fingernails and indoor dust samples [J]. Environment International, 2019,133:105227.
[20] Dodson R, Rodgers K M, Carey G, et al. Flame Retardant Chemicals in College Dormitories: Flammability Standards Influence Dust Concentrations [J]. Environmental Science & Technology, 2017,51: 4860–4869.
[21] Zhang Y, Wu J P, Luo X J, et al. Biota-sediment accumulation factors for Dechlorane Plus in bottom fish from an electronic waste recycling site, South China [J]. Environment International, 2011,37:1357–1361.
[22] Wu J P, She Y Z, Zhang Y, et al. Sex-dependent accumulation and maternal transfer of Dechlorane Plus flame retardant in fish from an electronic waste recycling site in South China [J]. Environmental Pollution, 2013,177:150–155.
[23] Mo L, Wu J P, Luo X J, et al. Dechlorane Plus flame retardant in kingfishers (Alcedo atthis) from an electronic waste recycling site and a reference site in South China: Influence of residue levels on the isomeric compositions [J]. Environmental Pollution, 2013,174:57–62.
[24] Peng Y, Wu J P, Tao L, et al. Accumulation of Dechlorane Plus flame retardant in terrestrial passerines from a nature reserve in South China: The influences of biological and chemical variables [J]. Science of the Total Environment, 2015,514:77–82.
[25] Liu Y, Luo X J, Huang L Q, et al. Halogenated organic pollutants in aquatic, amphibious, and terrestrial organisms from an e-waste site: habitat-dependent accumulation and maternal transfer in watersnake [J]. Environmental Pollution, 2018,241:1063–1070.
[26] Wu J P, Wu S K, Tao L, et al. Bioaccumulation characteristics of PBDEs and alternative brominated flame retardants in a wild frog-eating snake [J]. Environmental Pollution, 2020,258:113661.
[27] Wu J P, Guan Y T, Zhang Y, et al. Several current-use, non-PBDE brominated flame retardants are highly bioaccumulative: Evidence from field determined bioaccumulation factors [J]. Environment International, 2011,37:210–215.
[28] Environment Canada. Canadian Environmental Protection Act, 1999. Federal Environmental Quality Guidelines. Polybrominated Diphenyl Ethers (PBDEs): En84-91/2013E-PDF [R]. 2013.
Residues of halogenated flame retardants in wild fish from an abandoned e-waste site in South China.
WU Jiang-ping1*, FENG Wen-lu1, WU Si-kang1, HU Yu1, MAI Bi-xian2
(1.School of Ecology and Environment, Anhui Normal University, Wuhu 241002, China;2.Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China)., 2021,41(4):1886~1892
Due to its serious environmental pollution, crude e-waste dismantling has been banned in China, leaving many abandoned e-waste sites. However, the levels and the ecological risks of e-waste derived contaminants in these sites were not fully understood. In the present study, the concentrations of several halogenated flame retardants (HFRs), including polybrominated diphenyl ethers (PBDEs), polybrominated biphenyls (PBBs), Dechlorane Plus (DP) and alternative brominated flame retardants (ABFRs), were examined in wild mud carps and crucian carps collected from an abandoned e-waste site in South China. The concentrations of ∑HFRs in mud carps and crucian carps ranged from 1230 to 1680ng/g and from 141 to 650ng/g, respectively. These concentrations were 1~2 orders of magnitude higher than those detected in the same species from a reference site, suggesting heavy contamination of HFRs, despite of the fact that primitive e-waste recycling has been regulated for several years. Among the HFRs measured, PBDEs were detected at the highest concentrations contributing 96% and 89% to ∑HFRs in mud carp and crucian carp, respectively. There were significant differences in both the concentrations, and compositions of HFRs between mud carp and crucian carp, possibly resulting from the differences in the feeding habits, trophic level and lipid content between the two fish species. The result of risk assessment showed that PBDEs posed an important risk both for the fish and for piscivorous wildlife.
halogenated flame retardants;PBDEs;e-waste;wild fish;ecological risk
X503.225
A
1000-6923(2021)04-1886-07
吴江平(1976-),男,安徽南陵人,副教授,博士,主要从事持久性有毒物质的环境化学行为及其生态毒理学效应研究.发表论文50余篇.
2020-08-25
国家自然科学基金资助项目(22076002);安徽省自然科学基金资助项目(2008085MD123)
* 责任作者, 副教授, jpwu@ahnu.edu.cn

